绿原酸缓解Aβ诱导的阿尔茨海默病小鼠神经损伤及NLRP3炎症小体活化①
刘 帆 何 琴 王鸿利 黄 丹 杨文娟
(四川省医学科学院·四川省人民医院草堂病区老年内五科,成都610072)
阿尔茨海默病(Alzheimer's disease,AD)是一种神经退行性疾病,主要表现为记忆、认知和行为衰退,最终导致死亡[1]。目前研究表明,AD 病理特点为胞外amyloid-β(Aβ)肽聚合,细胞内神经元纤维缠结和Tau 蛋白高度磷酸化[2]。Aβ 肽可以多种形式存在,如单体、低聚物或纤维状。越来越多证据表明,AD 发病机制为低聚物形式的Aβ 肽在胞外聚集[3-4]。目前AD 治疗药物主要为乙酰胆碱酯酶抑制剂(acetylcholinesterase inhibitors,AChEIs)和n-甲基-d-天冬氨酸受体拮抗剂(N-methyl-D-aspartate,NMDA),但无法达到预期治疗效果,且存在危及生命的潜在副作用[5-6]。中药具有多成分、多靶点、多途径特点,在AD 治疗方面优于单靶点药物[7-8]。绿原酸具有多种生物效应,包括抗菌、抗氧化、抗炎、抗癌、抗糖尿病、抗高血压、抗肥胖等作用[9-11]。已有研究表明,绿原酸发挥神经保护作用的可能机制是通过抑制乙酰胆碱和丁酰胆碱活性,从而减缓脑内乙酰胆碱和丁酰胆碱破坏,防止氧化性神经退行性变[12]。因此,本文主要研究绿原酸对Aβ 诱导的AD神经损伤及NLRP3炎症小体活化的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性昆明小鼠(5~6 周龄)购于四川省医学科学院,四川省人民医院实验动物研究所,许可证号:SCXK(川)2018-110。 22℃、50%相对湿度,12 h光/12 h暗循环饲养,自由饮食饮水,适应性喂养1周进行后续试验。
1.1.2 主要试剂与仪器 5-HT、5-HIAA、iNOS、IL-6和TNF-α 试剂盒购自南京建成生物研究所;BCA 试剂盒购自合肥莱尔生物科技有限公司;蛋白提取试剂盒购自Promega 公司;所有抗体均购自上海艾博抗生物科技有限公司;绿原酸购自成都曼斯特生物有限公司;BX43 光学显微镜购自日本奥林巴斯;酶标仪(Bio-Rad,Hercules,CA,USA)。
1.2 方法
1.2.1 AD 小鼠模型建立及治疗 参考文献[13]制备低聚Aβ1-42溶液,PBS 溶解,使用前37℃孵化72 h。小鼠腹腔注射氯胺酮(80 mg/kg)和二甲苯(20 mg/kg)进行麻醉。孵化72 h 后,采用1 L 汉密尔顿注射器将Aβ1-42注射于小鼠双侧大脑海马体(1.0 L,0.1 L/min)构建AD 小鼠模型[14]。AD 小鼠随机分为5 组:对照组、模型组、绿原酸低、中、高剂量治疗组(20、50、100 mg/kg)[15]。模型建立第15 天口服给予小鼠绿原酸,连续21 d,对照组口服等体积0.5%羧甲基纤维素钠溶液。
1.2.2 神经损伤评分 各组小鼠建模15 d 后进行神经损伤评分,具体参考Longa 神经评分法[16]。0 分:正常,无神经损伤;1 分:左侧前爪不能完全伸展,轻度神经损伤;2 分:行走时,小鼠向瘫痪侧转圈,中度神经功能缺损;3 分:行走时,小鼠身体向瘫痪侧倾倒,重度神经功能缺损;4 分:不能自发行走,有意识丧失[16]。
1.2.3 脑含水量检测 采用干湿重法测定小鼠脑组织含水量:取小鼠脑组织约100 mg,称重(湿重),110℃烘烤脑组织24 h 以上至恒重,称重(干重)。脑组织含水量(%)=(湿重−干重)/湿重×100%[17]。
1.2.4 HE 染色 处死小鼠,分离脑组织,石蜡包埋,连续切片(4 µm),HE 染色,中性树胶封片,显微镜下观察小鼠海马体。
1.2.5 Western blot 脑组织加入液氮研磨,裂解缓冲液裂解,4℃、14000 r/min 离心15 min,形成浓缩蛋白。取20 µg 总蛋白进行12%SDS-PAGE 凝胶电泳,转至PVDF 膜,37℃下5%牛血清白蛋白封闭1 h,加入抗神经营养因子(anti neurotrophinic factor,NGF)、NLRP3、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、ASC 和IL-1β 4℃过夜。TBST 洗涤(含Tween-20的Tris缓冲盐水),加入辣根过氧化物酶标记的山羊抗兔IgG(二抗)37℃反应1 h,洗膜,ECL曝光,Quantity one 软件分析蛋白条带灰度值。
1.2.6 ELISA 按照试剂说明书,测量血清中细胞因子5-HT、5-HIAA、iNOS、IL-6 和TNF-α 表达。Bio-Rad 酶标仪测定光密度。采用ELISA 试剂盒提供的细胞因子标准品建立标准曲线。
1.3 统计学分析 采用SPSS22.0 软件进行统计学分析,数据以±s表示,多重性比较采用Duncan 法,P<0.05 为差异具有统计学意义。
2 结果
2.1 绿原酸对Aβ 诱导的AD 小鼠神经损伤及脑含水量的影响 神经损伤评分结果表明,Aβ 诱导的AD 小鼠神经损伤评分为(2.73±0.40)分,绿原酸治疗后,小鼠神经损伤程度显著下调(P<0.05)。脑含水量检测结果表明,Aβ 诱导的AD 小鼠脑含水量为(88.61±6.38)%,绿原酸治疗后小鼠脑含水量显著下调(P<0.05,图1)。

图1 小鼠神经损伤评分及脑含水量Fig.1 Neurologic deficit score and cerebral water content of mice
2.2 绿原酸对Aβ 诱导的AD 小鼠海马体病理损伤的影响 HE 染色结果表明,模型组小鼠海马体椎体细胞神经元萎缩,细胞空泡化,细胞疏松。绿原酸治疗后,小鼠上述情况明显缓解(图2)。
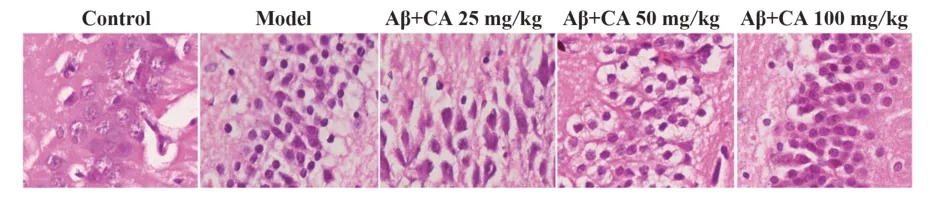
图2 HE染色观察小鼠海马体病理学变化(×400)Fig.2 Hippocampus pathology of mice detected by HE staining(×400)
2.3 绿原酸对Aβ 诱导的AD 小鼠BDNF、NGF、5-HT 和5-HIAA 表达的影响 Western blot 结果表明,模型组小鼠神经营养因子BDNF 和NGF 表达下调(P<0.05),绿原酸治疗后,BDNF和NGF蛋白表达显著上调(P<0.05)。ELISA 结果表明,模型组小鼠5-HT 和5-HIAA 表达显著下调(P<0.05),绿原酸治疗后,5-HT和5-HIAA表达上调(P<0.05,图3)。

图3 小鼠脑组织中BDNF、NGF、5-HT 和5-HIAA 蛋白表达Fig.3 Protein expressions of BDNF,NGF,5-HT and 5-HIAA in mice brain tissue
2.4 绿原酸对Aβ 诱导的AD 小鼠细胞因子的影响 ELISA 结果表明,模型组小鼠外周血中促炎因子iNOS、IL-6 和TNF-α 表达显著上调(P<0.01),绿原酸治疗后,外周血中促炎因子iNOS、IL-6和TNF-α表达下调(P<0.01,图4)。
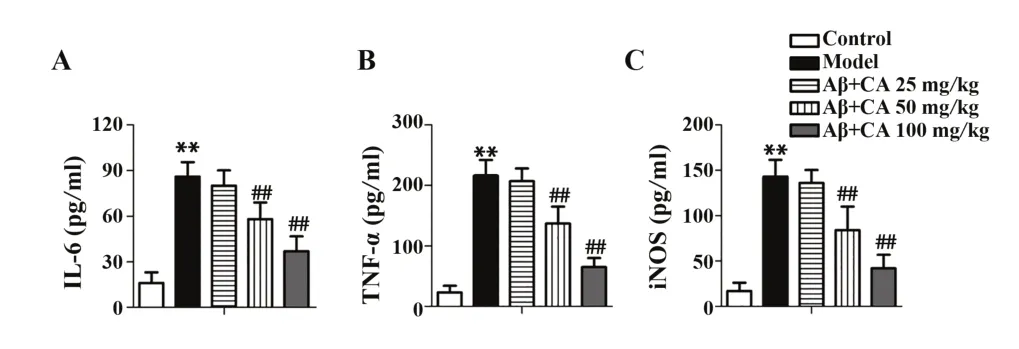
图4 小鼠外周血细胞因子表达Fig.4 Cytokine expressions in peripheral blood of mice
2.5 绿原酸对Aβ诱导的AD 小鼠NLRP3炎症小体活化的影响 Western blot 结果表明,模型组小鼠NLRP3、ASC 和IL-1β 表达显著上调(P<0.05),绿原酸治疗后,NLRP3、ASC 和IL-1β 蛋白表达显著下调(P<0.05,图5)。

图5 小鼠脑组织中NLRP3、ASC和IL-1β蛋白表达Fig.5 Protein expressions of NLRP3,ASC and IL-1β in mice brain tissue
3 讨论
AD 是一种复杂的神经退行性疾病。本研究采用绿原酸治疗后,Aβ 诱导的AD 小鼠神经损伤程度显著下调,脑含水量显著下调。半边花丁醇治疗可改善AD 相关认知和行为障碍[18]。已有研究表明,绿原酸可通过阻止酒精诱导的大鼠嗜铬细胞瘤PC12 细胞凋亡,从而提高细胞活力和促进细胞分化[19]。绿原酸可通过调节炎症因子、缺氧因子和神经生长因子保护局灶性脑缺血再灌注损伤大鼠[20]。绿原酸对脑缺血再灌注损伤大鼠具有神经保护作用,主要通过调节氧化应激相关的Nrf2 通路发挥作用[21]。研究表明,绿原酸可预防APP/PS2 转基因AD 小鼠认知能力障碍并减少Aβ 斑块沉积,说明绿原酸对脑组织具有保护作用[22]。
本研究中模型组小鼠神经营养因子BDNF 和NGF 蛋白表达显著下调,绿原酸治疗后BDNF 和NGF 蛋白表达显著上调,同时模型组小鼠5-HT 和5-HIAA表达显著下调,绿原酸治疗后,5-HT和5-HIAA表达均上调。已有研究表明,AD中NGF和BDNF水平下降,尤其在AD 早期,这两种神经细胞因子由于NGF 代谢改变和胆碱能突触损失而缺失[23]。5-HT参与AD病理过程,AD患者血清中5-HT表达显著下调[24]。5-HIAA可诱导脑啡肽酶改善AD小鼠记忆能力,促进内肽酶脑啡肽酶生成,从而缓解AD 症状[25]。本研究表明,绿原酸可促进BDNF、NGF、5-HT和5-HIAA上调,从而缓解AD小鼠症状。
炎症反应是机体对外来伤害性刺激的一种防御反应,适度炎症反应对机体起保护作用。但颅脑损伤等强烈刺激导致机体产生过量炎症因子,炎症反应级联放大,甚至失控,破坏微环境稳定和机体平衡,导致细胞死亡和功能缺失,且可能长期存在慢性神经炎症反应[26]。敲除AD 小鼠NLRP3可促进小胶质细胞抗炎作用,有利于小胶质细胞清除Aβ蛋白[27]。本研究中模型组促炎因子iNOS、IL-6 和TNF-α 表达显著上调,绿原酸治疗后,3 种促炎因子表达显著下调。同时模型组NLRP3、ASC 和IL-1β表达显著上调,绿原酸治疗后,NLRP3、ASC 和IL-1β蛋白表达显著下调。最近研究表明,炎症可能与神经退行性痴呆有关。细胞免疫成分,如小胶质细胞或星形胶质细胞,可介导炎症分子释放,包括TNF、生长因子、黏附分子或趋化因子[28]。虽然炎症在AD发病机制中的作用尚未明确,但IL-1β、IL-6、TNF-α等炎症因子已被证实参与AD 发病机制。虽然免疫系统有助于保护大脑,但免疫分子失衡也可能在神经退行性疾病中发挥重要作用[29-30]。炎症小体组成部分NLRP1、NLRP3、ASC 和caspase-1,以及下游效应器IL-1β 和IL-18 等在AD 患者mRNA 和蛋白水平均显著上调[31]。Aβ 可激活小神经胶质细胞NLRP3炎症小体的机理是Aβ 促进IL-1β 成熟,激活一系列炎症活动。研究表明,NLRP3 炎症小体缺失可诱导小胶质细胞向M2 表型转变从而减少Aβ 在AD 模型中的沉积[32]。已有研究表明,急性肝损伤中绿原酸可抑制NLRP3 炎症小体激活,降低Pro-caspase-1、caspase-1、Pro-IL-1β 和IL-1β 蛋白表达。此外,绿原酸还可降低血清和肝脏TNF-α、IL-6 和IL-1β mRNA表达,与本研究结果一致[33]。绿原酸可能通过降低焦虑相关神经递质表达,改善咪喹莫特诱导的银屑病样小鼠焦虑行为,抑制皮肤炎症反应[34]。杜仲绿原酸通过抑制NF- κB P65 活化减弱LPS 诱导的HRECs 细胞凋亡和炎症反应[35]。本研究表明,绿原酸可抑制Aβ 诱导的AD 炎症反应,从而发挥神经保护作用。
综上所述,本研究发现绿原酸可缓解Aβ 诱导的AD 小鼠神经损伤,抑制炎症反应,激活NLRP3炎症小体。本研究仅为体内试验的初步探讨,绿原酸具有AD 治疗效果,为进一步研究绿原酸药理学功能提供依据。

