miR-194靶向Bmi-1调控PI3K/Akt信号通路对脑胶质瘤细胞迁移和凋亡的影响①
田少辉 张学浩 徐江龙 乔晓霞 张雨豪
(河北大学附属医院神经外科,保定071000)
脑胶质瘤是最常见的颅内恶性肿瘤,虽然发病率较低,但恶性程度较高,严重威胁人类健康[1]。脑胶质瘤具有恶性程度高、扩展性生长并向周围组织浸润的特点,临床常采用手术、放化疗治疗,但均无法彻底清除肿瘤组织,导致患者免疫功能低下甚至复发,致残率和致死率较高。因此,寻找有效且不良反应较小的药物及治疗方法至关重要。
微小RNA(microRNA,miRNA)是一类非编码单链小分子RNA,长度19~25个核苷酸,通过与靶基因miRNA 的3'非翻译区结合调控基因转录后表达,参与调节细胞的生理和病理过程,包括细胞增殖、分化、凋亡及激素生物合成和分泌[2-3]。研究证实,miR-194 参与调控非小细胞肺癌、结直肠癌、胃癌等细胞增殖与迁移,但其在脑胶质瘤中的研究较少[4-6]。
Bmi-1(B-lymphoma moloney murine leukemia vi‐rus insertion region-1)属于多梳蛋白家族,在干细胞自我更新、细胞增殖、周期调控和抗凋亡调节等方面具有重要作用。Bmi-1 在多种癌症中表达上调,因此被认为是癌基因,包括在神经胶质瘤中[7-9]。PI3K/Akt 途径在各种生物学过程中均具有重要功能,且PI3K 信号传导异常对多种疾病均有影响,包括糖尿病、帕金森病、癌症等[10-12]。研究发现,Bmi-1通过激活PI3K/AKT 信号途径促进胰腺癌干细胞侵袭和转移[13],但Bmi-1 介导PI3K/Akt 信号途径对胶质瘤细胞的研究较少。因此,本研究探讨miR-194通过靶向Bmi-1调控PI3K/Akt信号通路对脑胶质瘤细胞迁移和凋亡的影响,为脑胶质瘤临床治疗提供新靶点。
1 材料与方法
1.1 材料
1.1.1 临床样本 所有脑胶质瘤组织(30 例)和相应的癌旁非肿瘤组织(30 例)均来自我院接受脑胶质瘤切除手术的患者。所有患者手术前接受化学治疗,术后进行病理诊断。所有患者知情同意,所有实验经我院伦理委员会批准与监督。各组织标本保存于液氮中直至使用。
1.1.2 细胞 正常星形胶质HA1800 细胞株、脑胶质瘤细胞株(U251、U87、LN229)购自中国科学院上海细胞生物学研究所。
1.1.3 试剂 DMEM 培养基和胎牛血清购自美国Gibco 公司;TRIzol 试剂、PrimeScriptTMRT Reagen Kit试剂盒、PrimeScriptTM1st Strand cDNA Synthesis 试剂盒和SYBR®Premix EX TaqTMⅡ试剂盒购自日本Ta‐KaRa 公司;NC mimics、miR-194 mimics、NC inhibi‐tor、miR-194 inhibitor、pcDNA/NC、pcDNA/Bmi-1、si-NC 和si-Bmi-1购自上海吉玛制药技术有限公司;Li‐pofectamineTM3000 购自美国Invitrogen 公司;免疫组织化学试剂盒购自北京索莱宝科技有限公司;pmir‐GLO 载体、双荧光素酶活性检测试剂盒购自美国promega 公司;Annexin V-FITC/PI 试剂盒、RIPA 裂解液和BCA 试剂盒购自美国Abcam 公司;T 兔抗Bmi-1 抗体、兔抗p-PI3K 抗体、兔抗PI3K 抗体、兔抗p-Akt 抗体、兔抗Akt 抗体、兔抗β-actin 和山羊抗兔IgG购自美国Cell Signaling Technology 公司。
1.2 方法
1.2.1 细胞培养 HA1800 细胞、U251 细胞、U87细胞和LN229 细胞采用含10% 胎牛血清的DMEM培养基培养,37℃、5%CO2,0.25% 胰蛋白酶消化传代,2 d更换1次培养基,以保证细胞所需营养成分。
1.2.2 细胞转染 按照LipofectamineTM3000 转染试剂说明书将NC mimics、miR-194 mimics、NC in‐hibitor、miR-145 inhibitor 分别转入U251 细胞,转染终浓度为100 nmol/L;将pcDNA/NC、pcDNA/Bmi-1、si-NC、si-Bmi-1 分别转入U251 细胞,转染终浓度为50 nmol/L;37℃、5%CO2培养6 h,更换新鲜培养基继续培养48 h,收集各组细胞进行后续实验。
1.2.3 qRT-PCR 采用TRIzol 试剂提取组织样本或细胞总RNA,紫外分光光度计检测总RNA纯度和含量,将各配对样品调节至相同浓度。采用Prime‐ScriptTMRT Reagen Kit 试剂盒将提取的RNA(miR‐NA)逆转录为cDNA,采用PrimeScriptTM1st Strand cDNA Synthesis 试剂盒将提取的RNA(mRNA)逆转录为cDNA。采用SYBR Premix EX TaqTMⅡ试剂盒进行qRT-PCR,FTC-3000p 实时PCR 系统完成实验,2−ΔΔCt法分析数据,引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.4 Transwell迁移实验 收集各组转染48 h细胞,胰酶消化,制成单细胞悬液,细胞密度为1×106个/ml。Transwell 小室上室加入细胞悬液100 µl,下室加入含10%FBS 的完全培养基500 µl,37℃、5%CO2、饱和湿度孵育8 h,取出聚碳酸酯微孔膜,中性甲醛固定,苏木素染色,显微镜下随机选取5个视野,统计穿膜细胞数,以穿膜细胞数表示细胞侵袭能力。
1.2.5 流式细胞术 收集各组转染48 h 细胞,离心,重悬于缓冲液,依次加入Annexin V-FITC 溶液(10 µl)和PI 溶液(10 µl)染色,室温下黑暗孵育30 min,FACS CaliburTM流式细胞仪分析。
1.2.6 免疫组织化学染色 组织于4% 多聚甲醛固定,包埋,制5 µm切片,脱蜡至水,3%过氧化氢溶液去除内源性过氧化物酶,3% 牛血清白蛋白封闭30 min。滴加一抗(Bmi-1 抗体)4℃孵育过夜,滴加二抗(HRP 标记的山羊抗兔)室温孵育1 h。DAB 显色,苏木素复染,中性树胶封片,显微镜下观察拍照,目标蛋白呈棕黄色则为阳性表达。
1.2.7 双荧光素酶报告基因 将预测得到含miR-914 结合位点的Bmi-13'UTR 片段插入pmirGLO,得到野生型Bmi-13'UTR 的报告基因载体Bmi-13'UTR wt。将靶序列进行突变得到突变型载体Bmi-13'UTR mut。 Bmi-13'UTR wt、Bmi-13'UTR mut 与miR-194 mimics 或NC mimics 共转染至U251 细胞,48 h 后双荧光素酶活性检测试剂盒测定U251 细胞荧光素酶活性。
1.2.9 Western blot RIPA 裂 解 液 提 取U251 细 胞总蛋白,BCA 法测定总蛋白,SDS-聚丙烯酰胺凝胶电泳分离蛋白,转至PVDF 膜,5% 脱脂奶室温封闭1 h,加 入p-PI3K 抗 体(1∶1000)、PI3K 抗 体(1∶1000)、p-Akt 抗体(1∶1000)、Akt 抗体(1∶1000)、β-catin 抗体(1∶2000)4℃孵育过夜。TBST 洗涤3 次,持续5 min,加入山羊抗兔IgG-HRP(1∶5000)孵育1 h,TBST 洗涤3 次,持续5 min。显影曝光,Image-Pro Plus图像分析系统分析蛋白条带灰度值。
1.3 统计学分析 采用SPSS19.0软件进行数据分析,正态分布数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-194 在脑胶质瘤组织和脑胶质瘤细胞中的表达 qRT-PCR 结果表明,与癌旁非肿瘤组织组相比,miR-194 在肿瘤组织中表达明显下调(P<0.01,图1A);与HA1800 细胞相比,3 个脑胶质瘤细胞中均观察到miR-194 呈低表达(P<0.05),其中,U251细胞中miR-194表达最低(P<0.001,图1B),因此,选择U251细胞进行后续实验。
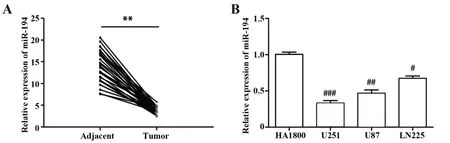
图1 miR-194在脑胶质瘤组织和脑胶质瘤细胞中的表达Fig.1 miR-194 expressions in glioma tissues and glioma cells
2.2 miR-194 对U251 细胞迁移能力的影响 Tran‐swell 迁移实验结果表明,与NC mimics 组相比,miR-194 mimics 组U251 细胞迁移数显著减少(P<0.001);与NC inhibitor 组相比,miR-194 inhibitor 组U251细胞迁移数明显增加(P<0.01,图2)。

图2 miR-194对U251细胞迁移能力的影响(×200)Fig.2 Effect of miR-194 on migration ability of U251 cells(×200)
2.3 miR-194 对U251 细胞凋亡率的影响 流式细胞术结果表明,与NC mimics组相比,miR-194 mimics组U251 细胞凋亡率上升(P<0.05);与NC inhibitor组相比,miR-194 inhibitor 组U251 细胞凋亡率下降(P<0.05,图3)。

Note:*.P<0.05.
2.4 Bmi-1 在脑胶质瘤组织和脑胶质瘤细胞中的表达 免疫组织化学结果表明,与癌旁非肿瘤组织相比,Bmi-1在肿瘤组织中阳性表达率明显上调(P<0.01 ,图4A);qRT-PCR结果表明,与HA1800细胞相比,U251细胞中Bmi-1表达明显上调(P<0.01,图4B)。
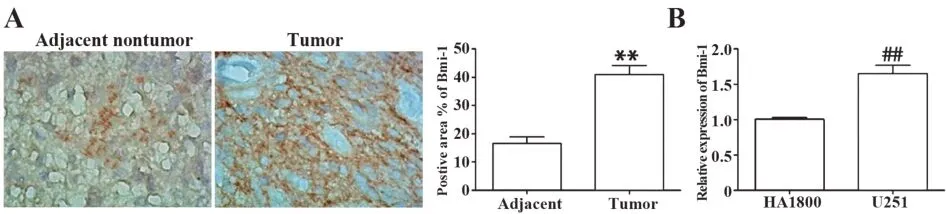
图4 Bmi-1在脑胶质瘤组织和脑胶质瘤细胞中的表达(×400)Fig.4 Bmi-1 expressions in glioma tissues and glioma cells(×400)
2.5 Bmi-1 是miR-194 的 靶 基 因 TargetScan 数 据库分析结果显示,Bmi-1 是miR-194 的候选目标(图5A)。双荧光素酶报告基因测定结果表明,miR-194 mimics 明显抑制携带Bmi-13'UTR wt 的荧光素酶活性(P<0.001,图5B),但报告质粒携带Bmi-13'UTR mut 时未观察到明显抑制作用(P>0.05)。
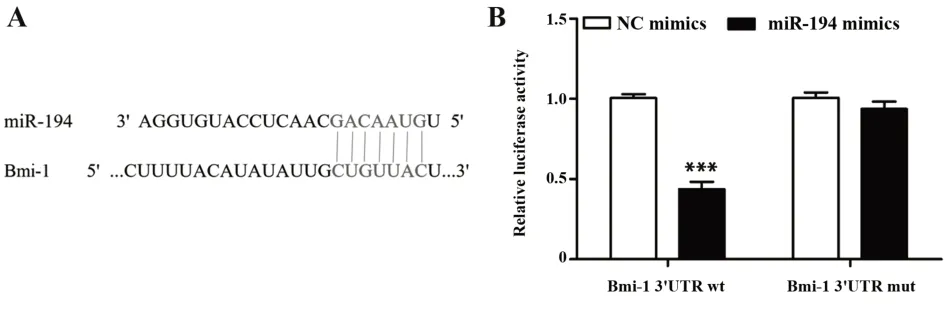
图5 Bmi-1与miR-194的靶相关系Fig.5 Targeting relationship between Bmi-1 and miR-194
2.6 miR-194与Bmi-1呈负调控 qRT-PCR 结果表明,与NC mimics组相比,miR-194 mimics组中Bmi-1表达明显下调(P<0.01),与NC inhibitor 组相比,miR-194 inhibitor 组中Bmi-1 表达明显上调(P<0.01);与PCDNA/NC 组相比,pcDNA/Bmi-1 组中miR-194表达显著下调(P<0.001),与si-NC 组相比,si-Bmi-1组中miR-194表达明显上调(P<0.01,图6)。

图6 miR-194与Bmi-1呈负调控Fig.6 miR-194 and Bmi-1 had a negative regulatory rela⁃tionship
2.7 miR-194 靶向Bmi-1 对U251 细胞迁移能力的影响 Transwell 迁移实验结果表明,与pcDNA/Bmi-1+NC mimics 组 相 比,pcDNA/Bmi-1+miR-194 mimics 组U251 细胞迁移数明显减少(P<0.01);与si-Bmi-1+NC inhibitor 组相比,si-Bmi-1+miR-194 in‐hibitor组U251细胞迁移数明显增加(P<0.01,图7)。
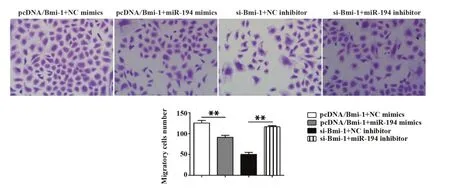
图7 miR-194 靶向Bmi-1 对U251 细胞迁移能力的影响(×200)Fig.7 Effect of miR-194 targeting Bmi-1 on migrationability of U251 cells(×200)
2.8 miR-194 靶向Bmi-1 对U251 细胞凋亡率的影响 流式细胞术结果显示,与pcDNA/Bmi-1+NC mimics 组 相 比,pcDNA/Bmi-1+miR-194 mimics 组U251 细胞凋亡率显著提高(P<0.001);与si-Bmi-1+NC inhibitor 组 相 比,si-Bmi-1+miR-194 inhibitor 组U251细胞凋亡率显著下降(P<0.001,图8)。

图8 miR-194靶向Bmi-1对U251细胞凋亡率的影响Fig.8 Effect of miR-194 targeting Bmi-1 on apoptosis rate of U251 cells
2.9 miR-194 靶向Bmi-1 对PI3K/Akt 通路相关蛋白的影响 Western blot结果表明,与pcDNA/Bmi-1+NC mimics 组相 比,pcDNA/Bmi-1+miR-194 mimics组中PI3K 蛋白磷酸化程度和Akt 蛋白磷酸化程度明显降低(P<0.01);与si-Bmi-1+NC inhibitor 组相比,si-Bmi-1+miR-194 inhibitor 组中PI3K 蛋白磷酸化程度和Akt 蛋白磷酸化程度明显增强(P<0.001,P<0.01,图9)。

图9 miR-194靶向Bmi-1对PI3K/Akt通路相关蛋白的影响Fig.9 Effect of miR-194 targeting Bmi-1 on PI3K/Akt pathway-related proteins
3 讨论
脑胶质瘤占颅内恶性肿瘤的40%~60%,手术治疗生存期仅为12~18 个月[14]。目前胶质瘤临床常规治疗手段包括手术、放化疗等,疗效均已取得极大改善,但多数患者术后生存率仍未得到明显改善[15]。近年分子生物学发展对肿瘤基因诊断和治疗具有极大促进作用,但针对脑胶质瘤的分子靶向药物治疗尚未在临床得到广泛应用。寻找并鉴定具有抑制脑胶质瘤细胞增殖的小分子将为脑胶质瘤诊治提供新靶点。
miR-194 是miRNA 家族成员,可抑制多种肿瘤生长、分化、侵袭、迁移及凋亡。研究显示,miR-194在多种恶性肿瘤中异常表达,参与其分化、增殖和凋亡过程。如miR-194通过靶向NFAT5抑制高糖诱导的非小细胞肺癌细胞进程[16];miR-194 通过抑制RAP2B 抑制膀胱癌细胞增殖和侵袭[17]。本研究表明,miR-194 在脑胶质瘤组织和脑胶质瘤细胞中呈低表达,且过表达miR-194 抑制U251 细胞迁移、促进其凋亡。
Bmi-1 基因是PcG 家族核心成员之一,对胚胎期哺乳动物骨骼、造血及神经发育发挥重要作用。肿瘤细胞中,Bmi-1 呈高表达,促进肿瘤细胞不断更新为癌症干细胞,其表达与肿瘤发生、发展、侵袭、预后等病理指标相关[18-19]。本研究发现,Bmi-1在脑胶质瘤组织和脑胶质瘤细胞中呈高表达,过表达Bmi-1 导致U251 细胞迁移能力增加,凋亡率下降;且过表达miR-194 可逆转Bmi-1 过表达引起的U251细胞迁移能力增强,凋亡率下降。
PI3K/Akt 信号通路在脑胶质瘤细胞中过度活化,促进脑胶质瘤细胞侵袭、转移等[20]。本研究发现,PI3K/Akt 通路在Bmi-1过表达的脑胶质瘤细胞中被激活,且过表达miR-194可抑制PI3K/Akt通路激活。
综上所述,本研究验证了miR-194与Bmi-1的相互作用关系,过表达miR-194 抑制Bmi-1 表达,使PI3K 和Akt 蛋白磷酸化程度降低,从而抑制脑胶质瘤细胞迁移,促进其凋亡。因此,miR-194 有望成为脑胶质瘤治疗靶点。

