抗G17单链抗体-AP融合蛋白的构建、表达与鉴定①
邵艳宏 李天宁 黄伦辉 王文皓 魏琳纳 袁玉华 刘运德
(天津医科大学医学检验学院,天津300203)
胃癌(gastric carcinoma,GC)是全球最常见的恶性肿瘤之一[1]。流行病学数据显示,胃癌在全球癌症死亡人数中排名第二[2]。早期胃癌术后五年生存率为90%。胃癌初期无明显临床症状和体征,因此检出率很低。70%的患者首诊时,已发展为晚期疾病,总体预后较差[3]。因此,胃癌的早期发现和治疗至关重要。胃泌素是胃分泌的主要效应因子,主要以胃泌素17为主[4]。一些研究表明胃泌素17可作为胃癌的生物标志物。患者血液中胃泌素17含量异常预示其患胃癌的可能性增大。肿瘤消退则胃泌素17含量恢复正常[5-7]。因此迫切需要一种快速、灵敏且廉价的胃泌素检测方法。
传统的酶标记蛋白方法主要有戊二醛交联法和改良过的碘酸钠法[8]。他们的反应步骤较多,标记酶的状态难以控制,反应过程不确定性大。生成的产物不单一,较难纯化,质量评价难以进行[9]。蛋白标记率达不到百分之百,而且受人员技术影响,标记效果不稳定。本研究针对现有技术的不足,提供一种将抗体与标记酶的序列相连接的融合蛋白的方法,解决了现有标记方法中存在的上述问题。既简化实验步骤又监控反应过程,降低操作的技术要求,减小反应的不确定性。
单链抗体(scFv)是一段氨基酸残基构成的弹性短肽(linker),由抗体的重链可变区(VH)和轻链可变区(VL)连接而成[10]。因为他们没有传统抗体的恒定区片段,免疫原性降低[11]。在双抗体夹心法的ELISA中,应用scFv减少标本中异嗜性抗体对检测结果造成的假阳性或者假阴性影响。单链抗体是能与抗原结合的最小抗体片段。由于其结构简单、分子量小、无糖基化等特点,易于在大肠杆菌生产平台上制备,生产成本低。使其比全长单克隆抗体具有优势[12-13]。更重要的是,它可以与碱性磷酸酶(AP)偶联形成融合蛋白直接进行分析检测。
本研究在分子生物学的角度上将单链抗体与碱性磷酸酶通过一段柔性短肽偶联,利用原核表达系统表达出单链抗体融合蛋白。这是一种新型且灵敏度高,具有百分百标记率的自指示剂。无需再进行酶标抗体的制备,省去其繁琐的纯化过程[14]。
1 材料与方法
1.1 材料 抗G17单克隆抗体107和N33株和重组肽G17由本实验室保存;质粒载体pET-32a(+)购自金斯瑞生物有限公司;Rosetta(DE3)和BL21(DE3)购自世纪康维有限公司;限制性内切酶EcoRⅠ和HindⅢ购自索莱宝科技有限公司;His-tag蛋白纯化树脂和HRP标记的抗His鼠源单克隆抗体购自赛默飞世尔科技公司。
1.2 方法
1.2.1 质粒的构建 本研究先前已经通过分离患者外周血单个核细胞建立噬菌体抗体库。利用酶联免疫吸附试验进行生物淘洗,获得特异性抗体。通过进一步的测序确定抗体的VH和VL基因序列。碱性磷酸酶基因序列由GenBank获得(登录号NP_414917.2)。抗体与标记酶之间用GSSSSGSSSSGSSSS这一柔性短肽连接。由金斯瑞生物有限公司合成该基因并构建质粒。
1.2.2 质粒的鉴定 将收到的质粒转化到DH5α大肠杆菌中,通过扩大培养获取大量含有质粒的大肠杆菌。根据质粒提取说明书,提取质粒。用限制性内切酶EcoRⅠ和HindⅢ对质粒进行双酶切(20 µl体系,质粒6 µl,限制性内切酶EcoRⅠ和HindⅢ各2 µl,10×BSA 2 µl,10×NEB Buffer 2 µl,H2O 6 µl)。酶切效果用1%琼脂糖凝胶电泳进行验证,并使用Sanger法进行测序。
1.2.3 质粒的转化及抗体融合蛋白的表达 将测序正确的重组质粒转化到Rosetta(DE3)和BL21(DE3)感受态细胞中,平板划线挑取单克隆菌落。将挑取的菌落分别接种到含氨苄青霉素(工作浓度为50 µg/ml)的LB培养基中,37℃、220 r/min培养。采集标本经10%SDS-PAGE分析,用考马斯亮蓝R-250染色。
1.2.4 表达条件的优化 本实验共设置了18个分组,从不同的诱导温度(25℃、37℃),IPTG的浓度(0.5 mmol/L、1 mmol/L、2 mmol/L),诱导时间(2 h、4 h、6 h)3个方向,对蛋白的表达条件进行摸索。确定最佳表达条件使目的蛋白的可溶性产量最大化,方便后续实验的进行。
1.2.5 蛋白纯化 本实验采用固定化金属离子亲和层析(IMAC)技术纯化目标蛋白,用20 mmol/L咪唑、50 mmol/L磷酸 二氢钠(NaH2PO4·H2O)、300 mmol/L氯化钠(pH8.0)作为洗涤缓冲液,用250 mmol/L咪唑、50 mmol/L磷酸二氢钠、300 mmol/L氯化钠(pH8.0)作为洗脱缓冲液。非特异性结合蛋白用洗涤液洗涤。抗体与His-tag蛋白纯化树脂结合后用洗脱缓冲液洗脱。标记为洗脱物。采集的样品经10%SDS-PAGE分析,考马斯亮蓝R-250染色,用anti-his-hrp孵育PVDF膜,进行免疫印迹。
1.2.6 scFv-AP定量 采用BCA法测定目的蛋白浓度。将标准品倍比稀释绘制标准曲线,洗脱液调零。按说明书推荐,A∶B=50∶1制成AB混合液。每个样本两个复孔,每孔加10 µl蛋白和200 µl AB混合液。37℃避光显色30 min,使用synergy2多模微板阅读器读取562 nm处的光密度。根据标准曲线计算相应浓度。
1.2.7 scFv-AP活性测定 首先,将抗G17单克隆抗体N33包被在96孔酶联测定板,4℃下孵育过夜。第二天,用0.05%PBST在自动洗板机上洗涤微孔板。用0.05%PBST溶解BSA制成5%BSA封闭缓冲液。每个孔中加入250 µl封闭缓冲液,37℃下孵育2 h。然后将抗原缓冲液G17加入清洗过的微板中。37℃孵育2 h后,洗涤3次。然后用0.05%PBST清洁每个孔。将样品孔分为两组,一组是传统的ELISA夹心模式为对照组,另一组为用scFv-AP直接检测的实验组。对照组加入抗G17单克隆抗体107缓冲液,实验组加入抗体融合蛋白(scFv-AP)。37℃孵育2 h,用0.05% PBST再次清洗每个孔。对照组加入酶标二抗,实验组加入AP底物(p-NPP)。前者37℃孵育1 h,后者避光显色30 min读取405 nm处的光密度。1 h后加入HRP底物(TMB)进行显色反应,最后读取光密度值。
1.3 统计学处理 所有试验至少重复3次。使用医学统计软件GraphPad Prism 7.0将实验结果进行统计分析。统计结果以±s表示。
2 结果
2.1 质粒酶切与测序鉴定 图1A是质粒示意图,方框标出的为EcoRⅠ和HindⅢ酶切位点。将质粒用EcoRⅠ和HindⅢ进行双酶切,结果如图1B所示。1%琼脂糖凝胶电泳显示片段大小为2200 bp,与预期值相符。经Sanger法进行测序,测序结果与标准序列比对一致。表明质粒构建成功。

图1 质粒酶切和鉴定Fig.1 Plasmid digestion and identification
2.2 质粒转化与融合蛋白表达 为了能提高目的蛋白产量,选择两种不同感受态细胞Rosetta(DE3)和BL21(DE3)质粒转化。先进行小量表达,确定目的蛋白表达情况。从图2中可以明显看出Rosetta(DE3)感受态细胞产量更高。目的蛋白在两种感受态细胞中均以包涵体的形式存在。方框标记目的蛋白。

图2 质粒转化与融合蛋白表达Fig.2 Plasmid transformation and fusion protein expres⁃sion
2.3 优化表达条件 为了减少包涵体的形成,提高目的蛋白可溶性表达。通过摸索不同的诱导时间、诱导温度、IPTG浓度,确定最佳表达条件。图3A~C是25℃和37℃,TPTG浓 度0.5 mmol/L、1 mmol/L、2 mmol/L,培养2 h、4 h、6 h的PAGE胶图。方框标记目的蛋白。如图3所示,诱导时间越长,目的蛋白产量越大。37℃的生产效率高于25℃,但也更易形成包涵体。这是因为胞质内蛋白质生成速率过高,没有充足的时间进行折叠,从而形成蛋白质的聚集体。包涵体的形成不利于后面实验的进行。为了减少包涵体的形成,设置25℃进行低温诱导,并适当延长诱导时间。最终确定最佳诱导条件为25℃、1 mmol/L IPTG、6 h。
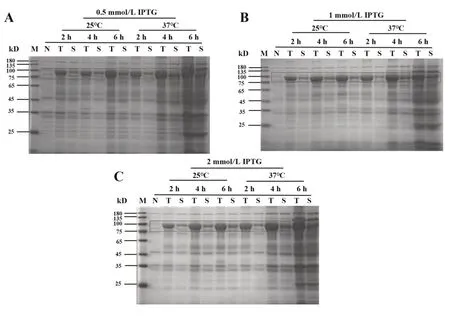
图3 表达条件的优化Fig.3 Optimization of expression conditions
2.4 蛋白纯化 根据最终确定的诱导方案表达蛋白,成功得到了可溶性的抗体融合蛋白。无需采用包涵体的变形复性方式纯化,只需将上清液与Histag蛋白纯化树脂结合完全,离心弃去上清液。用洗涤缓冲液洗去杂蛋白。用含250 mmol/L咪唑的洗脱缓冲液洗下目的蛋白。如图4A为纯化后的抗体融合蛋白的SDS-APGE图。可见100 kD处有单一条带。抗His抗体的Western blot验证为目的条带(图4B)。本研究共诱导500 ml的菌液,纯化后得到8 ml。经BCA法定量,浓度为600 µg/ml。即每升菌液可得9.6 mg抗体融合蛋白。

图4 蛋白纯化Fig.4 Protein purification
2.5 基于scFv-AP融合蛋白的ELISA与传统ELI‐SA相比,抗G17的scFv-AP融合蛋白应用于ELISA可以缩短分析时间,避免使用化学偶联的二抗,无需再次标记。先前实验室已成功制备出3种人源化抗G17的单克隆抗体,并采用双抗体夹心方式进行两两配对。最终结果为N33和107这一配对灵敏度最高。本研究将抗原G17缓冲液由31.25 ng/ml对倍稀释至0.978 ng/ml。实验分为4组。对照组、实验组和他们的空白组,即不加抗原缓冲液G17组。对照组是传统的ELISA夹心模式,实验组用scFv-AP直接检测。实验重复3次。单克隆抗体具有两个抗原结合位点,而单链抗体只有一个抗原结合位点。为控制变量,将实验组与对照组scFv-AP与IgG摩尔浓度比例设置为2∶1。如图5所示,未加抗原缓冲液的对照组和实验组OD值均在0.1左右。对照组检出限为3.910 ng/ml,实验组最低检出限在0.978 ng/ml,比对照组灵敏度高4倍。

图5 scFv-AP的ELISA分析Fig.5 ELISA analysis of scFv-AP
3 讨论
中国是胃癌高发国家,约占世界新发病例的一半。对高危人群进行胃蛋白酶原和胃泌素的血清学筛查可降低胃癌死亡率。血清学试剂盒多以单克隆抗体作为免疫分析工具。单克隆抗体往往存在生产周期长、成本高、批间差异大,需将酶与抗体通过化学共轭方式连接才能作为检测试剂。
单链抗体可以避免基因丢失、基因突变和细胞系漂移等问题。因其生化和遗传稳定性好、在原核系统中表达成本低、生长快、产量大,可弥补单克隆抗体生产工艺的不足。1988年MOUSLI等[15]报道了scFv-AP的生产与表征。2010年LIU等[16]报道细菌碱性磷酸酶可以与单链抗体结合作为ELISA检测的替代试剂。本研究结果验证scFv-AP比单克隆抗体灵敏度高4倍。scFv-AP融合蛋白相较于单克隆抗体可以简化检测步骤,提高检测G17的灵敏度。本研究推测单克隆抗体检出限不高,可能是因为酶标记抗体的化学反应特异性差。随机连接的化学反应使产物不单一,发生副反应破坏结合位点,从而降低单克隆抗体测定的灵敏度。
本研究成功表达抗G17的scFv-AP融合蛋白,通过优化表达条件,避免包涵体形成。使用固定化金属离子亲和层析技术进行纯化,每升菌液可收集9.6 mg的目的蛋白。为以后低成本、大批量生产scFv-AP提供了重要基础。scFv-AP同时具有抗体特异性结合能力和碱性酶活性。这种双功能蛋白的应用使单步免疫测定成为可能。可以更加快速、灵敏地检测胃泌素17,为早期筛查胃癌提供可能。

