外源一氧化氮对铝胁迫下黑麦草幼苗生长和生理的影响
张汉林,王琳,吴亚,王栋麟,刘大林
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.扬州大学农业科技发展研究院(国际联合实验室),江苏 扬州 225009)
近年来,随着生活水平日益提高,畜产品需求量不断增加,饲草饲料短缺严重[1]。多花黑麦草(Loliumperenne)是一种疏丛型禾本科牧草,其产草量高,营养价值高,家畜适口性佳,是优秀的牧草品种,常见利用方式有青料饲喂、晒制干草和青贮饲料等[2]。发展南方牧草种植具有巨大需求,然而我国南方地区土壤偏酸性,酸性土壤的铝毒害是限制黑麦草生长的一个重要因素。土壤中游离的Al3+增多,对草本植物的生长有严重影响。研究表明,植物的农艺性状和抗氧化酶系统等在铝胁迫下均受到抑制[3-4]。
一氧化氮是一种植物体内的气态自由基信号,广泛存在植物体细胞内和细胞间,调节植物生长和各种生理变化过程[5]。NO在干旱、重金属、盐类等非生物胁迫下作为关键信号分子,某些酶的活性受NO的调度[6]。此外,NO能促进原生根和侧根的生长,调节气孔运动以及光介导的绿化,促进光合作用,加快细胞运输,提高植物对非生物胁迫的抵御能力[7-8]。常见的NO供体主要有硝普钠(SNP)、硝酸盐、吗多明及其代谢物,Diazeniumdislate类(NONOates)、S-亚硝基硫醇类、介离子三噁唑类和偶氮二醇烯鎓盐类等也被用作新型的NO供体[9-10]。其中SNP较为常用,有研究表明玉米[11]、小麦[12]、黄瓜[13]、棉花[14]、烟草[15]等在渍水胁迫下对其有响应。
本研究以黑麦草为材料,探究外源NO对铝胁迫下黑麦草幼苗生长和生理的影响,以期为酸性土壤地区种植黑麦草提供一定的理论依据。
1 材料和方法
1.1 试验材料
铝敏感型黑麦草Nagahahikari和铝耐受型黑麦草特高,由扬州大学动物科学与技术学院草业科学种子库提供。
1.2 试验设计
本研究采用沙培法,直径20 cm的加仑盆,沙子装进盆内,分别将2种黑麦草种子播种其中,播深2 cm,播种后置于光照培养箱,设置恒温25℃,光照度10 000 lux,光照14 h、黑暗10 h交替变化,每周施加100 mL Hoagland营养液,培养2周后间苗,每盆保留50株长势一致的幼苗。
试验设置6个处理:CK:100 mL蒸馏水;T1:100 mL处理液,含有100 μmol/L的SNP;T2:100 mL处理液,含有200 μmol/L的SNP;T3:100 mL处理液,含有20 mmol/L Al3+(Al3+由AlCl3·H2O提供);T4:100 mL处理液,含有20 mmol/L Al3+和100 μmol/L的SNP;T5:100 mL处理液,含有20 mmol/L Al3+和200 μmol/L的SNP,每个处理组3次重复。6种处理液分别连续施用3 d,继续培养至7 d进行采样,测定各项形态指标和生理指标。
1.3 测定指标与方法
采样后用直尺(精确到0.1 cm)测量株高和根长,然后将样品植株分别置于105℃烘箱杀青30 min后65℃烘干至恒重,用分析天平称量(精确到0.000 1)其干重(DW),即为地上生物量和地下生物量。
乙醇浸泡法测定叶绿素含量,浸泡法测定相对电导率(EL),硫代巴比妥酸法测定丙二醛(MDA)含量,蒽酮法测定可溶性糖含量,考马斯亮蓝法测定可溶性蛋白含量,氮蓝四唑染色法测定超氧化物歧化酶(SOD)活性,以上指标测试参考施海涛[16]的测定方法。用过氧化物酶(POD)测试盒(南京建成生物工程研究所)比色法测POD活性。用过氧化氢酶(CAT)测试盒(南京建成生物工程研究所)比色法测CAT活性。参考张立军[17]的方法测可溶性糖含量。参考贺建华等[18]的方法测铝离子含量。
采用PAM2500(Heinz Walz GmbH)对黑麦草叶片的叶绿素a荧光瞬态曲线进行测定,计算量子产率和效率以及比能量通量,使用Yusuf等[19]描述的JIP测试方法和计算公式分析OJIP瞬时曲线。
1.4 数据分析
用Excel 2003进行数据处理,ANOVA法进行统计分析,Duncan法进行差异显著性检验。
2 结果与分析
2.1 铝胁迫下添加外源NO对黑麦草幼苗生长特征的影响
添加NO后,2种黑麦草幼苗地上和地下部分的伸长生长受到促进,生物量增加(图1)。与CK组相比,T3组2种黑麦草的株高、根长、地上生物量和地下生物量的增加均受到抑制。Nagahahikari的根长、地上生物量和地下生物量分别降低28.68%、30.43%和25.59%;黑麦草特高的根长、地上生物量和地下生物量分别降低22.92%、13.51%和17.66%。T4组和T5组黑麦草受到的铝胁迫毒害均有缓解。T4组两种黑麦草根系的伸长生长较CK分别显著提高34.21%和31.97%(P<0.05)。相较于T4组,T5组2种黑麦草地上生物量和地下生物量提高更多。
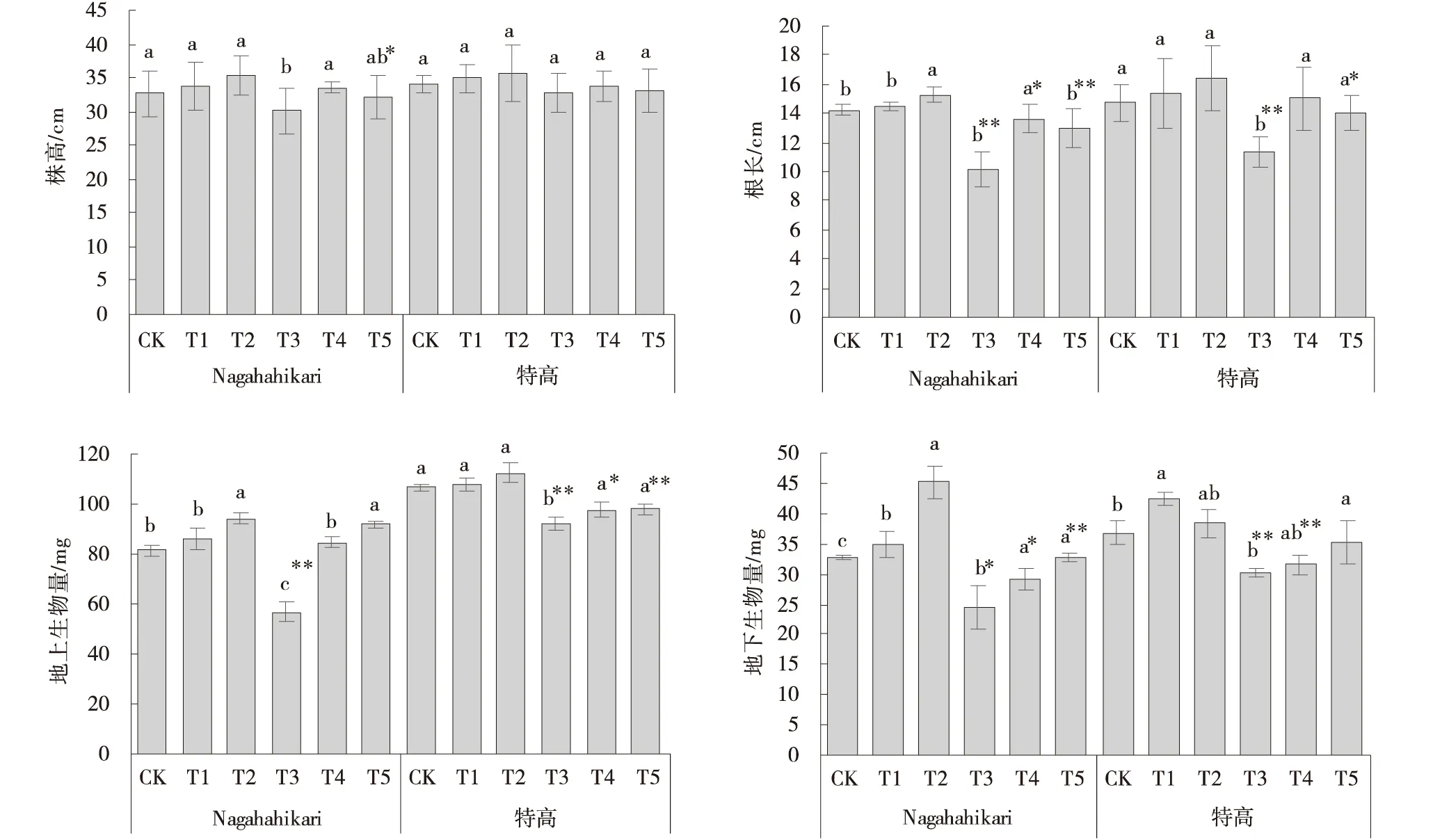
图1 铝胁迫下添加NO黑麦草幼苗的生长特性Fig.1 Effects of exogenous NO addition on the growth characteristics of ryegrass seedlings under aluminum stress注:不同小写字母表示不同浓度外源物之间即CK、T1、T2之间、T3、T4、T5之间存在显著性差异(P<0.05),“*”表示无铝胁迫组和有铝胁迫组之间即CK与T3、T1与T4、T3与T5存在显著性差异(P<0.05),“**”表示无铝胁迫组和有铝胁迫组之间即CK与T3之间、T1与T4之间、T3与T5存在极显著差异(P<0.01),下同
2.2 铝胁迫下添加外源NO对黑麦草幼苗叶绿素含量的影响
与CK组相比,T3组2种黑麦草的叶绿素a含量、叶绿素b含量和叶绿素总量在铝胁迫下显著降低(P<0.05)(图2)。Nagahahikari的叶绿素a含量、叶绿素b含量和叶绿素总量分别降低31.37%、39.13%和39.13%,特高分别降低22.75%、33.60%和33.60%。相较于T3组,T4组和T5组2种黑麦草叶绿素a含量和叶绿素总量显著提高(P<0.05),叶绿素b含量无显著性升高(P>0.05)。

图2 铝胁迫下添加NO黑麦草幼苗的叶绿素含量Fig.2 Effects of exogenous NO addition on the chlorophyll content of two ryegrass seedlings under aluminum stress
2.3 铝胁迫下外源NO对黑麦草幼苗叶绿素荧光特性的影响
T1组2种黑麦草的叶绿素荧光强度高于T2和CK组2种黑麦草的叶绿素荧光强度。T4组和T5组2种黑麦草的叶绿素荧光强度高于T3组(图3)。

图3 铝胁迫下添加NO黑麦草幼苗的OJIP荧光瞬态曲线Fig.3 Effects of exogenous NO addition on OJIP fluorescence transient curves of the seedlings of two ryegrass cultivars under aluminum stress
与CK组相比,T3组Nagahahikari的Fo、Fj、Fi、Fm和F300μs值在铝胁迫处理下极显著降低(P<0.01)。T3组特高的Fj、Fi、Fm和F300μs值与CK组相比极显著降低(P<0.01)。T4组和T5组Nagaha-hikari的Fo、Fj、Fi、Fm和F300μs值较T3组均显著提高(P<0.05)。相比T3组,特高的F0(0.02 ms)在T4组和T5组都显著降低(P<0.05)(表1)。
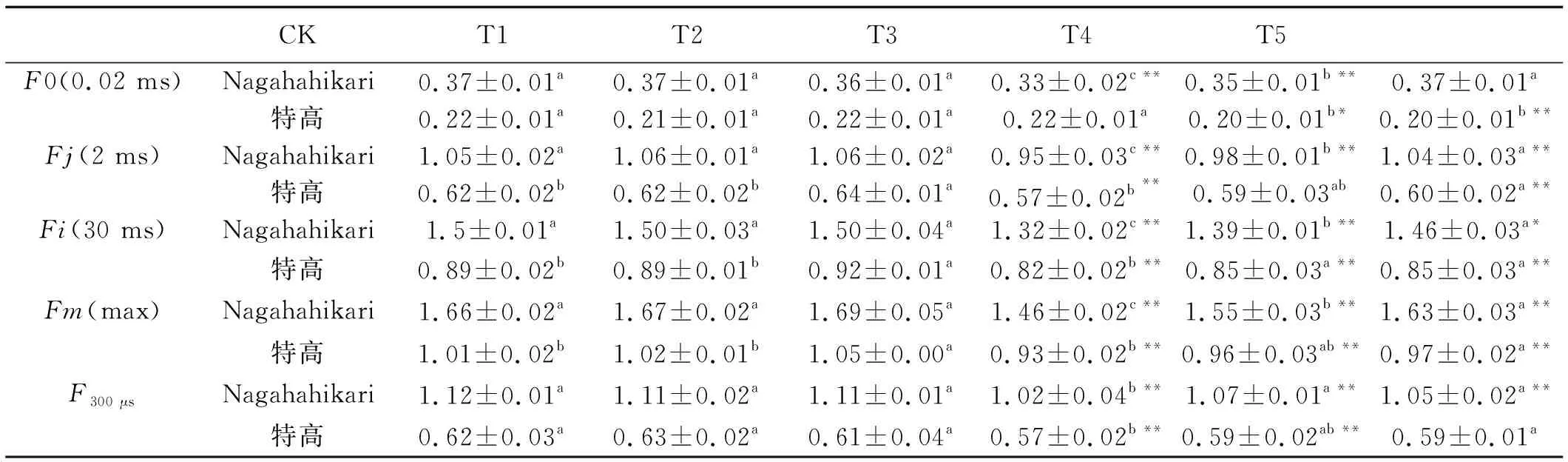
表1 由OJIP曲线上提取的叶绿素荧光强度数据
T2组Nagahahikari的φEo、δRo、ψEo、RC/ABS和yRC值显著提高(P<0.05)(表2)。T1组和T2组特高的RC/ABS和yRC值较CK组显著提高(P<0.05)。与CK组相比,T3组Nagahahikari的φpo、φEo和ψEo值显著降低(P<0.05)。T4组和T5组Nagahahikari的φEo和ψEo值均显著提高(P<0.05),T5组黑麦草Nagahahikari的RC/ABS和yRC值显著提高(P<0.05)。T5组特高的φpo、RC/ABS和yRC值显著提高(P<0.05),而T4组仅φpo值显著提高(P<0.05)。

表2 铝胁迫下添加NO黑麦草幼苗的量子产率和效率
T2组Nagahahikari的ABS/RC和ETo/RC值显著降低(P<0.05),但REo/RC值显著提高(P<0.05)(表3)。T2组特高的ABS/RC、TPo/RC、ETo/RC和REo/RC值显著提高(P<0.05)。与T3组相比,T4组Nagahahikari的TPo/RC、ETo/RC和REo/RC值显著升高(P<0.05)。T5组Nagahahikari的ABS/RC、TPo/RC和ETo/RC值显著降低(P<0.05)。
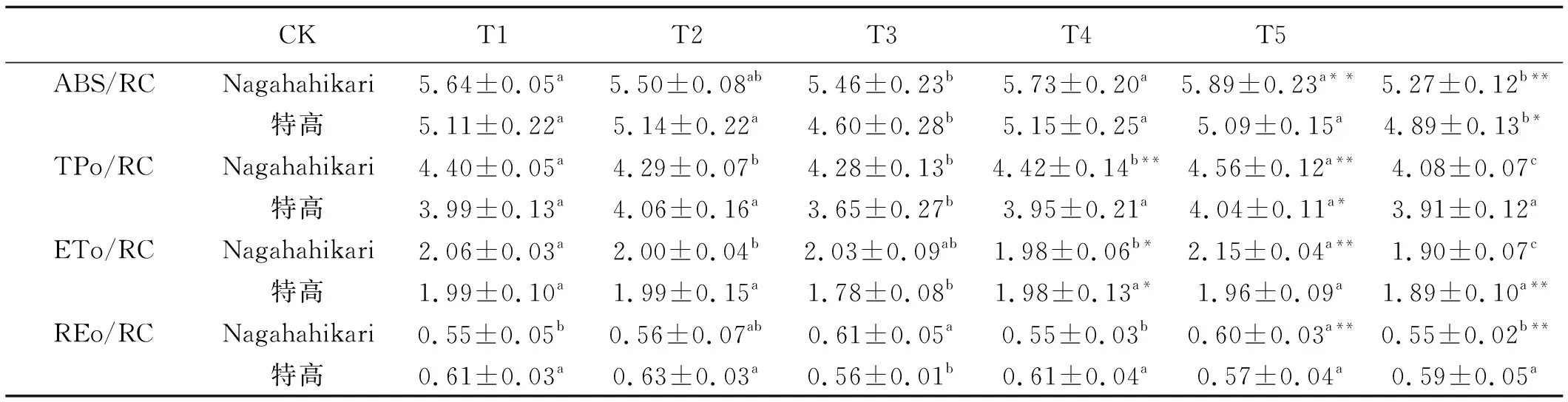
表3 铝胁迫下添加NO黑麦草幼苗的比能量通量
T2组,两种黑麦草的性能指标显著提高(P<0.05),其中Nagahahikari和特高的PIABS值分别增加9.25%和12.42%,PItotal值分别增加28.54%和16.84%(图4)。与T3组相比,T5组Nagahahikari的PIABS和PItotal值显著提高(P<0.05),T4组和T5组特高的PIABS值均显著提高(P<0.05),而T5组特高的PItotal值显著提高(P<0.05)。
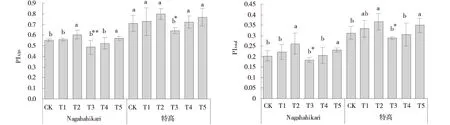
图4 铝胁迫下添加NO黑麦草幼苗的性能指标Fig.4 Effects of exogenous NO addition on the performance indexes of the seedlings of two ryegrass cultivars under aluminum stress
2.4 铝胁迫下添加外源NO对黑麦草幼苗可溶性糖和可溶性蛋白含量的影响
添加外源NO的T1组和T2组相比CK组,2种黑麦草可溶性糖含量升高,T2组Nagahahikari和特高的可溶糖含量提高,分别为41.55%和90.42%(图5)。与CK组相比,T3组2种黑麦草的可溶性糖含量提高,其中Nagahahikari的可溶性糖含量极显著高于CK组(P<0.01),而特高无显著性变化。与T3组相比,T4组和T5组2种黑麦草的可溶性糖含量增加,T5组Nagahahikari的可溶性糖含量显著高于T3组(P<0.05)。
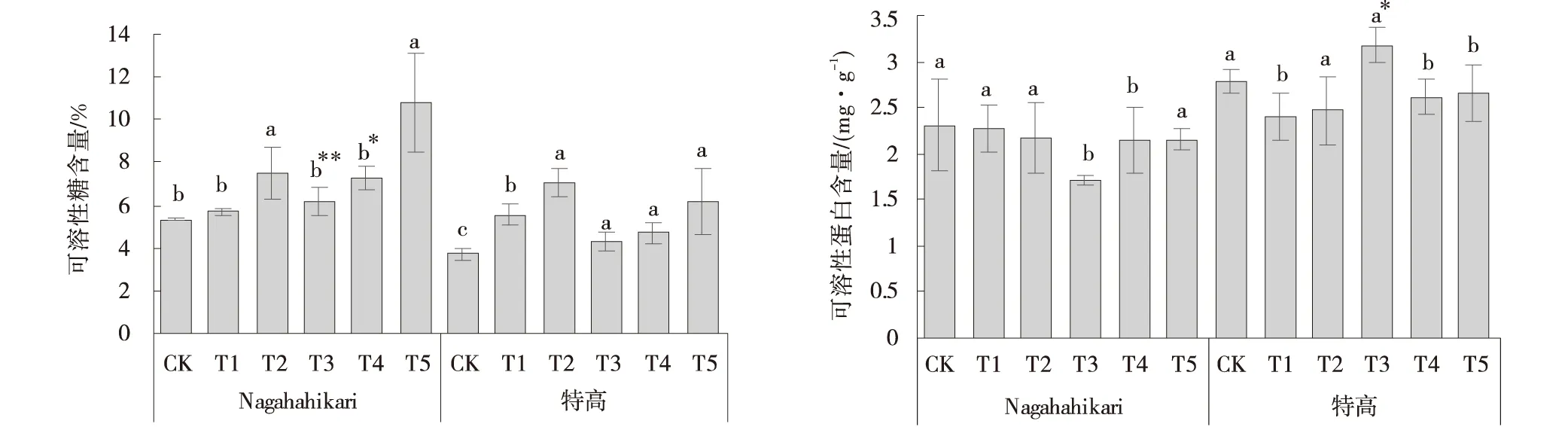
图5 铝胁迫下添加NO黑麦草幼苗的可溶性糖和可溶性蛋白含量Fig.5 Effects of exogenous NO addition on the soluble sugar and soluble protein content of the seedlings of two ryegrass cultivars under aluminum stress
T3组Nagahahikari的可溶性蛋白含量相较于CK组降低,而特高的可溶蛋白含量显著高于CK组(P<0.05)。T4组和T5组Nagahahikari的可溶性蛋白含量提高,特高的可溶蛋白含量降低。
2.5 铝胁迫下外源NO对黑麦草幼苗过氧化指标的影响
与CK组比较,T3组2种黑麦草的相对电导率极显著提高(P<0.01)。与T3组相比,T4组和T5组2种黑麦草的相对电导率显著降低(P<0.05),其中T5组Nagahahikari和特高的相对电导率分别降低34.85%和27.35%。
T3组相较于CK组,2种黑麦草的MDA含量极显著提高(P<0.01),Nagahahikari和特高的MDA含量分别增加2.75倍和2.29倍。与T3组相比,T4组和T5组2种黑麦草的MDA含量显著降低(P<0.05)。

图6 铝胁迫下添加NO黑麦草幼苗的过氧化指标Fig.6 Effects of exogenous NO addition on peroxidation indexes of the seedlings of two ryegrass cultivars under aluminum stress
2.6 铝胁迫下外源NO对黑麦草幼苗抗氧化酶活性的影响
T3组2种黑麦草的SOD活性均极显著高于CK组(P<0.01)。T4组和T5组2种黑麦草的SOD活性较T3组显著提高(P<0.05),其中T5组2种黑麦草的SOD活性相较于T3组分别提高28.66%和37.18%。
T3组2种黑麦草的POD活性均极显著高于CK组(P<0.01)。T4组和T5组2种黑麦草的POD活性较T3组显著提高(P<0.05),其中T5组2种黑麦草的SOD活性相比T3组分别提高52.41%和50.30%。
与T3组相比,T5组Nagahahikari的CAT活性显著提高(P<0.05),T4组和T5组特高的CAT活性均有显著提高(P<0.05)。
2.7 铝胁迫下添加外源NO对黑麦草幼苗Al3+富集含量的影响
与CK组相比,T2组特高地上部的Al3+富集量显著降低(P<0.05)(图8),其根系的Al3+富集含量降低,但差异不显著(P>0.05)。T4组和T5组2种黑麦草地上部和根系中的Al3+富集量较T3组降低,T5组Nagahahikari地上部和根系中的Al3+富集量减少,分别为34.95%和26.02%,特高地上部和根系中的Al3+富集量减少,分别为29.33%和17.37%。

图7 铝胁迫下添加NO黑麦草幼苗的抗氧化酶活性Fig.7 Effects of exogenous NO addition on antioxidant enzyme activities of the seedlings of two ryegrass cultivars under aluminum stress
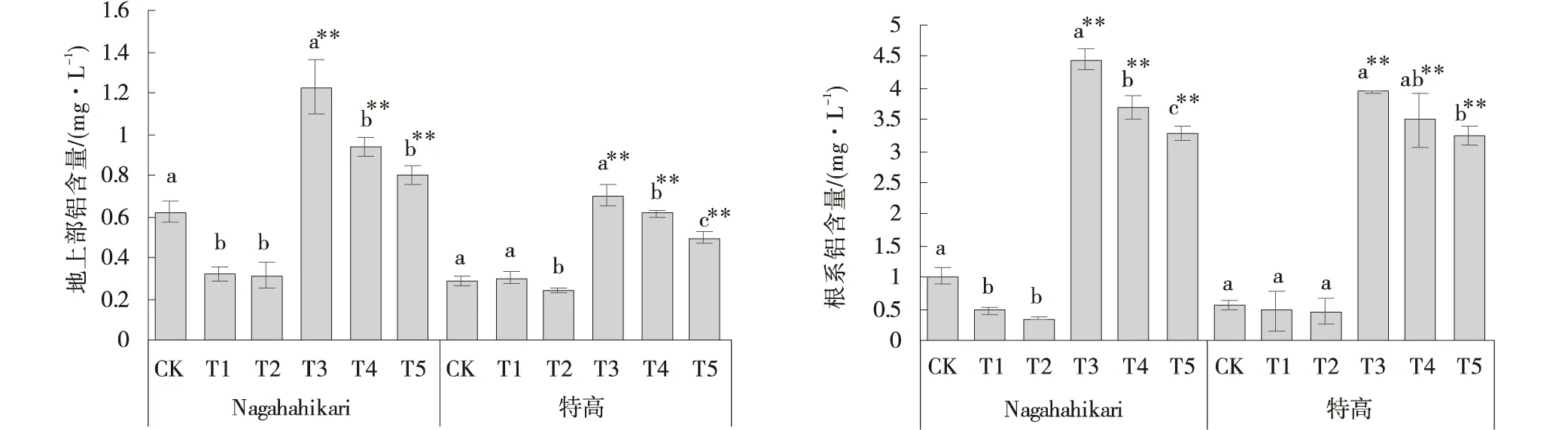
图8 铝胁迫下添加NO黑麦草幼苗不同部位的铝富集含量Fig.8 Effects of exogenous NO addition on the aluminum content in different parts of the seedlings of two ryegrass cultivars under aluminum stress
3 讨论
一氧化氮(NO)是一种重要的气体信号分子[20]。NO能够提高植物对非生物胁迫的抵抗性能,如低温胁迫[21]、盐胁迫[22]、高温与干旱胁迫[23]、重金属胁迫[24]和酸铝胁迫[25]等。番茄等植物幼苗的生长在适宜浓度的NO下受到促进[26-27]。Tian等[28]研究表明豌豆叶片膨大与适宜浓度的NO处理相关。本研究发现,对铝胁迫下的黑麦草添加NO,其株高和根长增加,地上和地下部分生物量增加。这与对大豆[29]、小麦[30]、烟草[31]等研究的结果一致。由此可见,对铝胁迫下黑麦草添加NO,能促进其生长。相同处理组中,特高的株高、根长、地上生物量和地下生物量均高于Nagahahikari,可能是特高本身对于铝胁迫有较好的耐受性,受到铝毒害的影响较小,在添加NO后生长有更明显的改善。
叶绿素含量与植物光合作用的强度具有密切的关联。研究发现,铝胁迫下,两种黑麦草叶片中叶绿素各组分的含量均显著降低。铝胁迫下的黑麦草,叶绿体受损,酶的结构发生变化,从而抑制叶绿素的合成[32-33]可能是造成此结果的原因。Fv/Fm参数(光化学的最大量子产量)不具有特异性[34],通常对植物的逆境胁迫响应不大[35]。因此,使用快速叶绿素a荧光动力学对黑麦草的光合性能进行评价。荧光猝灭的分析可评价黑麦草的光合性能,反映黑麦草对铝胁迫的耐受性,还可反映PSⅡ中能量流动和电子输运的状况[36-37]。研究发现,对铝胁迫下的黑麦草进行添加NO处理,其叶绿素a荧光强度提高。铝胁迫下黑麦草添加NO,黑麦草特高的Fo值降低,2种黑麦草的Fm值都提高,黑麦草的量子产率和效率提高,比能量通量降低,表现为叶绿素a荧光动力学性能提高。Pltotal与植物生长和生理参数间有强相关性[38]。研究发现,对铝胁迫下黑麦草添加200 μmol/L的NO,能使其Pltotal显著上升。由此可知NO能保护黑麦草的光合系统。其中特高的各项光合性能指标均优于Nagahahikari,表明铝耐受型黑麦草对铝胁迫有较好的适应性,同时Nagahahikari的光合性能指标提升幅度大于特高,表明添加NO对于铝敏感型黑麦草的光合系统有更好的保护效果。
可溶性糖和可溶性蛋白调节植物细胞液浓度、改变细胞渗透势的物质,也能为细胞提供能量或作为酶类物质,在应对非生物胁迫的过程中发挥重要作用[39-40]。研究发现,对铝胁迫下黑麦草添加200 μmol/L的NO,2种黑麦草的可溶性糖含量均提高,可溶性蛋白含量均下降。可能是由于铝胁迫下黑麦草分解可溶性蛋白提供能量。黑麦草特高可能因为对铝胁迫具有较好的耐性,2种渗透调节物质含量提高,以维持细胞渗透势,提高细胞吸水或保水能力。
MDA的积累损伤膜系统,质膜透性变差,电解质外泄,最终导致相对电导率上升。研究发现,铝胁迫显著提高2种黑麦草的MDA含量和相对电导率。由此可见黑麦草细胞在铝胁迫下易发生过氧化。植物清除体内ROS主要通过SOD,POD和CAT等抗氧化酶类,以此维持ROS的产生和清除的平衡。研究发现,铝胁迫下2种黑麦草的3种抗氧化酶活性显著升高,可能是因为铝胁迫使黑麦草体内产生更多ROS,提高抗氧化酶活性以更快地清除ROS,更快适应铝胁迫环境。铝胁迫下2种黑麦草添加NO后,SOD、POD和CAT活性提高,MDA含量和EL值也因此降低。
研究发现,黑麦草特高地上和地下部分都比黑麦草Nagahahikari富集的铝少,说明特高通过减少Al3+在其体内富集实现更好的铝耐性。铝胁迫下对2种黑麦草进行添加NO处理,使地上和地下部分中的铝富集量均有降低。由此可见,铝胁迫下对黑麦草进行添加NO处理,能降低黑麦草对Al3+的吸收和富集,减轻铝胁迫对黑麦草的毒害,促进黑麦草的生长,提高黑麦草的生物量。
4 结论
铝胁迫下对黑麦草进行添加NO处理,使其光合性能提高,渗透调节能力提高,膜脂过氧化程度降低,抗氧化酶活性提高,铝富集量降低,黑麦草实现了更好的生长,更多的生物量积累。添加NO提高了黑麦草对铝胁迫的适应能力,缓解了铝胁迫对黑麦草的毒害作用。此外,相比于铝耐受性黑麦草特高,添加SNP对铝敏感型黑麦草Nagahahikari有更明显的铝毒害缓解效果。

