金雀异黄酮对冻融猪精子蛋白酪氨酸磷酸化及获能相关基因表达的影响
梁莹莹,谢运法,胡传活*,陈志英,邓祝新,冯显钤,许春荣,刘德玉,唐胤晟,李 铭
(1.广西大学动物科技学院,广西 南宁 530004;2.广西畜禽品种改良站,广西 南宁 530001;3.广西畜牧研究所,广西 南宁 530001)
【研究意义】金雀异黄酮来源于豆科植物,具有蛋白酪氨酸激酶抑制剂之称,其分子式为C15H10O5,被归类为植物雌激素,可穿透细胞抑制酪氨酸蛋白激酶活性及许多蛋白的酪氨酸磷酸化。已有研究证实,添加100.0 μmol/L金雀异黄酮能有效改善冻后猪精子表观指标及精子的获能状态[1],但尚未对其作用机理及作用部位进行深入研究。因此,探究金雀异黄酮对冻融猪精子蛋白酪氨酸磷酸化及获能相关基因的影响,对开展蛋白酪氨酸激酶抑制剂对冻融猪精子获能影响研究具有重要意义。【前人研究进展】低温刺激可对精子造成不可逆损伤,致使精子提前获能,且在这种低温环境下诱导的精子获能被认为是一种以多不饱和脂肪酸和胆固醇的损失为特征的膜重组现象,随着Ca2+内流的增加而引起pH升高,产生低水平的一氧化氮,并形成过氧亚硝酸盐,然后被裂解形成羟基自由基和二氧化氮,尤其是pH和羟基自由基的升高会激活腺苷酸环化酶,导致精子内cAMP和蛋白激酶A(PKA)活性发生变化[2-4]。Kumar和Atreja[4]研究认为,精子获能是与卵子结合的必要条件,但过早获能易导致精子生理特征发生改变,缩短精子在雌性生殖道的存活时间而影响受精过程。早在20世纪80年代,人们已在猪精浆蛋白中发现一组精子黏附蛋白(SP)家族,该家族包括5个蛋白(AQN1、AQN3、AWN、PSP-I和PSP-II及其糖基亚型),射精时附着在精子表面,保护精子顶体防止精子提前获能,精子获能后多数SP脱离精子外膜,仅少数与精子膜磷脂相结合,参与精卵识别并与透明带结合[5]。Ledesma等[6]研究发现,分别在羊的精液冷冻液中添加精浆蛋白和富含II型纤维连接蛋白结构域的精浆重组蛋白均能有效改善羊冷冻精子的质量,并抑制或逆转冷冻过程中精子获能。Fang等[7]研究显示,在羊精子冷冻液中添加40%猪精浆可抑制羊精子冷冻获能,改善正常的生理获能过程,增加羊宫颈内人工授精的精子穿透率和妊娠率。高波等[8]研究表明,在羊精液冷冻液中精子运动抑制因子(SPMI)是哺乳动物精浆中的另一种蛋白,可调控精子的运动能力。【本研究切入点】目前,关于金雀异黄酮影响冻融猪精子获能的具体作用机制尚无研究报道。【拟解决的关键问题】探讨金雀异黄酮对冻融猪精子蛋白酪氨酸磷酸化水平、获能信号通路PKA和蛋白激酶G(PKG)活性变化、SP家族基因及SPMI基因mRNA表达的影响,为丰富猪精子冷冻保存技术的理论基础提供参考依据。
1 材料与方法
1.1 试验材料
试验于2019年2—7月在广西大学基础兽医实验室进行。猪精液以手握法采自广西科达畜禽改良有限责任公司18~24月龄、体重140~150 kg、体格健康、性欲旺盛的10头杜洛克种公猪,检测其精子活力不低于70.0%。主要试验试剂:金雀异黄酮(碧云天);Anti-rabbit HRP IgG、DyLight 488-抗鼠IgG、β-Actin pAb Rabbit(Bio-World);Phospho-Tyrosine Mouse mAb、Anti-mouse IgG HRP-linked Antibody(CST);RNA提取试剂盒、2×ChamQUniversalSYBRqPCR Master Mix酶(Vazyme);2×TaqPCR Master Mix(TaKaRa),均购自于广西南宁楚杰生物科技有限公司;其他试剂均为国产分析纯。精液冷冻稀释液(Ⅰ液和Ⅱ液)参照李丹丹等[11]的方法进行配制。
1.2 试验方法
1.2.1 试验设计 分别设100.0 μmol/L金雀异黄酮冷冻处理组(冷冻精液中添加金雀异黄酮,G组)、对照组(冷冻对照组,CK组)和鲜精组(新鲜精液,F组)。
1.2.2 精液冷冻和解冻 参照李丹丹等[9]的方法进行猪精液冷冻和解冻。将镜检合格的猪精液于室温下离心取沉淀;加入等体积的冷冻Ⅰ液(使金雀异黄酮终浓度分别为0和100.0 μmol/L)[1],17.0 ℃下孵育1.0 h后加入等体积的冷冻Ⅱ液(即精液∶冷冻Ⅰ液∶冷冻Ⅱ液=1∶1∶1);用250.0 μL塑料细管分装,2.0 h内缓慢降温至4.0 ℃,并在该温度下平衡2.0 h,于程序降温仪中降温至-140 ℃,程序结束后投入液氮中保存。解冻时,将装有精子的塑料细管置于60 ℃水浴复温解冻5 s(冷冻精子解冻后均称冻融精子,下同)。
1.2.3 精子蛋白酪氨酸磷酸化水平检测 参照王红[10]、Saez等[11]的方法提取各组猪精子的总蛋白后,以紫外分光酶标仪检测蛋白浓度,并进行Western blotting检测。以80 V电压分离各组蛋白,并将蛋白条带转移至NC膜上,5.0%脱脂奶粉封闭1.5 h后漂洗,经一抗(抗酪氨酸磷酸化抗体∶PBST =1∶2000,β-actin∶PBST =1∶20 000)4 ℃孵育过夜和二抗(鼠抗∶PBST =1∶20 000;兔抗∶PBST =1∶100 000)室温孵育1.0 h后漂洗,加入发光液置于暗室曝光盒内曝光后显影、定影保存。
1.2.4 精子蛋白酪氨酸磷酸化位点检测 参照张孝清等[12]的方法进行间接免疫荧光检测。取各组猪精子置于3.7%多聚甲醛中37 ℃下固定20.0 min,PBS洗3次,制成100.0 μL精子悬液;取20.0 μL悬液涂片风干,于3.0% BSA-PBS内37 ℃下封闭1.0 h;一抗室温下孵育1.0 h,PBST浸洗5.0 min(3次);二抗37 ℃下避光孵育1.0 h,PBST浸洗5.0 min(3次),水中避光浸洗5.0 min;抗荧光衰减剂封片(用指甲油将涂片封闭于避光盒内);荧光显微镜下观察200个以上精子。
1.2.5 PKA和PKG活性检测 参照GenStar猪PKA酶联免疫分析试剂盒说明和猪PKG酶联免疫分析试剂盒推荐方法进行标准曲线构建和精子内蛋白酶活性检测。
1.2.6 RT-PCR鉴定 参照GenBank中公布的猪精子AQN1、AQN3、AWN、PSP-I、PSP-II和SPMI基因及内参基因(GAPDH),利用Clone manger 8.0分别设计扩增引物(表1),委托华大基因股份有限公司合成。取各组精子按照RNA提取试剂盒说明提取精子RNA。以RNA为模板,根据RNA反转录试剂盒说明合成cDNA第一链。根据2×TaqPCR Master Mix使用说明及通过多次试验验证确定PCR反应体系和最佳反应条件。反应体系26.0 μL:2×TaqPCR Master Mix 12.5 μL,上、下游引物各0.5μL、水12.5 μL。通过改变退火温度和循环次数确定最佳RT-PCR扩增条件(表2)。参照刘运佳[13]的方法对猪精子黏附蛋白基因、SPMI基因和GAPDH基因进行SDS-PAGE鉴定。

表1 猪精子黏附蛋白基因、SPMI基因和GAPDH基因的扩增引物
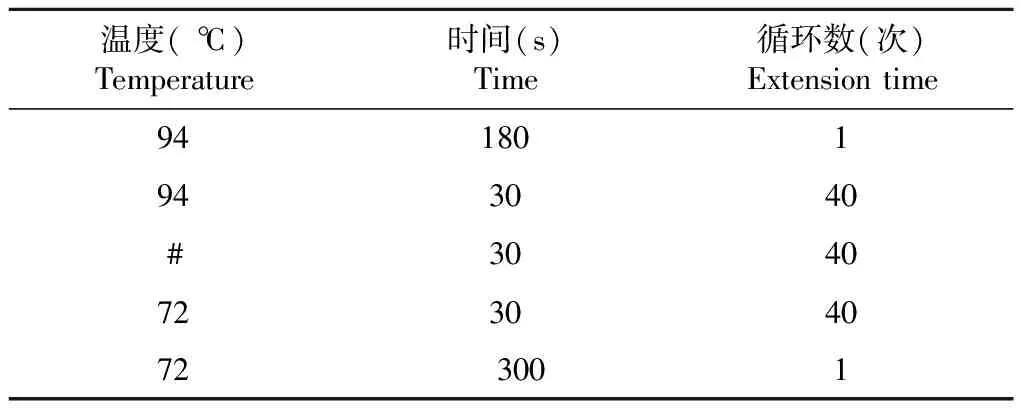
表2 猪精子黏附蛋白家族基因、SPMI基因和GAPDH基因的RT-PCR扩增条件
1.2.7 实时荧光定量PCR检测 根据2×ChamQUniversalSYBRqPCR Master Mix酶使用说明及通过试验验证后确定实时荧光定量PCR反应体系和最佳反应条件。反应体系20.0 μL:2×ChamQUniversalSYBRqPCR Master Mix酶10.0 μL,上、下游引物各0.4 μL,cDNA模板1.0 μL,ddH2O补足20.0 μL。扩增程序:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 1.0 min,进行40个循环。
1.3 统计分析
试验数据采用Excel 2010和SPSS 22.0进行统计分析,利用Image J进行灰度值扫描,并以Graphpad Prism 6.0制图。
2 结果与分析
2.1 金雀异黄酮对冻融猪精子蛋白酪氨酸磷酸化的影响
采用Western blotting对G组、CK组和F组中酪氨酸磷酸化蛋白进行检测,结果(图1)发现,在冻融精子中检测出5种不同分子量(32、37、40、58和69 kD)蛋白的酪氨酸磷酸化,而F组中仅检测出3种不同分子量(37、40和58 kD)蛋白的酪氨酸磷酸化(图1-A和图1-C);与CK组相比,G组中分子量为32和69 kD的蛋白酪氨酸磷酸化水平显著降低(P<0.05,下同)(图1-B),分子量为37、40和58 kD蛋白的酪氨酸磷酸化水平差异不显著(P>0.05,下同)(图1-D)。说明金雀异黄酮在猪精子冻融过程中可能通过降低32和69 kD蛋白的酪氨酸磷酸化而抑制猪精子被动获能。
2.2 金雀异黄酮对冻融猪精子不同部位蛋白酪氨酸磷酸化位点的影响
从图2-A可看出,冻融组精子(G组和CK组)和F组中猪精子的顶体区、顶体后区和尾部均发生蛋白酪氨酸磷酸化;从图2-B可看出,与CK组相比,F组蛋白酪氨酸磷酸化位点在顶体后区极显著升高(P<0.01,下同);顶体区和顶体+顶体后区磷酸化位点极显著降低;G组中顶体+顶体后区磷酸化位点显著降低。说明金雀异黄酮可能通过降低精子顶体+顶体后区处蛋白的酪氨酸磷酸化水平而抑制猪精子冻融过程中获能。
2.3 金雀异黄酮对冻融猪精子PKA和PKG活性的影响
通过对标准品进行二倍梯度稀释,构建PKA和PKG活性标准曲线。从图3可看出,构建的标准曲线具有良好的线性关系(PKA:y=0.0156x-0.0127;PKG:y=0.0459x-0.0104),且R2大于0.9900,说明标准曲线构建成功。
以ELISA试剂盒检测G组、CK组和F组中猪精子的PKA和PKG活性,结果(图4)发现,G组中猪精子的PKA活性较CK组显著降低,PKG活性与CK组差异不显著。说明金雀异黄酮可能通过降低冻融猪精子cAMP/PKA获能信号通路中的PKA活性而阻止精子获能。
2.4 金雀异黄酮对冻融猪精子黏附蛋白家族与SPMI基因表达的影响
采用SDS-PAGE对猪精子黏附蛋白家族、SPMI和GAPDH基因进行检测,结果(图5-A和图5-B)显示,AQN1、AQN3、AWN、PSP-I、PSP-II、SPMI和GAPDH基因扩增产物长度分别为193、179、207、140、201、174和100 bp,与重组质粒的测序结果一致。
通过实时荧光定量PCR对猪精子黏附蛋白家族基因、SPMI基因和GAPDH基因进行检测,其熔解曲线呈均一单峰,说明引物具有良好的特异性;以GAPDH基因为内参基因分别对冻融精子黏附蛋白家族和SPMI基因mRNA表达量进行检测,对所得不同分组精子黏附蛋白家族基因和SPMI基因表达量进行归一化处理,绘制各基因不同分组相对表达量差异比对图(图6)。与CK组相比,G组中AWN基因相对表达量极显著上升,PSP-I、PSP-II和SPMI基因相对表达量下降(其中,PSP-I基因显著下降,PSP-II和SPMI基因极显著下降)。说明金雀异黄酮可能通过提高冻融精子AWN基因表达量,抑制猪精子冻融过程中获能;通过降低PSP-I、PSP-II和SPMI基因表达量,提高冻融精子活力。
3 讨 论
Eddy等[14]、Urner和Sakkas[15]研究认为,精子的运动和获能均受蛋白酪氨酸磷酸化过程调控,且与精子的结构、生理特性及获能过程中的超激活运动有关。本研究通过检测猪精子中蛋白酪氨酸磷酸化水平变化,结果发现顶体+顶体后区酪氨酸磷酸化位点减少可能受精子中蛋白酪氨酸磷酸化调控;通过对cAMP/PKA和cGMP/PKG信号通路中PKA和PKG活性的检测,发现金雀异黄酮对冻融过程中精子获能的抑制(或使冻融精子去获能)可能与cAMP/PKA信号通路中PKA活性降低有关。Orrego等[16]研究报道,冻融过程导致“获能样”精子中的蛋白酪氨酸磷酸化水平增加,并出现32 kD分子量的蛋白(p32)酪氨酸磷酸化。本研究中,冻融猪精子(CK组和G组)不仅出现p32蛋白,还出现p37、p40、p58和p69蛋白,其中p37和p58蛋白的表达量显著高于F组,与王亮亮等[17]、González-Fernández等[18]的研究结果相似;冻融精子较新鲜精子新增2个酪氨酸磷酸化蛋白(p32和p69),经金雀异黄酮处理后表达量显著降低,酪氨酸磷酸化蛋白p32的出现可能与冻融引起顶体内容物融合有关[17];但新鲜精子中未检测到p69蛋白,与王亮亮[17]的研究结果存在差异,具体原因尚需进一步探究。
已有研究证实,冷冻处理的猪精子蛋白酪氨酸磷酸化主要分布于顶体后区的颈部,顶体和尾部仅有少许荧光[19]。本研究通过检测冻融猪精子中蛋白酪氨酸磷酸化位点,发现100.0 μmol/L金雀异黄酮处理可减少顶体区和顶体+顶体后区蛋白酪氨酸磷酸化,与Lewis和Aitken[20]的研究结果不一致,可能与研究的物种不同有关;冻融精子的顶体+顶体后区蛋白酪氨酸磷酸化位点降低可能与p32和p69蛋白表达量降低有关;鲜精组中精子的顶体区酪氨酸磷酸化位点较高,与Urner等[19]的研究结果一致:而CK组有部分精子死亡,未发生酪氨酸磷酸化。
精子黏附蛋白主要由精囊腺产生,是附着在精子表面的多功能蛋白,能与多种配体(碳水化合物、硫酸糖胺聚糖、磷脂和蛋白酶抑制剂等)相结合,参与不同受精过程。Sanz等[21]研究显示,精子通过附睾时,AQN3和AWN蛋白通过与双层膜磷脂相互作用与精子表面紧密结合,射精前与部分受体相结合,在子宫通道中起着稳定透明带结合位点的作用;射精时,精子黏附蛋白在精子头部敏感的顶体区域形成一层保护层,防止过早顶体反应;在体外获能过程中,除磷脂结合的精子蛋白外,其他精子黏附蛋白均脱离精子表面,AWN和AQN3蛋白可能是卵母细胞透明带的主要受体,因此有助于精子和卵子间的初始结合和识别。Sanz等[22]通过对AQN1蛋白的分离,运用飞行时间等离子体—解吸质谱法测定其为12 kD分子量蛋白,并运用蛋白质谱法测定其氨基酸序列和二硫键位置,发现其结构和功能与AQN3和AWN蛋白具有广泛的相似性。胡安琪等[23]研究表明,AQN1、AQN3和AWN蛋白在精子获能时具有稳定顶体质膜及调节精卵结合作用。本研究发现,冻融猪精子黏附蛋白基因AQN1、AQN3和AWN的表达量降低,与胡安琪等[23]的研究结果一致,且加速了精子的“获能样”变化,而G组中AWN基因的相对表达量显著升高。Sanz等[24]研究认为,AWN1蛋白是AWN蛋白的一个亚型,可调节机体碳水化合物,识别并黏附于卵子透明带,而黏附蛋白丢失使精子失去保护,从而发生假获能或提前获能,影响其繁殖力。以上研究结果表明,AWN蛋白基因在精子冷冻和获能过程中发挥着积极作用,可为后续开展精子冷冻和获能研究提供参考。
Kang等[25]研究发现,PSP-I和PSP-II蛋白在低产仔公猪精子中的表达量显著高于高产仔公猪,也有研究报道公猪精浆中PSP-1蛋白表达与生育能力和精子运动呈负相关[26-27],PSP-1蛋白表达主要损害精子尾部。本研究发现,冻融猪精子PSP-I和PSP-II蛋白基因相对表达量升高,可能与冻融精子活力降低有关,而经金雀异黄酮处理后,冻融猪精子PSP-I和PSP-II基因相对表达量明显降低,与梁莹莹等[1]的研究结果一致,进一步证实公猪精浆中PSP-I基因的表达与精子运动受抑制有关。
动物射精后,SPMI蛋白以前体(52 kD)形式存在,随后精浆内蛋白酶将其降解为17~21 kD小肽,对精子运动的抑制能力也减弱[28]。Iwamoto等[29]研究表明,猪精子SPMI蛋白在精囊腺中特异性高表达,参与精子的运动抑制作用。本研究发现,冻融猪精子中SPMI基因相对表达量升高,可能是冻融精子活力降低的原因之一,而经金雀异黄酮处理后,冻融精子SPMI基因相对表达量明显降低,与梁莹莹等[1]研究认为“金雀异黄酮可提高冻融精子活力”的结果相似,但精子活力的提高还可能是SPMI蛋白与黏附蛋白(PSP-I和PSP-II)共同作用的结果。
4 结 论
金雀异黄酮既能降低冻融猪精子顶体+顶体后区蛋白酪氨酸磷酸化水平,且PKA蛋白活性降低可能与32和69 kD分子量蛋白酪氨酸磷酸化水平降低有关,又可有效提高冻融猪精子中AWN基因及降低PSP-I、PSP-II和SPMI基因的表达量,在一定程度上提高冻融猪精子质量。

