锰胁迫对酸性土壤氮素转化及酶活性和甘蔗氮吸收的影响
潘俊臣,刘芸渟,姚校娟,莫碧霞,唐新莲
(广西甘蔗生物学重点实验室/广西大学农学院,广西 南宁 530004)
1 材料与方法
1.1 试验材料
供试赤红壤采集于广西大学农学院试验研究基地,基本理化性质为:全氮0.73 g/kg,全磷0.87 g/kg,全钾2.54 g/kg,铵态氮38.31 mg/kg,硝态氮20.95 mg/kg,碱解氮74.06 mg/kg,速效磷110.62 mg/kg,速效钾134.78 mg/kg,交换态锰6.83 mg/kg,易还原态锰27.05 mg/kg,有机质9.87 g/kg,pH 5.18。供试甘蔗品种为中蔗9号。供试肥料:氮肥为尿素(N 46%),锰以无水硫酸锰加入,磷肥为过磷酸钙(P2O512%),钾肥为氯化钾(K2O 60%)。
1.2 试验设计
1.2.1 室内模拟酸性土壤锰胁迫培养试验 试验设N1(0.14 g/kg土)和N2(0.28 g/kg土)2个N水平,-Mn(0 mg/kg土)和+Mn(328.00 mg/kg土)2个Mn水平,共5个处理,分别为空白对照(CK)、N1-Mn处理、N1+Mn处理、N2-Mn处理和N2+Mn处理(其中,N1-Mn、N1+Mn、N2-Mn和N2+Mn处理均属于施氮处理,N1-Mn和N2-Mn处理属于无锰胁迫处理,N1+Mn和N2+Mn处理属于锰胁迫处理)。每处理每公斤干土中均加入0.20 g过磷酸钙和0.30 g氯化钾。3次重复。
采集0~20 cm耕层土壤,自然风干后过18目筛,搅拌均匀后称取100.00 g装进白色培养瓶中,将土壤水分调节至最大田间持水量的40%,将培养瓶盖好,瓶盖打6~7个孔以保障减少土壤水分蒸发的同时使其处于好气环境。将所有培养瓶置于培养箱中以25 ℃恒温避光条件预培养1周后,按上述方案加入N、Mn及磷肥和钾肥并混和均匀,再将土壤水分调节至最大田间持水量的60%后继续培养,每隔1 d补充去离子水以维持水分相对恒定。分别于培养的第0、3、7、10、14、21、28、35、42和49天取样,当天测定铵态氮和硝态氮含量,剩余土壤迅速风干保存,用于测定pH、脲酶、蛋白酶和转化酶活性。
1.2.2 盆栽试验 试验方案同1.2.1。试验在玻璃温室中进行,每盆装过5 mm×5 mm筛的风干土20.00 kg,并栽培2株甘蔗,于栽培60 d后收获并取样分析测定甘蔗的株高、干物质累积量、氮吸收累积量和氮素吸收效率等指标。
1.3 测定项目及方法
参考鲍士旦[20]的方法,采用玻璃电极法测定土壤pH(水土比为5∶1),采用0.05 mol/L HCl-0.025 mol/L 1/2 H2SO4法测定土壤有效磷含量,采用半微量开氏法测定土壤全氮含量,采用1.00 mol/L NH4OAc浸提—火焰光度法测定速效钾含量,采用碱解扩散法测定碱解氮含量,采用2.00 mol/L KCl浸提—靛酚兰比色法测定土壤铵态氮含量,采用重铬酸钾容量法—外加热法测定土壤有机质含量,采用1.00 mol/L NH4OAc浸提—AAS法测定土壤交换态锰含量,采用对苯二酚—1.00 mol/L NH4OAc浸提—AAS法测定土壤易还原态锰含量;参考苗杰等[21]的双波长紫外分光光度计法测定土壤硝态氮含量;参照关颂荫[22]的《土壤酶及其研究方法》测定土壤酶活性:土壤脲酶活性采用苯酚—次氯酸钠比色法测定,土壤蛋白酶活性采用Folin-Ciocalteu比色法测定,土壤转化酶活性采用3,5-二硝基水杨酸比色法测定;植物氮含量测定参照鲍士旦[20]的方法,将植物样品烘干粉碎后,采用H2SO4-H2O2消解,自动定氮仪测定氮含量。并计算有关指标。
无机氮含量=铵态氮含量+硝态氮含量
土壤净氨化速率=(培养后的铵态氮浓度-培养前的铵态氮浓度)/培养时间
土壤净硝化速率=(培养后的硝态氮浓度-培养前的硝态氮浓度)/培养时间
土壤净矿化速率=(培养后的无机氮浓度-培养前的无机氮浓度)/培养时间
干物质总累积量=地上部干物质累积量+根部干物质累积量
氮总吸收累积量=地上部氮累积量+根部氮累积量
氮素吸收效率(%)=植株氮素累积总量/土壤速效氮总量×100
1.4 统计分析
试验数据采用Excel 2016进行统计和制图,以SPSS 24.0和Duncan,s新复极差法进行差异显著性分析。
2 结果与分析
2.1 锰胁迫对酸性土铵态氮含量和净氨化速率的影响
由表1可知,在49 d的培养期内,CK的土壤铵态氮含量较低且保持相对稳定,而4个施氮处理的土壤铵态氮含量均呈先升高后降低的变化趋势,并于培养的第7天达最高值,随后迅速下降,但N1-Mn和N2-Mn处理的土壤铵态氮含量下降速度均比N1+Mn和N2+Mn处理快;整个培养期内,4个施氮处理的土壤铵态氮含量均显著高于CK(P<0.05,下同);N1+Mn和N2+Mn处理与N1-Mn和N2-Mn处理相比,除培养的第0天显著降低及第3天无显著差异外(P>0.05,下同),第7~49天均显著提高,至培养结束时,CK及N1-Mn、N1+Mn、N2-Mn和N2+Mn处理的土壤铵态氮含量分别为24.08、56.72、152.95、75.82和199.66 mg/kg,N1+Mn和N2+Mn处理与N1-Mn和N2-Mn处理相比分别显著提高169.7%和163.3%。从表1还可看出,在49 d的培养期内,CK的土壤净氨化速率较低且保持相对稳定,而4个施氮处理的净氨化速率在刚培养时最高,且显著高于CK,随后迅速下降;至培养结束时,N1+Mn和N2+Mn处理的净氨化速率仍显著高于CK,而N1-Mn和N2-Mn处理与CK无显著差异。
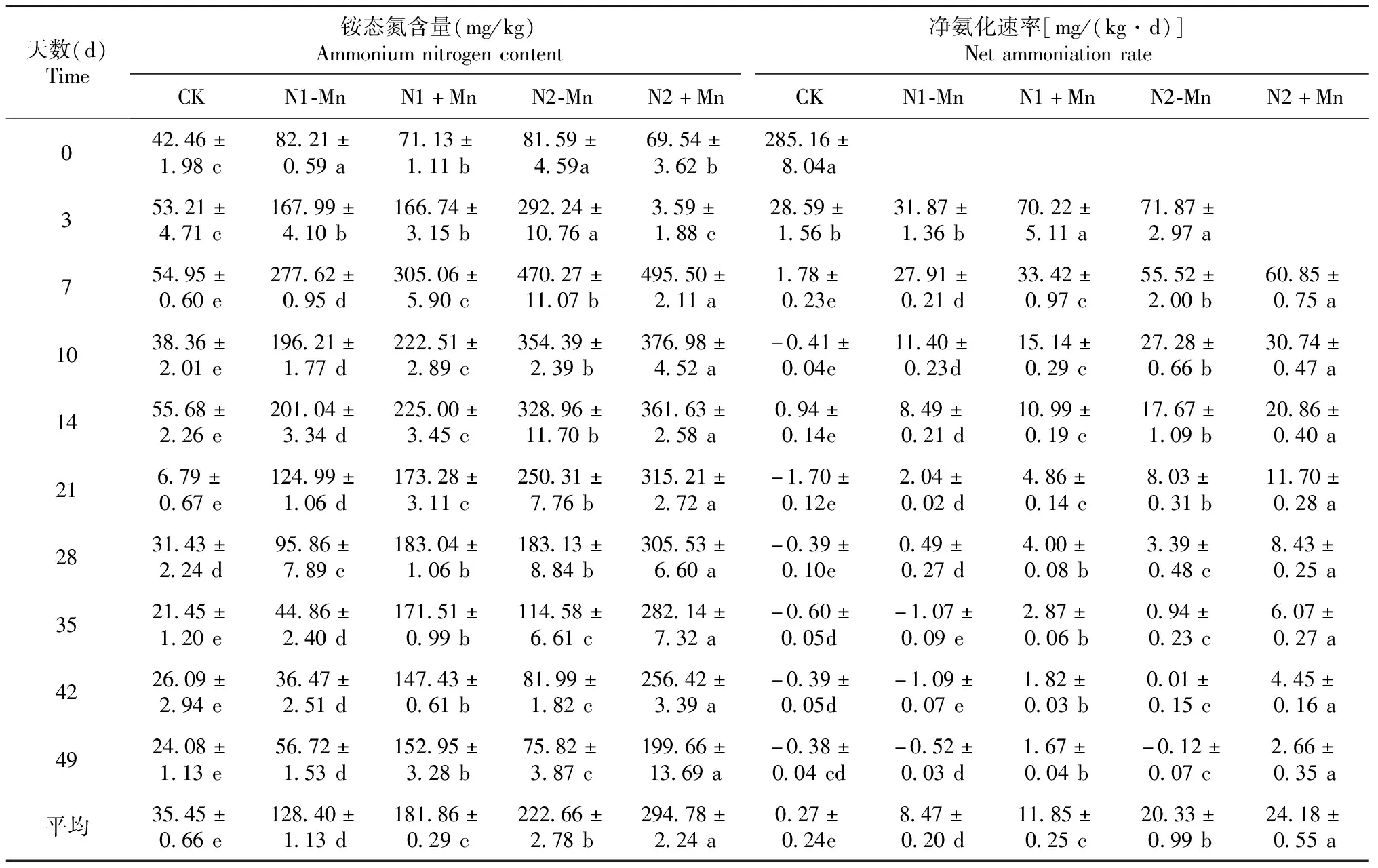
表1 锰胁迫对酸性土铵态氮含量和净氨化速率的影响
综上可知,锰胁迫会抑制土壤铵态氮转化,使土壤中铵态氮含量和净氨化速率显著提高。
2.2 锰胁迫对酸性土硝态氮含量及净硝化速率的影响
表2显示,在培养的前21 d,各处理的土壤硝态氮含量均呈先升高后降低的变化趋势,培养21 d后4个施氮处理的土壤硝态氮含量持续升高,而CK趋于稳定;在49 d的培养期内,N1水平中N1-Mn处理的土壤硝态氮含量与CK相比除第0~3天无显著差异外均显著提高,而N1+Mn处理与CK相比在培养的第0~7天无显著差异,第10~28天显著降低,第35天无显著差异,从第42天起显著提高,N1+Mn处理与N1-Mn处理相比除培养的第0~3天无明显差异外均显著降低,至培养结束时,CK及N1-Mn和N1+Mn处理的硝态氮含量分别为65.55、204.44和107.69 mg/kg,N1+Mn处理与N1-Mn处理相比显著降低47.3%。N2水平2个处理的土壤硝态氮含量变化情况与N1水平相似,但N2+Mn处理的土壤硝态氮含量从培养的第35天开始即显著高于CK,时间有所提前;至培养结束时,N2-Mn和N2+Mn处理的土壤硝态氮含量分别为308.43和159.57 mg/kg,N2+Mn处理较N2-Mn处理显著降低48.3%。
从表2还可看出,各处理的土壤净硝化速率随着培养时间延长的变化规律也呈先升高后降低的变化趋势,并于培养的第14天达峰值,此时土壤净硝化速率为5.56~7.47 mg/(kg·d),处理间表现为N2-Mn处理>N1-Mn处理>CK>N2+Mn处理>N1+Mn处理,且差异显著;至培养结束时,CK及N1-Mn、N1+Mn、N2-Mn和N2+Mn处理的净硝化速率分别为0.87、3.71、1.72、5.84和2.80 mg/(kg·d),其中N1+Mn和N2+Mn处理与N1-Mn和N2-Mn处理相比分别显著下降53.6%和52.1%。
综上可见,锰胁迫会抑制土壤中铵态氮向硝态氮转化,使硝化作用显著减弱,硝态氮含量及净硝化速率显著降低;在培养前期,N1+Mn和N2+Mn处理的硝态氮含量及净硝化速率甚至显著低于CK。
2.3 锰胁迫对酸性土无机氮含量及净矿化速率的影响
如表3所示,各处理的土壤无机氮含量在培养的前21 d均表现为先升高后降低再升高的波动性变化,21 d后均趋于稳定。其中,在49 d的培养期内,4个施氮处理土壤的无机氮含量均显著高于CK;在相同氮水平下,N1+Mn处理土壤的平均无机氮含量较N1-Mn处理显著提高,而N2-Mn处理与N2+Mn处理间无显著差异。
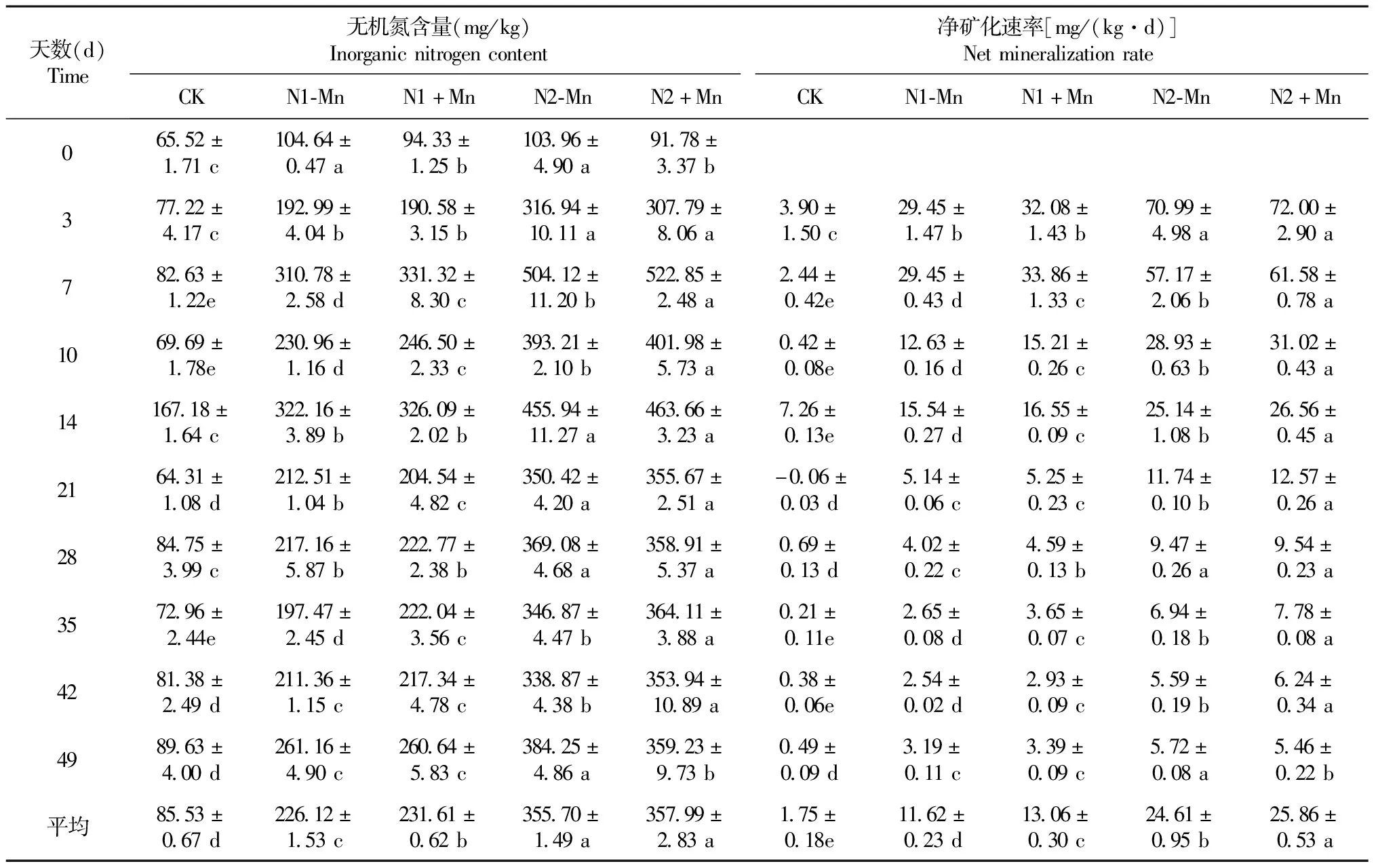
表3 锰胁迫对酸性土无机氮含量和净矿化速率的影响
由表3可知,各处理土壤净矿化速率随着培养时间延长的变化规律表现为在培养的前21 d波动变化,21 d后均趋于稳定;与CK相比,施氮可显著提高土壤的净矿化速率;在同一氮水平下,N1+Mn处理较N1-Mn处理,除培养的第3、21和49天无显著差异外均显著提高,而N2+Mn处理与N2-Mn处理相比,除培养的第3和28天无显著差异、第49天显著降低外均显著提高;在49 d的培养期内,N1+Mn和N2+Mn处理土壤的平均净矿化速率均显著高于N1-Mn和N2-Mn处理。
可见,锰胁迫在一定程度上可提高土壤中的无机氮总量,导致无机氮含量和净矿化速率显著提高。
2.4 锰胁迫对土壤脲酶、转化酶和蛋白酶活性及pH的影响
由表4可知,在49 d的培养期内,CK的土壤脲酶活性波动较小,最大值出现在培养的第10天,而4个施氮处理的土壤脲酶活性均呈先升高后降低再升高的变化趋势,最大值分别在第21、28、7和35天出现,表现为N1-Mn处理>N2-Mn处理>N2+Mn处理>CK>N1+Mn处理;在整个培养期内,N1-Mn处理的土壤脲酶活性与CK相比除第0~7天无显著差异外,第14~28天显著提高,第10、35和49天显著降低;N1+Mn处理与CK相比,除第7、21、28和42天无显著差异外其余均显著降低;N2-Mn处理与CK相比,除第0~3天无显著差异外,第7~28天显著提高,第35~49天显著降低;N2+Mn处理与CK相比,除第7~21天无显著差异外,第28和35天显著提高,第0、3、42和49天显著降低;在同一氮水平下,N1+Mn与N1-Mn处理相比,除第7、10、35和42天无显著差异外,其余均显著降低;N2+Mn与N2-Mn处理相比,除第35天显著提高、第42和第49天无显著差异外均显著降低;CK及N1-Mn、N1+Mn、N2-Mn和N2+Mn处理的平均土壤脲酶活性分别为0.38、0.41、0.30、0.41和0.34 mg/(g·d),其中,N1-Mn和N2-Mn处理与CK无显著差异,N1+Mn和N2+Mn处理较CK显著降低;N1+Mn处理较N1-Mn处理显著降低26.8%,N2+Mn处理较N2-Mn处理显著降低17.1%。
从表4还可看出,在49 d的培养期内,CK及N1-Mn和N2-Mn处理的土壤转化酶活性呈波动性变化,但变幅较小,而N1+Mn和N2+Mn处理的土壤转化酶活性呈现培养初始和结束时高、中间降低保持相对平稳的变化趋势;CK及N1-Mn、N1+Mn、N2-Mn和N2+Mn处理的平均土壤转化酶活性分别为0.61、0.53、1.32、0.67和1.39 mg/(g·d),相互间差异显著,且表现为N2+Mn处理>N1+Mn处理>N2-Mn处理>CK>N1-Mn处理;N1+Mn和N2+Mn处理的土壤转化酶活性在49 d的培养期内均显著高于N1-Mn和N2-Mn处理,平均转化酶活性分别较N1-Mn和N2-Mn处理显著提高149.1%和107.5%。

表4 锰胁迫对酸性土脲酶和蛋白酶活性的影响
表5显示,各处理的土壤蛋白酶活性均随着培养时间的延长呈先降低后升高再降低的波动性变化趋势。其中,在整个培养期内,虽然各处理间存在一定差异,但平均蛋白酶活性间差异均不显著。由表5可知,在49 d的培养期内各处理土壤的pH变化均呈先升高后降低的变化趋势,在培养至第7~14天时达最大值,而后在第14~49天呈下降趋势;在培养的第0~21天,N1+Mn和N2+Mn处理的pH低于N1-Mn和N2-Mn处理,而在第28~49天则相反,N1+Mn和N2+Mn处理的pH高于N1-Mn和N2-Mn处理;在培养结束时,各处理的pH均低于培养初始时,其中,CK的pH下降0.17,N1-Mn、N1+Mn、N2-Mn和N2+Mn处理的pH分别下降1.01、0.26、1.56和0.53,且4个施氮处理的土壤pH均低于CK,N1+Mn和N2+Mn处理分别比N1-Mn和N2-Mn处理提高0.19和0.55。

表5 锰胁迫对酸性土蛋白酶活性的影响
综上可知,锰胁迫对不同土壤酶活性的影响存在差异,其中,可显著降低土壤脲酶活性,显著提高土壤转化酶活性,而对土壤蛋白酶活性无明显影响;在培养初期,锰胁迫会降低土壤的pH,但随着培养时间的延长,锰胁迫土壤的pH提高。
2.5 锰胁迫下酸性土氮素、pH和土壤酶活性的相关分析
相关分析结果(表6)表明,土壤脲酶活性与土壤铵态氮含量呈显著正相关,与pH呈极显著正相关(P<0.01,下同);土壤蛋白酶活性与土壤铵态氮含量呈显著正相关,与pH呈极显著正相关,与土壤硝化速率呈显著负相关,与硝态氮含量呈极显著负相关;而土壤转化酶活性与土壤铵态氮、硝态氮、无机氮含量、土壤氨化速率、硝化速率、矿化速率和土壤pH均无显著相关性。说明不同土壤酶活性与土壤氮素转化间存在一定的关系,但关联程度不同。
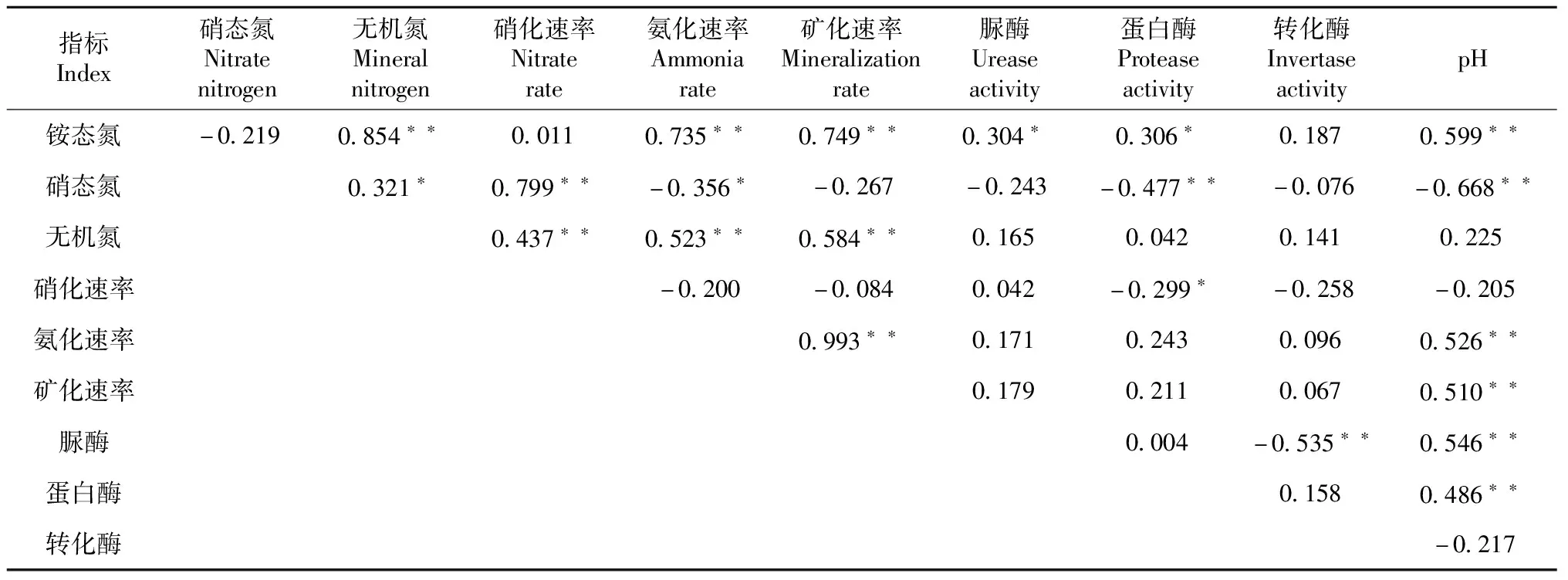
表6 锰胁迫下酸性土氮素、pH和土壤酶活性的相关分析结果
2.6 锰胁迫对甘蔗生长和氮素吸收利用的影响
由表7可知,N1+Mn和N2+Mn处理甘蔗的株高和干物质总累积量均显著低于CK及N1-Mn和N2-Mn处理,其中,N1+Mn处理甘蔗的株高较N1-Mn处理和CK分别下降29.0%和24.5%,N2+Mn处理甘蔗的株高较N2-Mn处理和CK分别下降26.8%和20.0%;N1+Mn和N2+Mn处理甘蔗的干物质总累积量显著低于N1-Mn和N2-Mn处理,其中,N1+Mn处理较N1-Mn处理下降54.4%(地上部下降56.3%,根部下降28.1%),N2+Mn处理较N2-Mn处理下降43.5%(地上部下降43.7%,根部下降42.7%)。可见,土壤锰胁迫使得甘蔗生长受阻,干物质积累量显著降低,且对植株地上部的影响大于根部。
从表7还可看出,N1+Mn和N2+Mn处理甘蔗的氮素累积量均显著低于N1-Mn和N2-Mn处理,其中,N1+Mn处理甘蔗地上部、根部和全株的氮素积累总量分别较N1-Mn处理降低53.4%、42.0%和53.0%,N2+Mn处理较N2-Mn处理分别降低47.3%、50.4%和47.4%;N1+Mn和N2+Mn处理的氮素吸收效率分别较N1-Mn和N2-Mn处理显著降低57.4%和53.3%,也明显低于CK。可见,锰胁迫可抑制甘蔗对土壤氮素的吸收和利用。
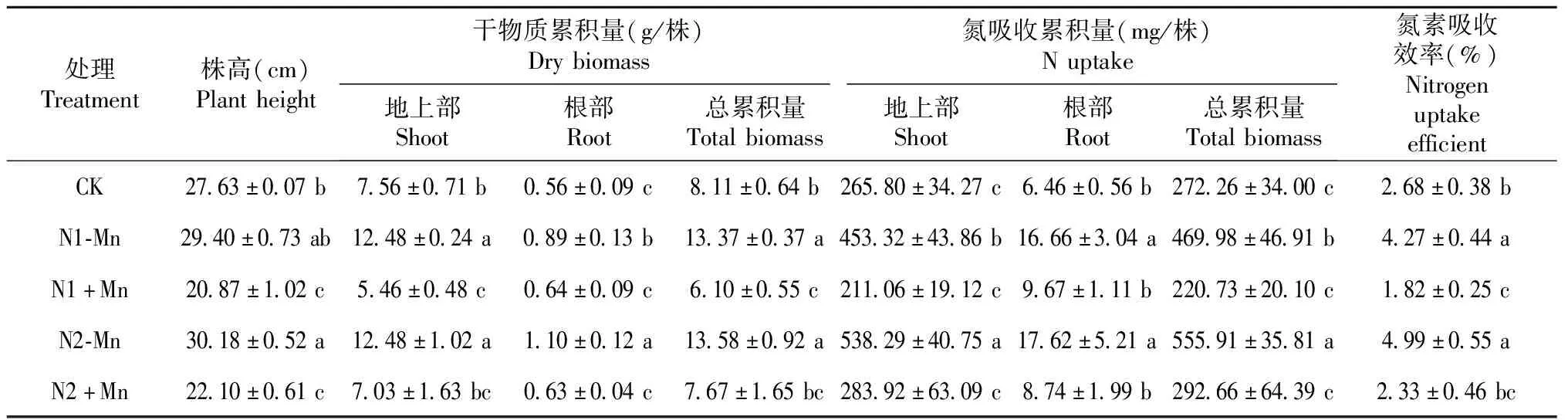
表7 锰胁迫对甘蔗株高、干物质累积量和氮素吸收利用的影响
3 讨 论
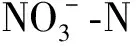
土壤生化活动都是在土壤酶的作用下进行,而土壤酶活性受多种因素影响。重金属污染是土壤污染的重点之一,与土壤酶活性关系密切,但不同种类酶受重金属污染的影响存在差异[16]。已有研究表明,当土壤中Cr、As、Cu、Pb和Zn等重金属浓度达到一定程度时会抑制土壤脲酶活性[31-33],其原因是重金属结合了脲酶的活性部位并生成稳定的络合物[34]。本研究发现,锰胁迫的土壤脲酶活性显著降低,与Tabatabai[15]的研究结果相似,表明锰作为重金属元素之一,在其胁迫下土壤中的锰也可能结合了脲酶的活性部位并生成稳定的络合物,使其活性受到抑制;而锰胁迫对土壤蛋白酶活性无显著影响,与Todorov等[35]研究发现重金属Pb对蛋白酶活性没有影响,Chander和Brookes[36]研究认为铜与脱氢酶活性间关系不密切,脱氢酶不能表征土壤铜污染程度的结果相似,说明土壤蛋白酶对锰胁迫有一定的耐受性,此耐受性可能与土壤锰浓度或土壤中能影响蛋白酶活性的某种锰形态含量过低有关,也有跟锰与土壤蛋白酶间没有专一对应关系有关[37]。本研究中,锰胁迫可显著提高土壤转化酶活性,与Wang等[37]研究认为As胁迫下土壤转化酶活性无显著变化的结果存在差异,可能是因为土壤转化酶作为一种蛋白质需要一定量的某种重金属离子作为辅基,而一定浓度锰的加入能促进其活性中心与底物配位结合,使酶分子及其活性中心保持一定的专性结构,从而改变酶催化反应的平衡性质和酶蛋白的表面电荷,增强酶活性,即锰对土壤转化酶具有激活作用。本研究相关分析结果表明,土壤脲酶活性与土壤铵态氮含量和pH呈显著或极显著正相关,土壤蛋白酶活性与土壤铵态氮含量呈显著正相关,与土壤硝态氮含量和硝化速率呈显著或极显著负相关,说明锰胁迫可通过改变土壤酶活性,进而影响土壤氮素转化。
4 结 论
锰胁迫能抑制酸性土壤的硝化作用,减少铵态氮向硝态氮转化,使土壤铵态氮含量及氨化速率升高,硝态氮含量及净硝化速率降低,并提高土壤净矿化速率,同时使土壤脲酶活性降低,土壤转化酶活性升高,从而减少酸性土壤中甘蔗可利用氮的含量及比例,使甘蔗对氮的吸收利用减少。

