茉莉酸和水杨酸诱导胡椒抗瘟病中生理生化的变化研究
苏岳峰,郑其向,马 晓,李家庆,伍宝朵,胡丽松,范 睿*
(1.海南大学,海南 海口 570000;2.中国热带农业科学院香料饮料研究所,海南 万宁 571533; 3.云南农业大学,云南 普洱 665000)
【研究意义】胡椒(PipernigrumL.)是胡椒科(Piperaceae)胡椒属(Piper)多年生常绿藤本植物,原产于印度,素有“香料之王”、“黑色黄金”的美誉,在人类历史文明进程中占有独特地位[1]。据统计,世界胡椒种植面积达5.53×105hm2,总产量达4.33×105t,目前中国胡椒种植面积近4×105hm2,年总产量近4×104t,主要分布在云南、海南、广东、福建和广西等省(区),其中海南主产区,年均产值高达20多亿元、已发展成为百万人口经济来源的支柱产业[2]。然而,在胡椒产业中,胡椒瘟病作为一种季节性土传性病害,常引发植株木质部褐化,导管变黑腐烂等病状。病情严重时致损高达90%及以上,甚至全园毁灭、颗粒无收[3],严重制约着中国胡椒产业的健康发展。【前人研究进展】针对胡椒瘟病病害,张开明[4]等研究表明,辣椒疫霉(Phytophthoracapsic)是中国胡椒瘟病的主要病原菌,寄主范围广,气候依赖性强,可侵染可可、山龙眼等热带水果和饮料植物以及辣椒、黄瓜等茄科和葫芦科作物[5],已成为热区植物的灾害性病菌。国内外在辣椒作物上用化学杀菌剂、生物拮抗菌开展了较为系统的防治研究,分离出附生细菌金属芽孢杆菌、洋葱芽孢杆菌等生防菌,但杀菌剂的副作用和拮抗菌的寄生性对寄主的危害依然存在较多的争论[6]。近年来,植物外源诱导剂——茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)等作为诱导抗性信号的基本组分,使植物产生抗病性,介导抗性信号激活[7],形成精巧的转导途径和偶联网络、精密地控制各激素的整体水平,成为近年来抗病研究的一大热点[8]。Zhu等研究发现叶面喷施水杨酸处理后能够增强本氏烟对烟草花叶病毒的系统性抗病性[9]。SA信号诱导通过增强组织细胞的活性氧(pathogenesis-related protein,PRs)清除能力和渗透调节能力,可以明显降低白菜根肿病和冬瓜枯萎病的发病率,提高了系统酶活性和抗病性效果[10]。水杨酸处理还提高种胚抗氧化物质还原型谷胱甘肽和渗透调节物质脯氨酸(PRO)等的含量[11]。外源JA处理能够减轻受水稻稻瘟病病发症状[12],还可以有效诱导辣椒对青枯病产生抗性,抗病效应与体内丙二醛(malonic dialdehyde, MDA)以及抗氧化酶活性有关[13]。【本研究切入点】前人研究表明,SA、JA信号通过激发植物体防御机制的建立来参与植物生长发育调控和对外界刺激的响应[14]。【拟解决的关键问题】通过间接、连续和混合方式喷施5 mmol·L-1浓度的 SA、1 mmol·L-1的 JA处理“热引1号”胡椒试验苗,在自然条件下接种辣椒疫霉菌后,通过表型鉴定、次生代谢物质、内源激素动态变化以及各相关防御酶活性的变化研究,阐述JA、SA在胡椒抗瘟病中的作用。
1 材料与方法
1.1 试验材料
供试苗:“以热引1号(P.nigrumc.v.Reyin-1)”胡椒扦插苗作为材料,按照“胡椒优良种苗培育技术规程(DB46/T 262012)”进行育苗,于沙床上培育生根后转移至育苗盆中,每盆2棵苗,培育3~5个月。
供试菌种:辣椒疫霉菌,采用PDA培养基,于全气候箱中恒温(26~28 ℃)培养5~7 d,多次转接纯化培养,以保证菌种活性。供试苗和供试菌种均由海南香料饮料研究所提供。
1.2 试验方法
1.2.1 材料处理 选取健康、长势一致的胡椒苗,按照处理方式分为JA1、JA2、SA1、SA2、JA/SA1、JA/SA2、CK1、CK2 组,每组至少3株苗。CK1、CK2组为对照,用蒸馏水喷施,具体处理如下。SA1组:使用浓度为5 mmol·L-1SA处理,连续处理15 d;SA2组:间隔2 d 喷施5 mmol·L-1的SA;JA1组:单独喷施1 mmol·L-1的JA,连续处理15 d;JA2组:间隔2 d 喷施1 mmol·L-1的JA;JA/SA1组:5 mmol·L-1的SA和1 mmol·L-1的JA混合后,连续处理15 d;JA/SA2组:5 mmol·L-1的SA和1 mmol·L-1的JA混合后,间隔2 d喷施;CK1组:连续喷蒸馏水15 d;CK2组:间隔2 d喷施蒸馏水。
观察JA、SA喷施处理胡椒苗的生长发育状态以及室内接种病原菌后的变化情况,通过表型鉴定,对抗病效果显著的处理进行重复实验。距离采样时间第0、12、24、72和144小时等5个时间点,于早上8:00时接种处理,用浸湿的棉花包裹,以保证病原菌的存活和侵染。用液氮存储,采集 5个接种时间点试验样品,包括根、茎和叶片,用样品袋分装、标记编号、处理方式及接种时间,置于-80 ℃超低温冰箱,同时每个处理随机采取叶龄相似的5~10片叶片,趁鲜取回处理,用于测定电导率。剩余叶片分组置于烘箱,57 ℃恒温烘干至恒重打粉。
1.2.2 表型鉴定 采样:每组各采集5~10片叶,用样品袋分装好,并做好标记。接种:将取回来的叶片整齐摆放到消毒灭菌盘子里,叶片正面朝上,用一次性注射器针头在叶片中央(避开叶脉)刺3个小孔,用打孔器在培养基上取菌丝块,用接种针将生长有菌丝的一面覆盖住小孔,接种在针刺孔处。盘子按照采样标记写上编号,于4个对角分别放上用蒸馏水浸湿的棉花团,用大号采样袋套住,封口,保证湿度。观察:接种第1天起开始观察,每隔1 d观察1次,记录好观察情况,并用卡尺测量叶面坏死区病斑直径大小,按照相关胡椒瘟病抗性评价标准,对各个处理病斑进行级划分[8]。
1.2.3 生理生化指标测定 内源激素测定(双抗体夹心法测定):制备SA、JA、JA/SA和CK喷施前、喷施后(接种前)和接种后3个时间段的叶片样品,按照试剂盒方法进行样品稀释及保存,并多功能用酶标仪测量450 nm波长下各个处理组叶片组织样品OD值,并描点绘制曲线计算样品中植物茉莉酸(JA)的浓度。水杨酸(SA)和植物乙烯(ETH)的测定方法与上述相同、相关试剂盒由上海泛柯实业有限公司提供。
次生代谢物质:测定胡椒叶片(干重)粉末中总黄酮、总多酚及多糖含量变化,按邹文静等植物总黄酮、多酚及多糖的含量测定方法[15]、采用75%乙醇溶剂浸提,建立样品与吸光度值A之间标准线性关系、测定含量。
防御酶PAL和PPO活性:PAL和PPO催化产物在290和420 nm处有特征吸收光值,分别测定290和420 nm处的吸光值变化,计算相对酶活。相关试剂盒由南京建成生物科技、上海泛柯实业有限公司提供。
1.3 数据分析
使用立体显微镜Stemi 2000-C、相机Canon EOS 5D Mark IV观察和采集实验图片,SPSS 2017软件进行数据统计及分析,采用Duncan新复极差法,比较差异及显著性,OriginPro 2017软件进行数据绘图。
2 结果与分析
2.1 外源JA、SA连续处理20 d胡椒苗的变化
由图1可知,5 mmol·L-1SA、1 mmol·L-1JA和JA/SA混合喷施,连续处理20 d,喷施5 mmol·L-1SA和JA/SA幼嫩的茎叶均出现不同程度受损。
2.2 接种病原菌前后表型变化
2.2.1 JA、SA接种病原菌发病前后的叶片变化 从图2可以看出,对照组CK1、CK2最先在48 h发病,SA1、SA2和JA1在72 h出现病斑、JA2发病时间最晚,96 h出现病斑。96 h,所有处理组叶片均表现出瘟病病斑(表1)。
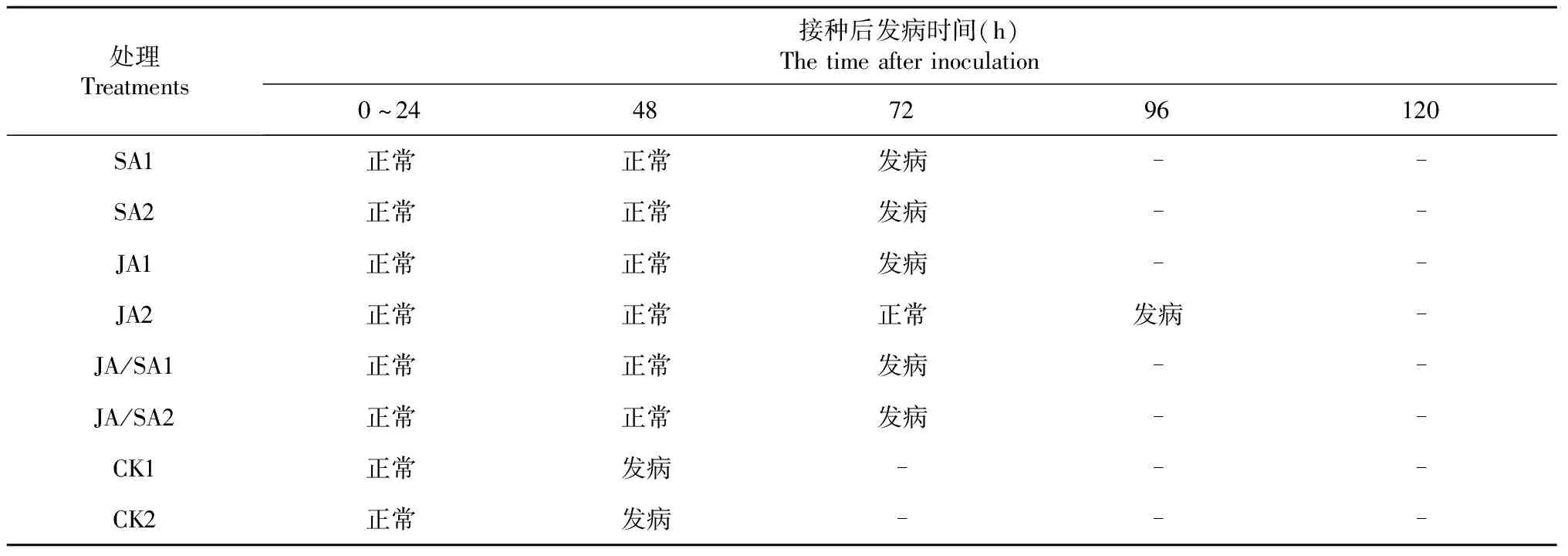
表1 接种胡椒瘟病病原菌的叶片情况
120 h时,CK1组和CK2组病菌沿着叶脉蔓延至叶缘,整个叶片出现黑色水质状病斑,显微镜下可在气孔保卫细胞中央看到白色菌丝附着;与接种后96 h比较,SA1组、JA1组水质状病斑面积不断扩大,所有叶片颜色逐渐变暗,失去绿色光泽(图2)。
2.2.2 接种病原菌后发病情况 由表2可知,JA/SA2组、JA2组病斑相对面积分别为12.50%和15.13%,病情级数均为1级;SA2组、JA/SA1组、SA1组和 JA1组病斑相对面积分别为26.27%、32.18%、33.11%、35.60%,病情级数均为2级。而CK1和CK2则达到了4级病情,病斑相对面积分别为78.34%、76.60%,显著高于各处理组。综合表型、发病情况以及经济效益,JA组、SA组和JA/SA组间隔2 d为比较优良的处理方式,SA2组、SA2组和JA/SA2组为最优处理。

表2 JA、SA接种病原菌后96 h、120 h病斑变化
2.3 JA、SA间隔处理前后内源JA、SA和ETH含量变化
JA2、SA2处理前后胡椒叶片内源JA、SA和ETH含量都发生了不同趋势的变化。内源JA含量变化:由图3-A可知,JA2组、SA2组和JA/SA2组外源剂处理前,叶片内源JA含量维持在1600 pmol·L-1水平;处理后(即接种前)CK2组无明显变化,JA2组、SA2组和JA/SA2组处理均使内源JA有所增加;接种病原菌后,JA2组内源JA含量达到了最高水平,SA2组含量次之,JA/SA2组与接种前相比无明显变化,接种后CK2组内源激素也出现少量增加。
由图3-B可知,JA2、SA2、CK2和JA/SA2外源处理前,叶片内水杨酸含量维持在2700 pmol·L-1水平;处理后(即接种前),CK2组和SA2组叶片内源水杨酸含量与处理前变化程度小,无明显差异,JA/SA2组、JA2组内源水杨酸含量与处理前相比升高。接种后SA2组叶片内源水杨酸含量达最高水平,JA2组次之,CK2组变化幅度相对较小。内源乙烯ETH含量变化:由图3-C可知,JA2、SA2、CK2和JA/SA2外源处理前,叶片内源ETH含量维持在42 ng·L-1水平。JA2组、JA/SA2组的内源乙烯ETH含量达到了84和104 ng·L-1水平,SA2组和CK2组与处理前无太大变化;接种后JA2组、JA/SA2组内源乙烯ETH含量达最高水平为150和160 ng·L-1,SA2组与CK2组内源乙烯ETH含量达70和90 ng·L-1。
2.4 接种病菌后总黄酮、总多酚和多糖含量变化
从图4-A可看出,接种后JA2、SA2、CK2和JA/SA2处理总黄酮含量呈现升高后降低变化,CK接种后第12小时总黄酮含量最高,24、72和144 h出现降低趋势,并且降低较快;JA2、SA2和JA/SA2处理总黄酮含量在24 h达到最高,在72、144 h总黄酮含量均出现降低趋势。
由图4-B可知,JA2、SA2、CK2和JA/SA2处理后接种胡椒瘟病病菌,随着接种时间延长,5个接种时间点所对应的叶片多酚含量均出现下降情况;CK2组的总多酚含量下降幅度较为明显,各时间点均低于JA2组、SA2组和JA/SA2组的,并于144 h达到最低;JA2组、SA2组变化趋势一致,各接种时间点多酚含量均高于CK2组和JA/SA2组。
由图4-C中可知,接种病菌,各处理胡椒组织叶片多糖含量均出现先升高后降低,在24 h多糖含量为最高,而24 h后多糖含量出现下降趋势;CK2组在第12~144小时均呈降低趋势。各接种时间点多糖含量以JA2组最高,SA2组次之,CK2组最低。
2.5 接种病原菌后PAL、PPO活性以及膜质过氧化程度
接种后,JA2、JA/SA2、SA2以及CK2组外源处理胡椒叶片组织内PAL活性变化总体先升高后降低趋势(图5-A),24 h胡椒叶片组织内PAL活力CK2组最高,且其活力变化程度较小,JA2组、SA2组变化趋势相当,是CK2组的1.85倍,JA/SA2组活力是CK2组的1.42倍;在第24~144小时后,各处理活力均出现下降。
由图5-B可知,胡椒叶片组织内 PPO活性在SA2、JA2和JA/SA2中保持较高活性,接种病原菌后,出现先升高趋势;SA2组、JA2组和JA/SA2组变化趋势一致,在72 h SA2组达到最高,是CK2组的1.31倍,JA2组是CK2组的1.2倍,JA/SA2组是CK2组的1.1倍,72 h后降低。而CK2组在24 h的PPO活性达到最高,随后降低。
3 讨 论
水杨酸和茉莉酸在病原菌入侵过程中扮演着不可或缺的角色[16],研究结果表明,喷施5 mmol·L-1SA、1 mmol·L-1JA和JA/SA 混合处理“热引1号胡椒”后,可以有效抑制胡椒瘟病病斑面积扩大,同时不同的处理时间会有不同的效果,具体来说间隔处理方式比连续处理方式对辣椒疫霉菌的抑制力更强。邹志燕等[17]在水稻,金夏红等[18-19]在小麦、烟草上的研究也有相同结果。推测可能是外源JA、SA激活胡椒植株体内产生抗病信号,这些抗性信号提高防御酶活性,从而使得胡椒产生系统获得性抗性和诱导系统抗性。
当JA和SA同时喷施时,胡椒瘟病抗性生理生化效果明显弱于单独喷施JA或SA,与曹宁[20]结果相符,这表明SA、JA在介导胡椒抗胡椒瘟病的过程中可能也存在相互拮抗作用,但是SA与JA信号转导往往不是孤立的,存在交叉转导,转导途径还存在着与浓度有关的协同或拮抗作用[21];JA、SA和JA/SA处理后均使胡椒叶片内源JA、SA有所增加,对照组无明显变化,但接种病原菌后叶片内源JA、SA、ETH含量达到了最高水平,胡椒苗叶片内源JA、SA含量中单独喷施JA或SA比JA/SA混合喷施的高,JA和JA/SA混合喷施处理后可以明显提高胡椒叶片内源ETH的含量。在甜瓜和水稻的研究中,鲁秀梅、徐以华等[22]也发现接种病菌后植株体内源激素JA、SA和ETH含量均显著增加,可能是胡椒在遭到病原菌侵染和外源诱导剂刺激,使得苯丙氨酸解氨酶(PAL)、腺苷酸合成酶(ATP)等酶活性发生变化,解除了对转录因子的抑制[23-24],促进胡椒内源JA和SA大量合成。有研究表明内源JA伴随着乙烯(ETH)的变化而发生变化,ETH与JA存在协作交互作用,而SA含量与JA和ETH没有紧密联系[25]。此外,乙烯既是一种与茉莉酸具有协同作用的抗病信号分子,也可以作为毒力因子致使植物感病,茉莉酸与乙烯信号途径共同调控植保素的合成[26]。
对各处理组接种胡椒瘟病病原菌后,胡椒叶片组织内PAL活性变化情况总体表现为先升高后降低趋势,PPO也先升高后又降低;而CK处理各接种时间点PAL活力明显低于其它3个处理。这与纹枯病毒素侵染水稻和冬瓜枯萎病防治等研究中表现相似[27]。苯丙氨酸解氨酶(PAL)在植物抗病、生理代谢等过程中不可或缺,是水杨酸途径中的限速酶,也是苯丙烷类代谢过程的关键酶,并参与黄酮、多酚等抗菌物质的合成[28-29];研究表明接种病原菌后,胡椒叶片组织内PPO活性在SA、JA和JA/SA中依然保持较高活性,接种病原菌后,出现先升高后降低趋势,胡椒叶片组织多酚含量在0~144 h中均出现降低,CK下降速度较快,胡椒叶片内多酚的降低与PPO多酚氧化酶关系密切,可能是PPO参与了胡椒叶片中多酚的催化氧化,产生对病原菌有毒害作用的醌类等物质,并参与机体中木质素的合成,增加细胞结构木质化程度,从而有效抑制病原物的扩展[28]。
4 结 论
5 mmol·L-1SA、1 mmol·L-1JA和JA/SA 混合处理“热引1号胡椒”后,可以抑制胡椒瘟病病斑面积扩大。JA、SA抗病信号传导是一个复杂的网络,在众多的高植物中表现出相似性,可能JA、SA在这些植物中存在相同的调节信号。而JA、SA信号中存在的拮抗或协同效果与其相对浓度有关,如果对拮抗点和协同点进行人为调控,挖掘抗病相关基因,可为抗病机理、创新种质资源及遗传育种奠定基础,研究作物中JA、SA的作用在农业上具有重要意义。

