免疫球蛋白G糖基化修饰的质谱分析方法及其应用
赖治臻,周巾煜,李智立
(中国医学科学院基础医学研究所/北京协和医学院基础学院,北京 100005)
免疫球蛋白(Ig)是一类与抗原特异性结合,具有免疫功能的糖蛋白。依据重链氨基酸序列的不同可分为IgG、IgM、IgA、IgD、IgE五类,其中,IgG是人体血液中含量最高的免疫球蛋白,约占免疫球蛋白总量的75%~80%[1]。当人体受到非己成分入侵或自身细胞衰老、损伤、病变时,IgG不仅可以识别异常细胞,还可以通过抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity, ADCC)、补体依赖的细胞毒作用(complement-dependent cytotoxicity, CDC)以及抗体依赖细胞介导的吞噬作用 (antibody-dependent cell-mediated phagocytosis, ADCP)等效应功能发挥免疫效应。在过去的几十年间,国内外学者利用IgG的分子结构特征,监测机体内IgG在疾病发生发展过程中的变化规律,探索其作为自身免疫性疾病和癌症等疾病的生物标志物的潜力,并设计了基于靶向IgG的治疗药物,为疾病的诊疗提供了新途径[1]。
与核酸和蛋白质合成相比,糖链合成没有固定的模板,并且糖链具有复杂的分支结构、连接方式和空间构型,这使得糖基化修饰分析成为蛋白质结构表征中最具挑战性的任务之一。随着基质辅助激光解吸电离(MALDI)和电喷雾电离(ESI)技术的发展,质谱技术已成为蛋白质糖基化修饰研究中广泛应用的分析手段。然而,糖蛋白的高动态范围、糖基化修饰固有的低丰度、与无糖基化修饰肽段的共存等所导致的离子抑制以及糖链结构的高度异质性等因素,使得质谱技术表征蛋白糖基化修饰面临挑战[2]。2019年,全球76个实验室采用不同技术方法从完整糖蛋白、糖肽或糖链等不同层面对单克隆抗体蛋白NISTmAb的糖基化修饰进行鉴定,发现抗体高丰度聚糖的质谱鉴定结果的重复性较好,而低丰度聚糖鉴定结果的重复性较差[3]。本文将综述IgG糖链、糖肽和完整糖蛋白水平的质谱分析方法,及其在疾病研究和药物研发中的应用。
1 IgG的结构
1.1 IgG的合成
Ig的多肽链由3个常染色体基因编码,这3个基因簇分别被称为H-、κ-和λ-基因家族,分别编码所有亚类的重链、κ-轻链、λ-轻链。人类的H、κ、λ基因家族分别在14号、2号、22号染色体上。每个重链由4种不同类型的基因片段编码,分别为可变区(VH)、多变区(D)、连接区(JH)和恒定区(CH)。Ig分子的轻链由VL、JL和CL 3个基因片段编码,重链的可变区域由VH、D、JH段编码。CH的基因片段决定重链的类别,而VH、D和JH区域决定免疫球蛋白分子的抗原识别部分。Ig根据其重链类型α、δ、ε、γ、μ可分为IgA、IgD、IgE、IgG和IgM五种类型。VH、D和JH基因片段共同编码IgG重链的可变区,Cγ1、Cγ2、Cγ3和Cγ4基因片段分别编码IgG1、IgG2、IgG3和IgG4的恒定区,编码基因转录成mRNA后,在核糖体中分别翻译成IgG轻链和重链分子,最后由2条相同的轻链(约25 kDa)和2条相同的重链(50~70 kDa)经二硫键组装为完整的IgG分子。二硫键位于CH1和CH2之间的铰链区,铰链区不仅负责连接2条重链,还影响抗原结合片段(Fab)与结晶片段(Fc)间的灵活性。其中,Fab由VL、CL、VH、CH1组成,负责与抗原相结合;Fc由CH2和CH3组成,负责行使效应功能,示于图1。
1.2 IgG亚类
IgG重链恒定区的差异主要表现在铰链区氨基酸数目、二硫键数目和氨基酸序列的不同,可分为IgG1、IgG2、IgG3和IgG4四个亚类[4],示于图2,从而导致IgG与protein A、protein G、补体分子(C1q)、Fcγ受体(FcγR)等蛋白的结合能力不同,列于表1。IgG亚类在人体免疫系统中分别承担不同的功能。抗体对某些抗原反应的刺激可导致某些IgG亚类的选择性增加[5-6]。IgG1铰链区域包含15个氨基酸残基和2个链间二硫键,其Fab片段可绕其对称轴旋转,IgG2铰链区有12个氨基酸残基和4个链间二硫键[7],IgG3铰链区包含62个氨基酸残基(21个脯氨酸和11个半胱氨酸)和11个链间二硫键,形成了1个多脯氨酸双螺旋结构[7],IgG4铰链区包含12个氨基酸残基和2个链间二硫键,其铰链区柔性顺序为IgG3>IgG1>IgG4>IgG2[8]。
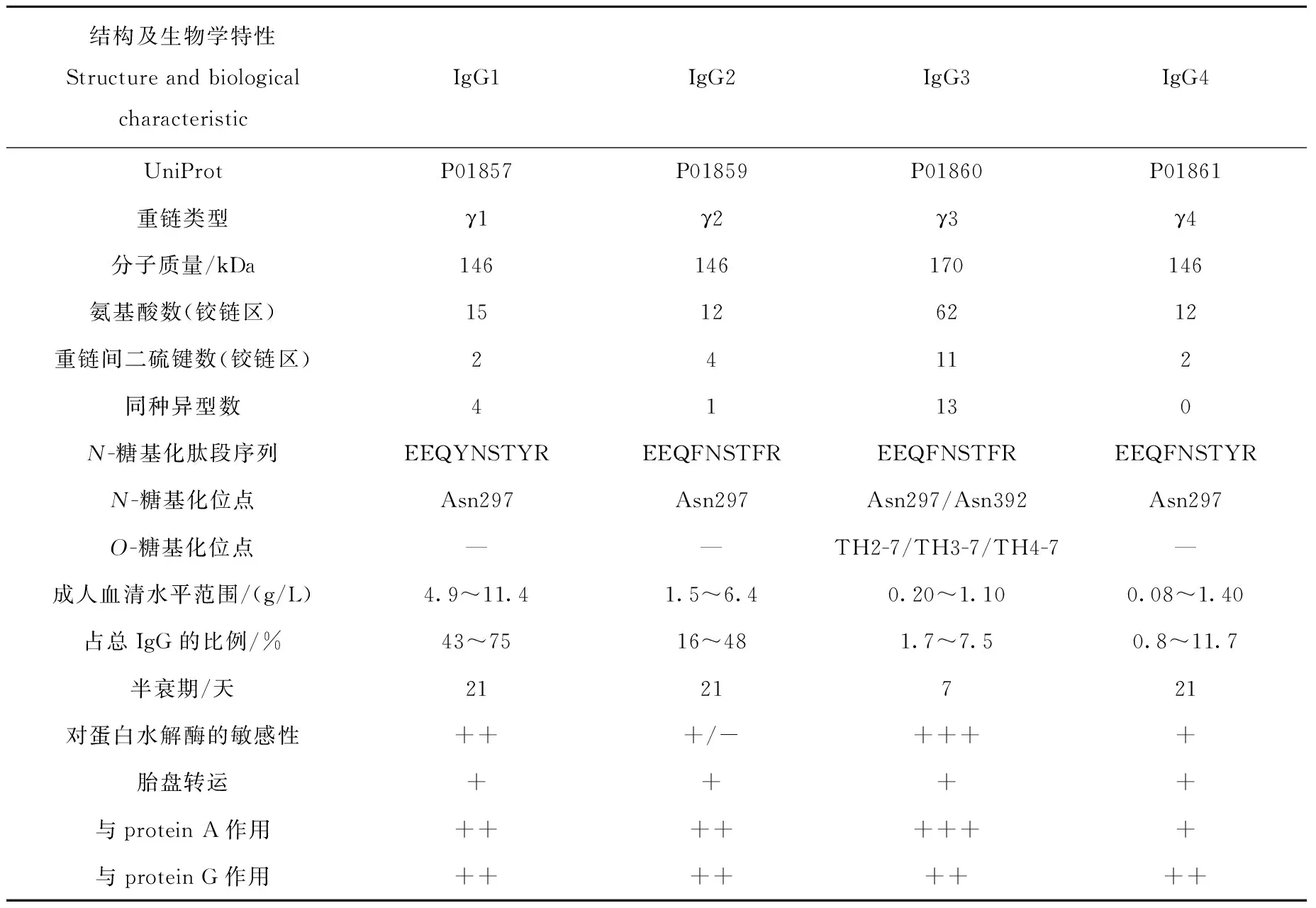
表1 IgG结构及生物学特性Table 1 Structures and biological characteristics of IgG

注:轻链:2号和3号染色体分别编码κ和λ轻链,经转录和翻译过程,产生不同的轻链;重链:14号染色体上VH、D、JH基因片段共同编码IgG重链的可变区(VH);Cγ1、Cγ2、Cγ3和 Cγ4基因片段经转录和翻译过程,分别产生IgG1、IgG2、IgG3和IgG4分子;此外,分别编码IgM、IgD、IgA1、IgE和IgA2的基因片段Cμ、Cδ、Cα1、Cε和Cα2也位于14号染色体上图1 IgG重链和轻链的合成过程Fig.1 Synthesis process of IgG heavy chain and light chain
2 IgG糖基化修饰
蛋白质糖基化修饰可改变效应蛋白的溶解度、半衰期以及与受体的相互作用等,从而影响其生理特性[9-11]。根据糖链与蛋白连接方式的不同,糖基化修饰主要分为N-连接和O-连接两种:大多数IgG分子仅在重链CH2区的Asn297位点连接N-糖链,约10%~20%的IgG分子在Fab区有N-糖基化修饰;少数IgG分子有O-糖基化修饰。N-糖链结构一般分为高甘露糖型、杂合型和复杂型3种类型。N-糖链均有1个共同的五糖(GlcNAc2Man3)核心结构[12]。IgGN-糖链多为双天线复杂型,常带有核心岩藻糖残基(Fuc)、平分型N-乙酰葡糖胺残基(GlcNAc)、末端半乳糖残基(Gal)或末端唾液酸残基(Neu5Gc)修饰。
3 IgG糖基化修饰的质谱分析方法
由于蛋白糖基化修饰具有高度的异质性,且丰度较低,一般在质谱鉴定前需要进行样本的前处理。目前,对IgG糖基化修饰的分析主要从糖链、糖肽和完整糖蛋白3个不同视角解析糖基化修饰状态和类型。
3.1 IgG的分离纯化方法
为满足基础或临床研究的需要,基于蛋白质相互作用原理的protein A和protein G亲和纯化方法已逐渐取代了硫酸铵沉淀法[14],并成为目前从血液中分离IgG的常用方法。聚丙烯酰胺凝胶电泳也常用于IgG的分离,但存在回收蛋白较难、分离效率较低等问题。
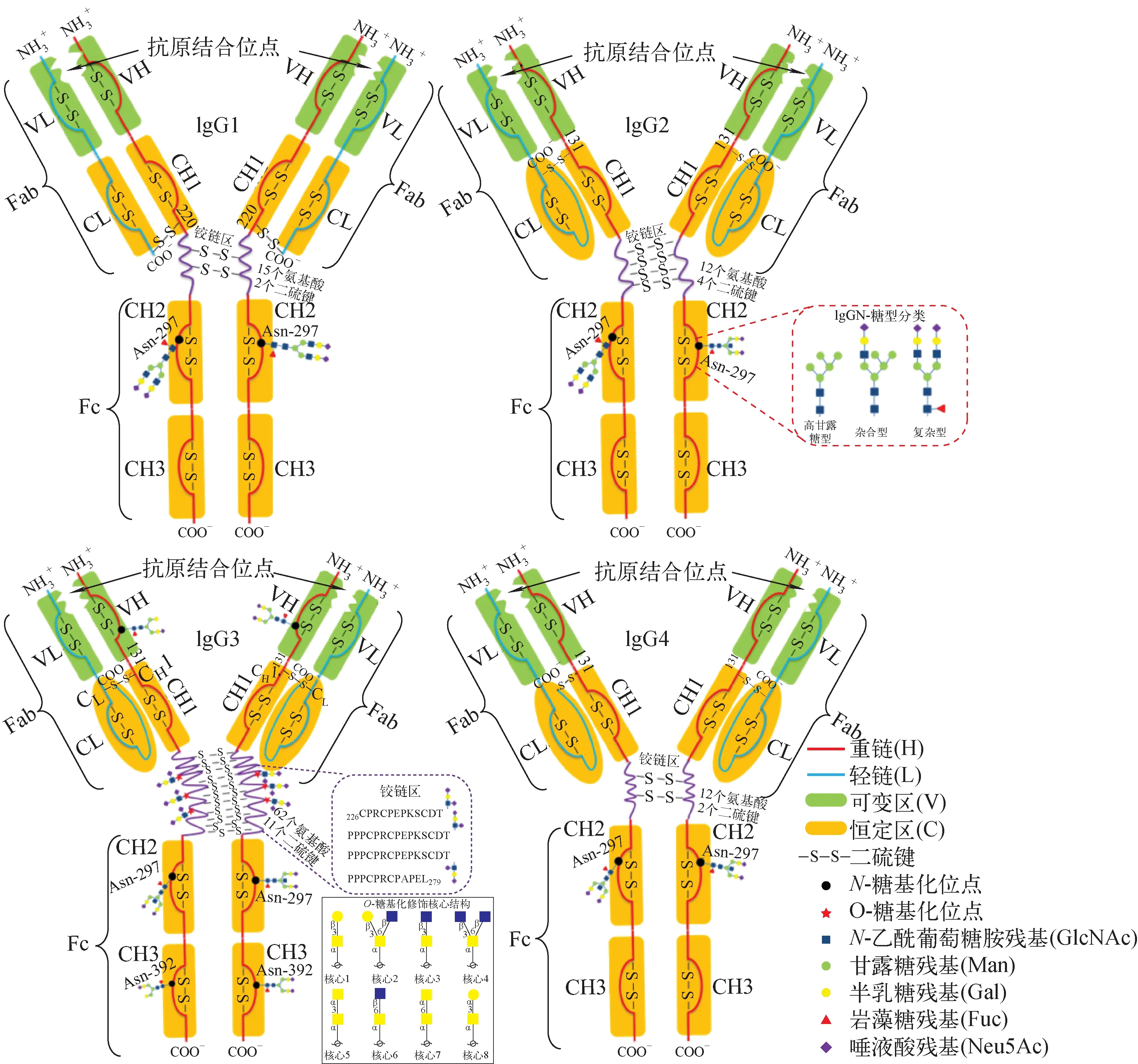
注:IgG根据氨基酸序列不同可分为IgG1、IgG2、IgG3和IgG4;IgG糖基化修饰N-连接的三种糖链类型:除由2个N-乙酰葡萄糖胺和3个甘露糖组成的五糖核心外,因单糖的种类和连接方式的不同N-糖链可分为高甘露糖型、复杂型和杂合型;O-连接的8种核心型糖链:O-糖链通过N-乙酰半乳糖胺与肽链相连,按N-乙酰半乳糖胺3位或6位上β连接的半乳糖、β连接的N-乙酰葡萄糖胺和α连接的N-乙酰半乳糖胺可分为8种核心型图2 IgG亚类结构及糖基化修饰的异同Fig.2 Similarities and differences of glycosylation of IgG subclass structures
3.2 糖链的分析
3.2.1糖链释放方法 糖链释放可采用生物酶解和化学水解的方法。N-糖苷酶F(PNGase F)[15]、N-糖苷酶A(PNGase A)[16]、糖苷内切酶H(Endo H)[17]和糖苷内切酶S(Endo S)[18]是常用的从蛋白质氨基酸链上酶解糖链的糖苷酶。PNGase F可用于糖肽或完整蛋白上连接的糖链释放[15];Endo H仅可酶解高甘露糖型寡糖链[19]。肼解法[20]、高碘酸氧化-β消除法[21]、三氟乙酸法[22]、三氟甲磺酸法[23]等是常用的化学水解法,其中肼解法可实现对肽段上N-糖链和O-糖链的同时释放[24-25]。
3.2.2糖链衍生方法 为提高检测糖链的灵敏度,通常利用荧光标记试剂(如2-氨基苯甲酰胺(2-AB)[26]、2-氨基苯甲酸(2-AA)[27]和2-氨基吡啶(PA)[28])衍生,随后采用液相色谱分离,紫外光谱分析。研究发现,HPLC-MS分析2-AA标记的糖链灵敏度高于2-AB标记[29]。利用1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生糖链结合离子迁移质谱,可实现对糖链异构体的分离[30]。利用8-氨基芘-1,3,6-三磺酸(APTS)标记结合离子对辅助萃取(IPAE)与亲水作用色谱(HILIC),可实现对糖链的分离纯化[31]。
3.2.3糖链纯化方法 纯化标记糖链的主要策略有固相萃取(SPE)[29]、凝胶色谱[32-34]和荧光标记法[35]。固相萃取利用分析物在固定相中的吸附能力不同纯化糖链,常用的固定相有反相(RP)填料、多孔石墨化碳(PGC)、HILIC和高效阴离子交换色谱(HPACE) 填料等,各分离方法的特点列于表2。利用HILIC-SPE可富集糖样本[36],PGC-LC-ESI MS联用技术可同时对糖蛋白中的N-糖链和O-糖链混合物进行分离鉴定[37-38]。随着质谱技术的不断发展,已开发出不同策略的IgG糖链纯化方法[39-41]。

表2 常用的糖链分离纯化方法Table 2 Typical methods for glycan chain separation and purification
3.2.4糖链的质谱分析 糖链质谱分析常用的离子化技术为MALDI和ESI,二者均为软电离技术,具有很强的互补性,并兼具高通量、高分辨率、高灵敏度等特点,但由于离子化可能引起唾液酸残基等不稳定糖苷键的断裂,分析前需要对糖链进行(全)甲基化衍生或对唾液酸残基进行衍生保护[49]。其中,MALDI是一种快速、简单的糖链离子化方法,对盐等干扰物的耐受力强,因电离产生的离子多为单电荷而便于解析;ESI-MS与液相色谱联用可实现对复杂糖链混合物的在线分离。此外,结合各种离子碎裂技术可利用串联质谱对糖链结构进行鉴定。
3.3 糖肽水平的质谱分析
3.3.1IgG糖肽的制备 糖链水平的分析不能提供其连接位点的信息,而在IgG糖肽水平上的分析不仅可获得糖型信息,还可获得糖基化修饰位点的信息[50]。用胰蛋白酶[51]、谷氨酸蛋白酶(Glu-C)[52]、赖氨酰肽链内切酶(Lys-C)[53-54]和木瓜蛋白酶[55-56]、胃蛋白酶[57]、链球菌IgG降解酶(IdeS)[58-59]和链霉蛋白酶[60]等可获得特异性或非特性的IgG糖肽。
3.3.2糖肽的富集 凝集素亲和法:凝集素是一类糖结合蛋白,能专一地识别某一特殊结构的单糖或聚糖中特定的糖基序列,并与之发生非共价且可逆的结合[61]。一种凝集素仅能富集某一特殊结构的糖链,很难实现对不同种类糖链结构的同时分析[62]。化学反应法:糖链具有特殊的多羟基、醛基等结构,可与化学材料分子的特殊官能团发生反应,形成较稳定的共价或非共价加合产物,从而实现对糖肽的分离富集,如硼酸化学反应法[63]和酰肼化学反应法[64]等。前者在碱性环境下,硼酸与糖残基的顺式1,2-二羟基之间可形成稳定、可逆的硼酸酯共价键,将糖肽结合到固相载体上;而在酸性环境下,酯键可发生水解反应释放糖肽,从而实现糖肽与非糖肽的分离。后者基于氧化后糖链中生成的醛基,与酰肼形成共价键实现糖肽的富集分离,其缺点是易破坏糖链结构。亲水/疏水相互作用法:基于亲水或疏水相互作用开发的多种糖肽富集材料已广泛用于糖肽的分离富集,如C18[65]、二氧化钛(TiO2)[66-67]、g-C3N4[68]、功能化磁性纳米材料[69-71]和天然固相萃取材料(棉花固相萃取柱[72]、杨絮和木棉[73]等)。其中,HILIC的原理主要是糖肽中糖链结构的亲水基团(如羟基和羧基等)与上述材料中的官能团形成较稳定的氢键,然后在酸或碱环境下破坏氢键获得糖肽。目前,基于HILIC原理开发的磁性纳米材料在糖肽富集策略中不仅具有较强的糖肽富集选择性,而且具有通量高、操作简便、经济环保等优点[2,74],受到研究者的青睐。
3.3.3糖肽的质谱分析 在质谱分析过程中,糖肽因结构复杂、分子质量大、离子化效率低、残留多肽干扰而较糖链分析更加困难。目前报道的糖肽分析方法主要有一级质谱(full scan mass spectrometry, MS1)和串联质谱(trandem mass spectrometry, MS2)。MS1水平的糖肽分析:糖肽在MS1水平的直接鉴定依赖于高分辨质谱仪采集糖肽精确分子质量的同位素分布数据。在多肽中,其主要组成元素为C、H、N 等(同位素间均只有1 u差异)。然而,糖肽中含有较多的氧元素,自然界中16O与18O之间存在2 u差异。因此,其特征性的同位素峰型在理论上可以用于糖肽的识别和鉴定,但对质谱仪的性能要求较高。MS2水平的糖肽分析:糖肽的鉴定一般通过串联质谱结合数据库搜索进行确定。常见的串联质谱碎裂方式有碰撞诱导解离(collision induced dissociation, CID)、高能碰撞解离(higher energy collisional dissociation, HCD)、电子转移解离(electron transfer dissociation, ETD)、电子捕获解离(electron capture dissociation, ECD),以及组合型EThcD(electron-transfer/higher-energy collision dissociation)和 CID+HCD等。CID碎裂技术能量较高,糖肽裂解作用于肽链上的聚糖,产生一系列与聚糖裂解有关的碎片离子[75]。然而,因糖肽的分子质量较大,CID-MS2图谱无法检测到氧鎓离子信号,不利于糖肽MS2谱图的解析。ECD和ETD可选择性地裂解肽段主链,通过产生的肽碎片离子和由连接的聚糖产生的质量位移确定肽序列和N-糖链连接的位点[76]。随着质谱仪的发展,特别是质谱的碎裂技术,将糖肽分析的主要瓶颈转移到高通量、高可信度的谱图解析所需的软件解决方案上[77]。
3.4 完整蛋白水平的分析
在完整蛋白水平分析IgG糖基化修饰的优势在于能够最大程度地简化样本制备过程,同时,这种分析策略可以获得整个IgG分子上的糖基化修饰信息,可用于研究2条重链上不对称的糖型分布[78]。完整蛋白水平上糖型分析的手段之一是凝集素。根据凝集素能够与不同糖型特异性结合的性质,通过与荧光标记、酶联反应或质谱技术联用,可以实现完整蛋白糖基化修饰的定性和定量分析[78-79]。为解决IgG蛋白分子在进行质谱检测时由于分子质量过大而导致的分析困难,多数研究采用木瓜蛋白酶[55-56]、胃蛋白酶[57]、无花果蛋白酶[80]或链球菌IgG降解酶(IdeS)[58-59]等将IgG酶解为Fab和Fc相关片段,示于图3,或者采用直接打开二硫键的方式将IgG分解成轻链和重链[51,81],以减小待分析物的分子质量,降低质谱分析难度,提供更精确的糖型信息。
3.4.1IgG Fab和Fc的分析 质谱分析一般只提供Fc糖基化修饰的信息,结合超高效液相色谱(UPLC)技术可获得Fc和Fab结构域糖基化修饰的信息。IgG Fab结构域的氨基酸序列与体细胞的突变密切相关,因此,Fab糖基化修饰分析非常复杂。利用IdeS酶对IgG酶解,产生F(ab’)2和2个Fc片段,可实现Fab和Fc片段的分析,示于图3。Fc片段可以与protein G结合,糖基化的F(ab’)2碎片随后在PNGase F酶作用下进行多糖释放。PNGase F多糖释放和唾液酸乙基酯化或2-AA多糖标记已成功用于Fab和Fc特异性糖基化修饰分析[82]。通过改变离子导向装置电压参数,开发了一种用于IgG Fab和Fc片段表征的N端Top-down测序方法[83]。应用傅里叶变换离子回旋共振质谱对人IgG1进行Top-down和Middle-down MS的深度表征,获得了详细的序列数据[84]。

注:IdeS将IgG酶解后产生1个F(ab’)2和2个Fc片段;木瓜蛋白酶将IgG酶解后产生2个Fab和1个Fc片段;胃蛋白酶将IgG酶解后产生1个F(ab’)2和Fc碎片肽段,酶解时间延长,F(ab)2进一步裂解产生2个Fab片段;无花果蛋白酶在4 mmol/L半胱氨酸溶液中酶解IgG产生1个F(ab’)2和碎片化的Fc肽段,在25 mmol/L半胱氨酸溶液中酶解产生2个Fab和碎片化的Fc肽段图3 完整IgG质谱分析酶解示意图Fig.3 Enzymatic hydrolysis schematic of complete IgG mass spectrometric analysis
3.4.2单克隆抗体药物的分析 由于多克隆抗体(如血清IgG)的可变区存在极大的序列异质性,质谱技术在完整IgG分子水平分析糖基化修饰的应用大多集中在单克隆抗体上[85]。因IgG Fc区糖基化修饰对治疗性抗体的安全性和临床疗效有着深远的影响,因此,高效的糖蛋白定量分析技术对治疗性抗体的开发和质量控制起着重要作用,其中IgG Fc的糖谱被认为是药物疗效的关键。Top-down MS已成为蛋白质鉴定的一种可行选择,尤其在治疗性抗体药物结构表征上有着迫切的需求[86]。结合多种碎裂技术(如,ETD、ECD和基质辅助激光解吸电离源衰变(MALDI-ISD))的Top-down和Middle-down MS分析已用于表征单克隆抗体 IgG1和融合IgG蛋白[87],可提供有关糖基化位点和不同组合蛋白种类的信息。
4 IgG糖基化修饰与生理、病理状态的关系
4.1 IgG Fc N-糖基化修饰与生理状态的关系
血清IgG的糖型组成与机体的生理状态相关,其糖基化修饰水平与年龄密切相关[88],尤其在57岁以下人群中差异更为明显[89],其相关性并非单一的正负关系[51]。在25岁时,IgG半乳糖基化修饰约为20%~30%;70岁时约为40%[90-91]。随着年龄增长,Fc段的核心岩藻糖基化修饰水平呈下降趋势,而平分型N-乙酰葡糖胺修饰水平则表现为上升趋势[92-93]。除与年龄相关外,IgG糖链组成还与性别相关,在60岁以下人群中的差异尤为显著[94]。与男性相比,女性血清IgG的半乳糖基化水平显著高于同年龄组男性,并且随着年龄增加而下降的趋势变得更为明显[51,94]。这可能是IgG半乳糖基化修饰在一定程度上受雌激素浓度的影响,如妊娠期水平升高[95],绝经后水平降低[96]。此外,雌激素在女性体内作为IgG半乳糖基化修饰的调节剂,揭示了一种与性别相关的免疫反应调节机制[97]。
4.2 IgG Fc N-糖基化修饰与病理状态的关系
IgG糖基化修饰在病理状态下将发生显著改变。自身免疫性疾病(如风湿性关节炎和系统性红斑狼疮患者)与健康人IgG糖链有着显著差异[98-100]。血清中的IgG不仅包含与疾病密切相关的IgG,还包含健康人体固有的自身抗体和稳态抗体。与疾病不相关的IgG糖基化修饰会干扰与疾病密切相关的IgG糖基化修饰的检测,甚至可能掩盖与疾病密切相关的IgG糖基化修饰变化趋势。因此,为更精准地研究疾病对IgG FcN-糖基化修饰的影响,需要关注对疾病特异IgG(DSIgG)的研究。采用Native-PAGE可分离出与疾病相关的免疫炎症蛋白复合物,再结合SDS-PAGE分离技术,可以从人血液中分离得到DSIgG,可对IgG Fc段糖基化修饰进行深入研究[81]。
IgG Fc糖基化修饰在不同慢性疾病,如甲状腺癌[51]、肺癌[101]、非小细胞肺癌[102]、胰腺癌[103]及胃癌[81]等中均发现了异常变化。利用基质辅助激光解吸电离-傅里叶变换离子回旋共振质谱分析了IgG2 Fc 6种岩藻糖基化修饰(如G0F、G1F、G2F、G0FN、G1FN和G2FN),可用作胰腺疾病诊断的潜在标志物。肺癌患者的IgG1 Fc半乳糖基化修饰呈下降趋势[101],且IgG Fc糖基化修饰形式可作为区分非小细胞肺癌和肺部良性疾病的潜在个体化标志物[102]。研究还发现,半乳糖基化修饰、唾液酸化修饰及N-乙酰葡糖胺基化修饰(GlcNAc)与这2种病理状态密切相关[81]。IgG糖基化修饰的改变极大地改变了其生物学功能,并与个体的年龄、性别和疾病状态相关[51,89,93,104]。其中,核心岩藻糖基化修饰、唾液酸化修饰、半乳糖基化修饰、平分型N-乙酰葡糖胺基化修饰和高甘露糖基化修饰[105]对IgG的物理化学特性有着重要影响。近年来的研究表明,IgG糖链结构变化与疾病状态密切相关,IgG糖链结构变化可为自身免疫性疾病和肿瘤的诊断与监测提供新的策略。
4.2.1核心岩藻糖基化修饰 IgG FcN-糖链结构变化可通过影响与Fc结合的各种受体的能力来调节抗体效应功能。核心岩藻糖基化修饰的寡糖是在高尔基体中通过岩藻糖基转移酶FUT8从GDP-Fuc上转运来的岩藻糖残基合成而来。IgG Fc核心岩藻糖会影响与FcγRIIIa的结合,且表现为非岩藻糖基化修饰的抗体与FcγRIIIa的结合最强[106]。体外实验表明,采用化学酶法生成的IgG1糖苷,去除核心岩藻糖对IgG与FcγRIIIa的结合和抗体的ADCC作用有着显著的增强作用,且唾液酸在核心岩藻糖修饰下可对ADCC产生不利的影响[107]。相对于缺乏岩藻糖的IgG,糖链结构中的核心岩藻糖降低了IgG抗体与IgG FcγRIIIa的结合,导致ADCC活性降低。胃癌患者中Fc核心岩藻糖基化修饰水平在疾病的Ⅱ期和Ⅲ期阶段表现出较明显的升高,表明核心岩藻糖基化修饰可能与胃癌的进展相关[108]。在卵巢癌患者的核心岩藻糖基化修饰研究中也观察到类似的现象[109]。
4.2.2唾液酸化修饰 唾液酸修饰作为糖链末端唯一带电荷的糖残基,对抗体Fc结构的影响最大[110]。单唾液酸化修饰的IgG约占10%左右[111-112],双唾液酸化修饰的IgG约占1%[113]。Fc高唾液酸化修饰会降低IgG与FcγRIIIA受体,以及其与细胞表面抗原结合的亲和性,导致ADCC作用减弱,IgG的功能由促炎转为抗炎作用[114]。在癌症患者中,单唾液酸化修饰的IgG呈下降趋势,而双唾液酸化修饰的IgG呈上升趋势[115]。
4.2.3半乳糖基化修饰 IgG半乳糖基化修饰是唾液酸化转移酶的底物,其唾液酸化修饰水平通常伴随着半乳糖基化修饰水平的升高而上调。免疫系统的变化会导致人类抗原特异性IgG半乳糖基化修饰水平的瞬时增加,而对IgG的总半乳糖基化修饰水平没有显著影响,表明无半乳糖基化修饰的IgG更具致病性,即IgG半乳糖基化修饰具有抗炎活性[96]。根据IgG Fc糖链末端半乳糖基化残基的数量,可以将IgG糖型分为无半乳糖基化修饰(G0)、二天线糖链中的一分支发生半乳糖基化修饰(G1)以及二天线糖链的两分支均发生半乳糖基化修饰(G2)3种类型。近年来的研究主要集中于IgG Fc半乳糖糖基化修饰与肿瘤之间的关系。在多发性骨髓瘤[116-117]、胃癌[81,108,118-120]、胰腺癌[103,121]、结直肠癌[70,122-124]、肺癌[102,125]、前列腺癌[115,126-127]、卵巢癌[128-129]、乳腺癌[130-131]患者的血清中发现IgG G0水平较健康对照组高,而IgG G2水平显著降低。
4.2.4平分型N-乙酰葡糖胺修饰 末端N-乙酰葡糖胺可以通过MBL途径激活补体,N-乙酰葡糖胺的增加会阻碍C1q与抗体的结合[132],表现为抗炎作用。在所有IgG Fc糖链中,只有约10%含有平分型GlcNAc[133]。平分型GlcNAc的升高可以通过提高IgG与FcγRIII的亲和力来强化ADCC作用[95]。但也有研究表明,平分型GlcNAc对结合FcγR或C1q没有显著影响[134]。在胃癌患者中,平分型GlcNAc水平降低[135],这可能归因于胃癌患者体内平分型聚糖残基N-乙酰葡糖胺转移酶3(MGAT3)的酶活性下降,平分型GlcNAc修饰的IgG水平降低,导致IgG与FcγRIIIA的亲和性随之下降,使ADCC作用减弱,肿瘤侵袭性增强。
4.2.5高甘露糖基化修饰 目前,对高甘露糖基化修饰的研究主要集中在治疗性重组IgG,重组抗体中高甘露聚糖修饰水平可从1%提高至20%,而内源性人体IgG中只含有微量水平(<0.1%)的高甘露糖基化修饰[136]。采用高分辨质谱测定糖链谱随时间的变化,发现高甘露糖基化修饰的相对水平随着时间的增加而下降,其他糖链则几乎保持不变,说明含有Fc高甘露糖糖链的治疗性IgG在人体内比其他糖链形式清除得更快[137-138]。治疗性单克隆抗体的N-糖基化修饰是药物安全性和有效性的一个重要产品质量属性,在生物仿制药的开发过程中需要增加高甘露糖基化修饰的百分比以提高药物的疗效[139]。
4.3 IgG Fab糖基化修饰与病理状态的关系
IgG Fab糖链在病理状态下也会发生显著改变。研究发现,IgG可能通过Fab片段上的糖链与抗原结合的IgG分子和巨噬细胞结合,影响抗原-抗体结合和巨噬细胞极化,有助于肿瘤细胞逃避免疫监视[140]。在类风湿性关节炎患者中,IgG Fab的核心岩藻糖基化修饰和平分型N-乙酰葡糖胺修饰水平在患病组略有下降[141],还有研究表明,类风湿性关节炎患者的IgG Fab糖基化修饰总体水平有所上升[142]。在骨髓瘤患者中,Fab段唾液酸化修饰、核心岩藻糖基化修饰和N-乙酰葡糖胺基化修饰的水平升高[143]。在滤泡性淋巴瘤、弥漫性淋巴瘤和伯基特淋巴瘤患者中,Fab互补决定区的糖基化位点显著增多,而非功能区糖基化位点则无明显变化[144-145]。在恶性黑色素细胞瘤患者中发现了抗GRP78的自身抗体Fab段糖基化修饰的改变,其可影响恶性黑色素细胞的生长和转移[146]。
5 总结与展望
IgG的生物学功能与其糖基化修饰状态密切相关,质谱技术在研究IgG糖基化修饰中发挥着重要作用。随着质谱技术的快速发展,研究人员分别在IgG的糖链水平、糖肽水平和完整蛋白水平开发了各种质谱分析方法,且揭示了IgG糖基化修饰状态与某些疾病之间的关系。然而,对IgG糖基化修饰状态的鉴定仍面临一些挑战。首先,在糖链分析中,一般先将其从肽段上释放,再通过酰胺化衍生或烷基酯化稳定糖链结构,以提高质谱检测的灵敏度,但衍生化处理使得样本更加复杂化,且在一定程度上破坏了糖链结构。其次,在糖肽分析中普遍存在肽信号对糖肽信号的抑制作用,如何高效地将肽和糖肽分离是亟待解决的问题。最后,在完整蛋白糖基化修饰分析中对质谱仪性能及人员的要求较高,较难大范围地推广。

