脑卒中血浆脂肪酸及其代谢产物的UPLC-MS分析
祁 奥,刘璐璐,张俊杰,张立坚,蔡 春
(1.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524023;2.广东医科大学药学院,广东 湛江 524023)
脑卒中俗称中风,通常是由于脑部血管突然破裂或因血管阻塞导致血液不能正常流入大脑而引起脑组织损伤的一组急性脑血管疾病[1]。脑卒中具有高发病率、高致残率、高复发率和高死亡率的特点,可分为缺血性脑卒中和出血性脑卒中2种亚型。其中,以急性脑缺血(ACI)为代表的缺血性脑卒中占我国脑卒中发病率的69.6%~70.8%。脑出血(ICH)是常见的出血性脑卒中,其占比仅次于急性脑缺血,且目前没有相应的治疗药物,因此该疾病的预后较差[2-3]。
目前对脑卒中的诊断主要依赖于核磁共振成像(MRI)、计算机断层扫描(CT)以及血管成像等影像学方式,影像结果只能提供有无病灶情况,且检测到的是具有相对大面积的异常脑组织,很难区分脑卒中的类型,诊断结果相对滞后[4]。所以,临床上需要特异性强、灵敏度高的生物指标对该疾病进行早期诊断。分子生物标记物可以作为预测脑卒中风险的敏感指标,生物标记物的鉴定可以极大地促进脑卒中病理生理学机制的研究[5]。
脂肪酸尤其是多不饱和脂肪酸,在辅助疾病的诊断和解释疾病的发病机制方面越来越受到重视[6-7]。其中,类二十烷酸又称类花生酸(eicosanoid),是一类由二十碳多不饱和脂肪酸氧化产生的具有生物活性的代谢物,是重要的炎症因子,广泛存在于体液和组织中,调节体内众多生理和病理过程[8-9]。炎症反应在脑卒中的病理生理过程中起着至关重要的作用[10]。脑卒中后,活化的外周免疫细胞产生的炎症介质在受损的大脑区域积聚[11-12],进而加剧了大脑屏障的破坏。有研究表明[13],促炎介质的减少和抗炎介质的增加与更小的梗死面积和更好的脑卒中临床结果有关。目前也有一些关于脑卒中脂肪酸脂质相关的标志物研究,羟基二十碳四烯酸(HETEs)是花生四烯酸的代谢产物,20-HETE在脑卒中患者血液中的浓度显著升高且与其预后较差相关,可以作为脑卒中发生发展的潜在生物标志物之一[8];Hagiwara等[14]研究表明,二十碳五烯酸有改善血管内皮的功能,对脑卒中具有保护作用。
超高效液相色谱-质谱法(UPLC-MS)具有高通量、高分离效率及高灵敏度等优点,在分析复杂的血浆成分及其代谢物的研究中具有独特优势[15-16]。本研究通过课题组前期优化后固相萃取技术萃取血浆中脂质介质[17],采用UPLC-MS法靶向分析健康人、急性脑缺血患者以及脑出血患者的158种脂肪酸代谢物在血浆中的含量,结合多维统计分析和受试者工作曲线,筛选出潜在的脑卒中脂肪酸代谢标志物,为脑卒中的诊断、缺血性和出血性脑卒中的快速区分提供科学依据。
1 实验部分
1.1 样本与试剂
59位健康志愿者、60位急性脑缺血患者和36位脑出血患者的血浆样品:由广东医科大学附属医院神经内科提供,供液相色谱-质谱分析。脑卒中患者的影像学资料示于图1。脑卒中的纳入标准为:1) 年龄在50~80岁;2) 有完整的脑磁共振成像或计算机断层扫描检查;3) 起病在14天以内,入院前没有经过药物的处理。排除标准:1) 严重心、肺、肾、肝功能不全患者;2) 既往有肿瘤病史或现发现肿瘤或可疑占位患者;3) 缺乏临床检验、影像学资料。另外,健康志愿者的血液样本来自广东医科大学附属医院体检中心,纳入标准为:1) 年龄在50~80岁;2) 脑动脉血流动力学正常;3) 脑磁共振成像或计算机断层扫描检查中没有梗塞区域;4) 颈部血管彩色多普勒超声检查未见颈动脉壁病变。样本的具体临床信息列于表1。
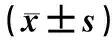
表1 样本临床信息表Table 1 Clinical information of samples
注:a.健康人;b.急性脑缺血;c.脑出血图1 脑组织计算机断层扫描Fig.1 Image of brain tissue by computed tomagraphy
前列腺素E代谢物-d6(tetranor-PGEM-d6)、6-酮-前列腺素F1α-d4(6-keto-PGF1α-d4)、血栓素B2-d4(TXB2-d4)、前列腺素F2α-d4(PGF2α-d4)、前列腺素E2-d4(PGE2-d4)、前列腺素D2-d4(PGD2-d4)、白三烯C4-d5(LTC4-d5)、白三烯B4-d4(LTB4-d4)、15(S)-羟基-5Z,8Z,11Z,13E-二十碳四烯酸-d8(15-HETE-d8)、12(S)-羟基-5Z,8Z,10E,14Z-二十碳四烯酸-d8(12-HETE-d8)、5(S)-羟基-6E,8Z,11Z,14Z-二十碳四烯酸-d8(5-HETE-d8)、血小板活化因子-d4(PAF-d4)、油酸乙醇酰胺-d4(OEA-d4)、二十碳五烯酸-d5(EPA-d5)、二十二碳六烯酸-d5(DHA-d5)、二十碳四烯酸-d8(AA-d8)16种同位素内标物:美国Cayman Chemical公司产品;乙腈、甲酸、甲醇:德国Merck公司产品。
1.2 仪器与装置
岛津8045系列UPLC-MS:日本岛津公司产品;液相分析色谱柱Kinetex C8(2.1 mm×150 mm×2.6 μm):美国Phenomenex公司产品;3K-15台式高速冷冻离心机:德国Sigma公司产品;恒温混匀仪:杭州瑞诚仪器有限公司产品;XW-80A型漩涡混合器:上海精科实验有限公司产品;超纯水系统:美国Millipore公司产品;Strata-X固相萃取柱(10 mg):美国Phenomenex公司产品。
1.3 内标溶液配制
取16种同位素标准品液,分别加入甲醇定容,配制成10 mg/L的同位素脂肪酸标准品储备液,于-20 ℃保存。使用时,用甲醇稀释,制成浓度为100 μg/L的混合标准品工作溶液。
1.4 血浆样品的脂质介质萃取
取100 μL血浆于2 mL EP管中,加入1 mL甲醇和10 μL 100 μg/L内标,在4 ℃下混合10 min,然后以15 000 r/min离心5 min,回收上清液于10 mL EP管中;添加4 mL 0.1%甲酸溶液,混匀,待提取。SPE柱萃取过程如下:先用1 mL甲醇活化SPE固相萃取柱,再用1 mL 0.1%甲酸溶液平衡柱子,然后开始加样进行脂质提取,接着分别使用1 mL 0.1%甲酸和1 mL 15%乙醇溶液淋洗柱子,最后用200 μL甲醇洗脱,收集洗脱液,待进样分析。
1.5 实验条件
1.5.1色谱条件 色谱柱:Kinetex C8(2.1 mm×150 mm×2.6 μm)柱;流动相:A为0.1%甲酸水溶液,B为乙腈;流速:0.4 mL/min;进样量:5 μL;色谱柱柱温:40 ℃;梯度洗脱:0~10 min(10%B),10~20 min(35%B),20~20.1 min(75%B),20.1~25.1 min(95%B),25.1~30 min(10%B)。
1.5.2质谱条件 离子化方式:ESI源正、负离子模式;雾化气流量:3 L/min;干燥气流量:10 L/min;加热气流量:10 L/min;脱溶剂管(DL)温度:250 ℃;加热模块温度:400 ℃;接口温度:300 ℃;碰撞诱导解离(CID)气压力:230 kPa。
1.6 数据分析
1.6.1数据预处理 剔除信噪比(S/N)小于3的数据;16种同位素内标按照校准后的保留时间将所有检测到的组分分为16组,将各组待测化合物的峰面积除以相应组分的内标峰面积进行峰面积标准化校正,再对该数值进行对数转换(log10),以实现正态分布。
1.6.2多维统计分析 标准化的数据集分为建模集和验证集。将建模集的数据导入SIMCA-P14.0软件,选择最优的数据模型进行建模分析,用R2Y和Q2(cum)评估所建立模型的质量,R2Y表示模型的适用性,一般越接近1越好,Q2(cum)表示模型的预测能力,一般大于0.5表示模型的预测能力良好[18-19]。建模成功后,再挑选VIP值大于1且P<0.05的组分,作为能区分2组的候选差异物质。然后检验上述建模组里筛选出来的差异物质在验证集的变化情况,用Benjamini-Hochberg方法对P值进行矫正,筛选出校正后P<0.05的组分作为后续分析的潜在生物标志物。
1.6.3ROC评估候选标志物的诊断能力 为评估筛选得到的候选标志物,本研究使用受试者工作曲线(ROC)对候选标志物进行分析。ROC曲线可用于比较物质对疾病的诊断能力。ROC图中,曲线下的面积(AUC)值范围是0.5~1。在AUC>0.5的情况下,AUC越接近于1,诊断效果越好。
2 结果与讨论
2.1 UPLC-MS分析
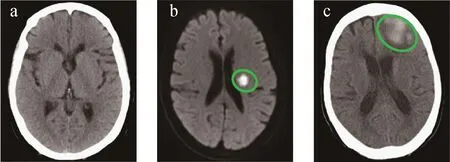
使用岛津8045 UPLC-MS的极性切换功能达到电喷雾正负离子模式的同时检测。158种脂肪酸及其代谢产物中包括87种花生四烯酸(AA)及其代谢物、18种二十碳五烯酸(EPA)及其代谢物、16种二十碳六烯酸(DHA)及其代谢物、11种乙醇酰胺类化合物、23种其他脂肪酸代谢物、血小板活化因子(PAF)、溶血血小板活化因子(Lyso-PAF)、壬二酰化的血小板活化因子(Azelaoyl-PAF)以及16种内标化合物。将158种化合物与各内标物洗脱时间接近的化合物分为一组,具体的化合物信息及分类情况列于附表1(请登录《质谱学报》官网http:∥www.jcmss.com.cn下载)。质谱检测采用多反应监测(MRM)模式,一共包含174个MRM离子对,其中,AA、DHA、13-HODE的色谱图示于图2。
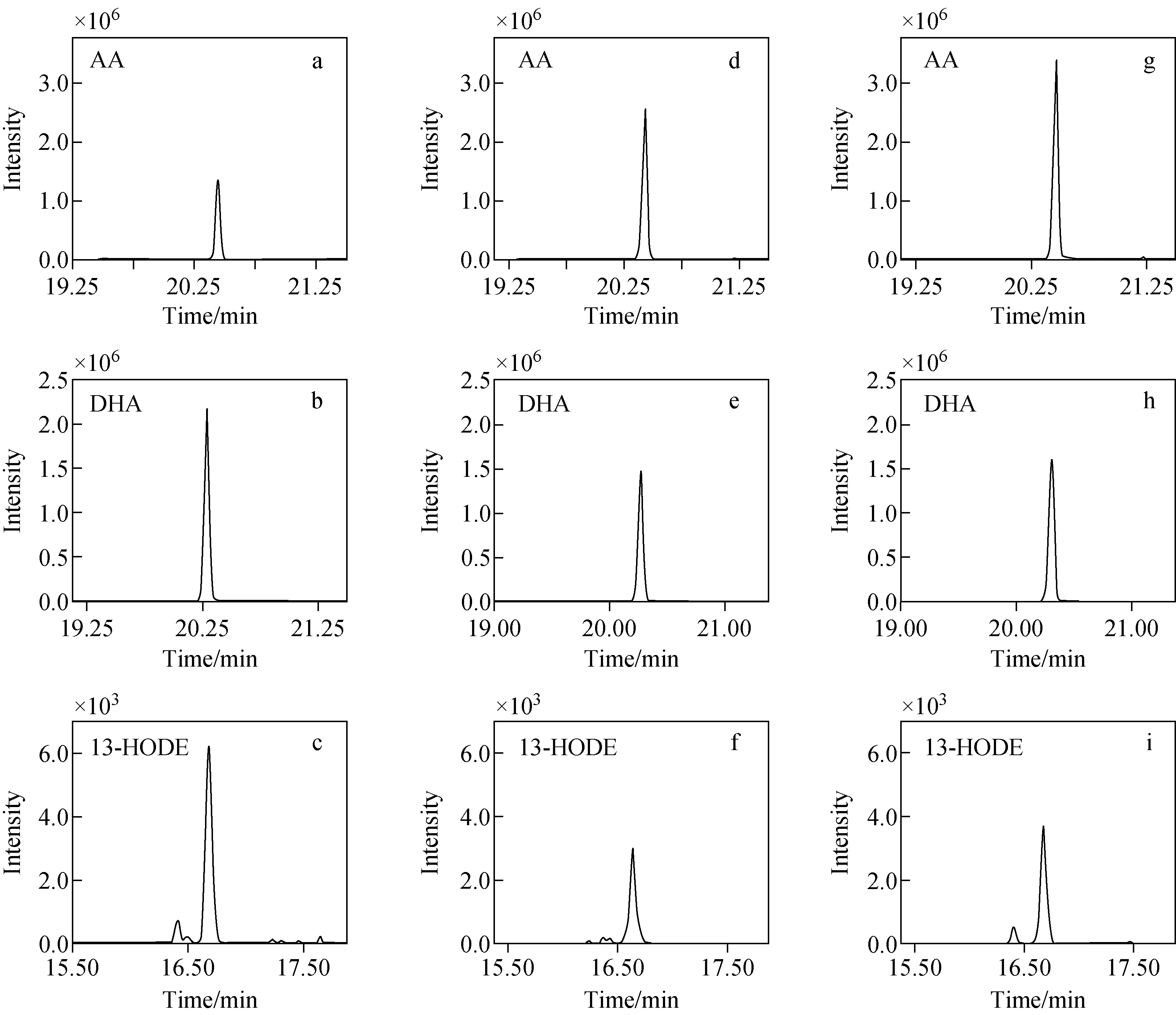
图2 健康人(a,b,c),急性脑缺血患者(d,e,f),脑出血患者(g,h,i)的AA,DHA,13-HODE的色谱图Fig.2 Chromatograms of AA, DHA, 13-HODE of health (a, b, c), ACI (d, e, f), ICH (g, h, i)
2.2 脂肪酸候选标志物的筛选
将经过各组内标化合物校正后的峰面积组成的数据集分为建模集和验证集。建模集一共包含46例样本,即17例健康人、18例急性脑缺血患者、11例脑出血患者;验证集一共包含109例样本,即42例健康人、42例急性脑缺血患者、25例脑出血患者。
在建模集里使用SIMCA-P14.0软件对数据进行建模分析。首先采用主成分分析(PCA)以“无监督”分析形式检查分组趋势和离群值。PCA在分析数据时未知每个样本的分组,单纯根据数据的特征进行分析,但由于代谢组学数据的复杂性,特别是对于组间差异不够明显的样品,单纯的“无监督”分析并不能很好地区分样本的组间差异。我们在PCA得分图中虽然未观察到健康人组与脑卒中组、ACI与ICH之间有明确的分离趋势,示于图3a、3b,但是也没有极端异常的样本需要排除。
为了提高模型的解析能力和有效性,滤除与分类信息无关的噪音,本研究进一步采用正交偏最小二乘判别分析(OPLS-DA),组与组之间呈现出了清晰的分离趋势,示于图3c、3d。然后使用VIP值筛选出能引起组内分离和聚类的代谢物。VIP值为变量对模型的重要性,描述了每个变量对模型的总体贡献,通常设定筛选标准为VIP>1,独立样本t检验具有统计学差异,满足该条件的表示这个变量对模型的分离效果贡献值很大。在健康人组和脑卒中组中,筛选到了5种可用于诊断脑卒中的潜在生物标志物;在ACI组和ICH组中,筛选到了9种可用于区分这2种中风亚型的潜在标志物,示于图4。
2.3 潜在生物标志物的聚类分析
筛选到的差异性脂质分子在组内个体中的全局表达量变化可以由热图直观地呈现出来,颜色的深浅表示化合物在个体中的表达量高低,颜色越红,表达量越高,示于图5。理论上,如果样本来自于同一组,其特征应该是相似的,在进行聚类的时候就很容易聚在一起。在健康人组和脑卒中组中,花生四烯酸在脑卒中组中的表达显著上调,9,10-二羟基-12-十八碳烯酸(9,10-DiHOME)、13(S)-过氧羟基-(9S,11E)-十八碳二烯酸(13-HpODE)、16-羟基二十二碳六烯酸(16-HDoHE)、二十二碳六烯酸在脑卒中组中的表达显著下调。在ACI和ICH中,20-羟基-白三烯B4(20-hydroxy-LTB4)、8-异-15酮-前列腺素2α(8-iso-15-keto-PGF2α)、17,18-二羟基-二十碳五烯酸(17,18-DiHETE)、5,6-二羟基--二十碳三烯酸(5,6-DHET)、13-羟基-9,11-十八碳二烯酸(13-HODE)、17,18-环氧二十碳四烯酸(17,18-EpETE)、16-羟基二十二碳六烯酸(16-HDoHE)、15-羟基二十碳-5Z,8Z,11Z,13E-四烯酸(15-HpETE)、二十二碳六烯酸等9种物质在ICH中均是上调的。
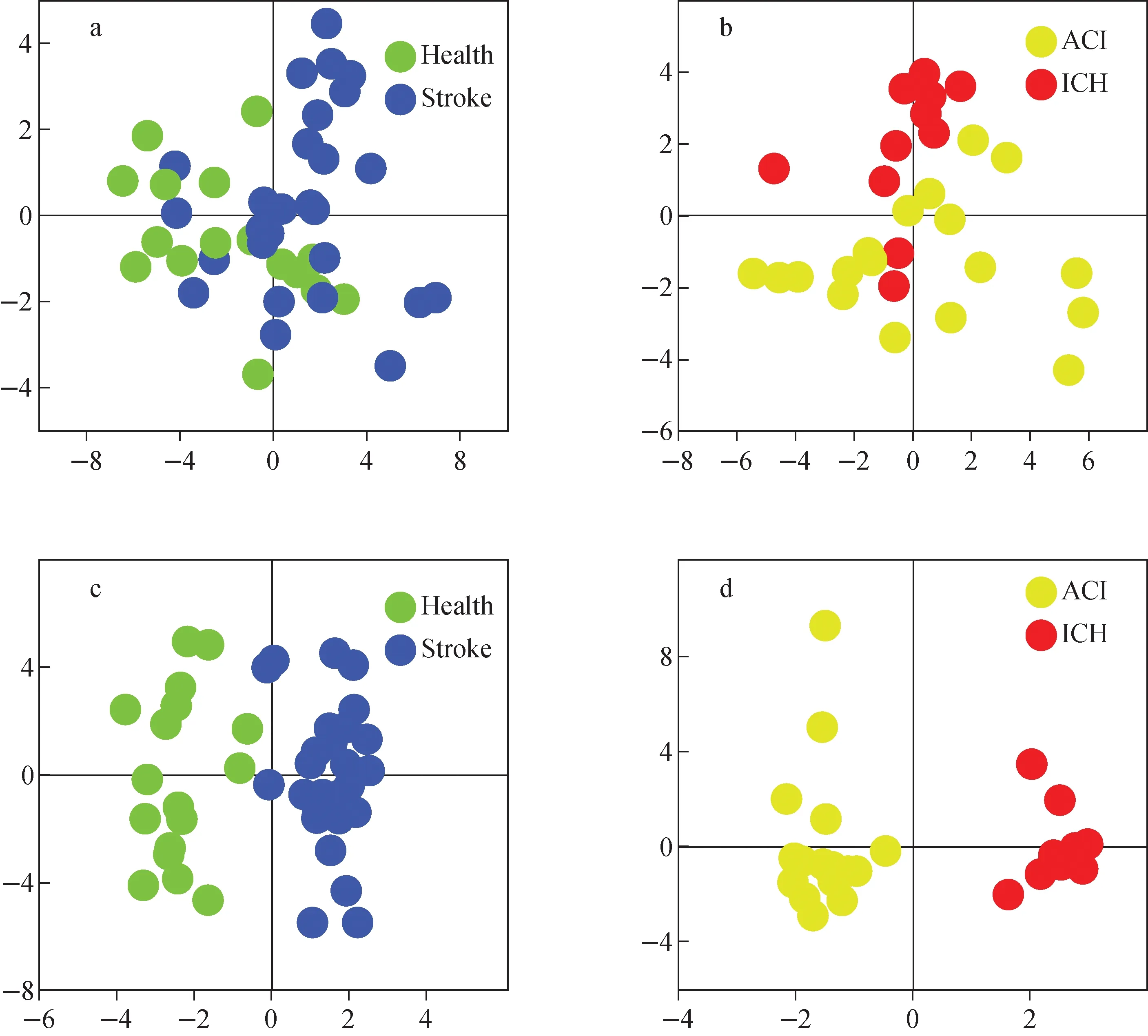
注:a.健康人组vs脑卒中组;b.急性脑缺血组vs脑出血组;c.健康人组vs脑卒中组(R2Y=0.913,Q2(cum)=0.797);d.急性脑缺血组vs脑出血组(R2Y=0.959,Q2(cum)=0.791)图3 PCA得分图(a,b)和OPLS-DA得分图(c,d)Fig.3 PCA score plots (a,b) and OPLS-DA score plots (c,d)
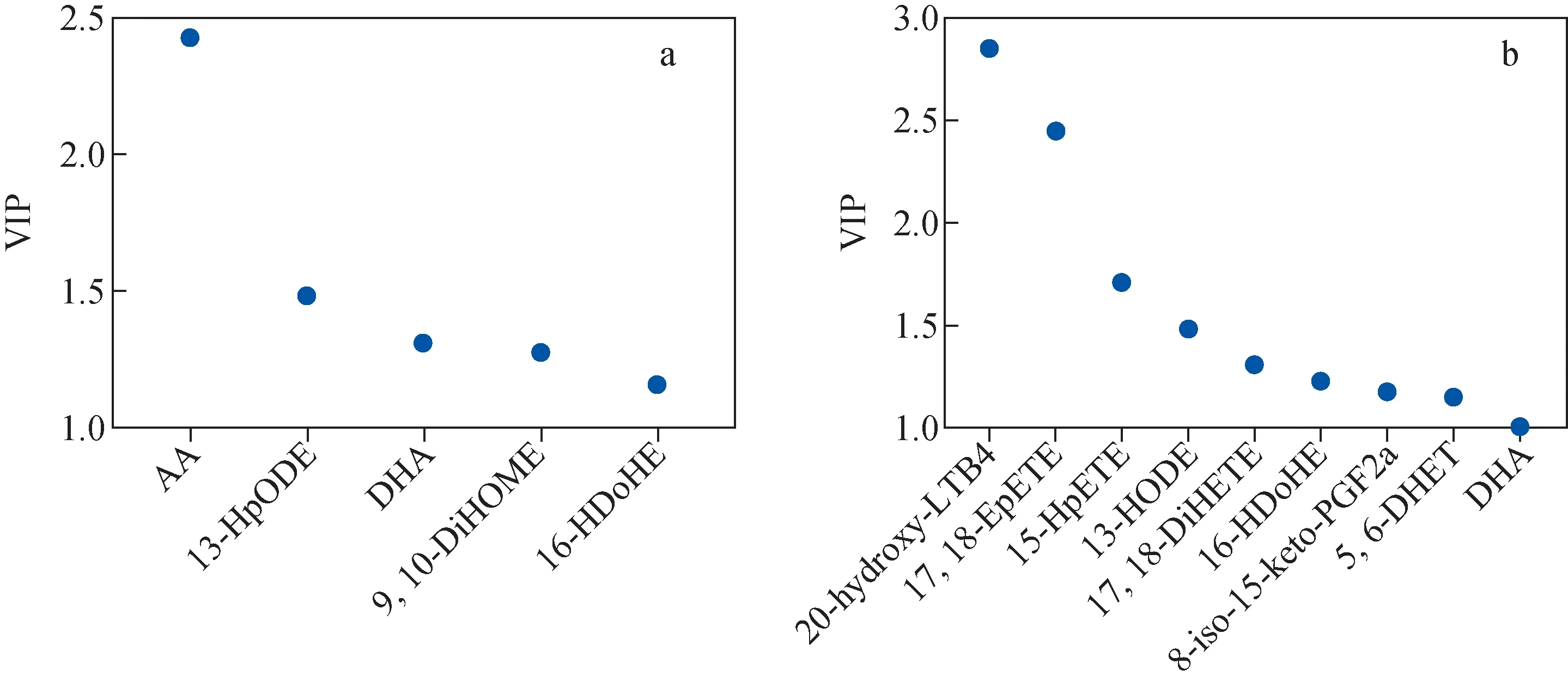
注:a.健康人组vs脑卒中组;b.急性脑缺血组vs脑出血组图4 潜在生物标志物的VIP得分图Fig.4 VIP score plots of potential biomarkers

注:a.健康人组vs脑卒中组;b.急性脑缺血组vs和脑出血组;*:P<0.05;**:P<0.01图5 显著差异性脂质分子聚类热图Fig.5 Cluster heat map of lipid molecules with significant differences
2.4 生物标志物的验证及ROC分析
为了进一步确认在建模集中筛选到的潜在生物标志物的准确性,本研究在验证集中对上述显著差异性脂质分子进行了独立样本t检验,结果表明,差异具有统计学意义,且变化趋势与建模集一致,示于图6。同时,构建了ROC曲线评估这些候选标志物的诊断能力。在能区分健康人组和脑卒中组的5种显著差异性脂质分子中,有2个脂质分子的AUC大于0.8,即AA(AUC:0.997)、13-HpODE(AUC:0.832),表明其具有良好的诊断价值,示于图7。在能特异性区分ACI和ICH的9种物质中,有3个脂质分子的AUC大于0.8,分别是20-hydroxy-LTB4(AUC:0.980)、13-HODE(AUC:0.890)、17,18-EpETE(AUC:0.880),示于图8。
应用单指标分析脂肪酸及其代谢产物对脑卒中组和健康组的区分度后,本实验采用ROC曲线和Logistic回归评价了多种指标在脑卒中的诊断价值。

注:a.健康人组vs脑卒中组;b.急性脑缺血组vs和脑出血组;*:P<0.05;**:P<0.01图6 建模集中筛选的显著差异性脂质分子在验证集的表达情况Fig.6 Expression of significantly different lipid molecules screened of the modeling set in the verification set
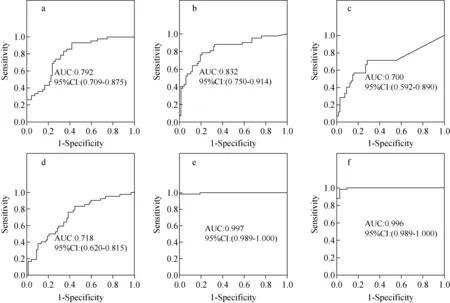
注:a.9,10-DiHOME;b.13-HpODE;c.16-HDoHE;d.DHA;e.AA;f.AA+13-HpODE图7 健康人组和脑卒中组的候选生物标志物的受试者工作曲线Fig.7 Receiver operating characteristic curves of candidate biomarkers between health and the stroke
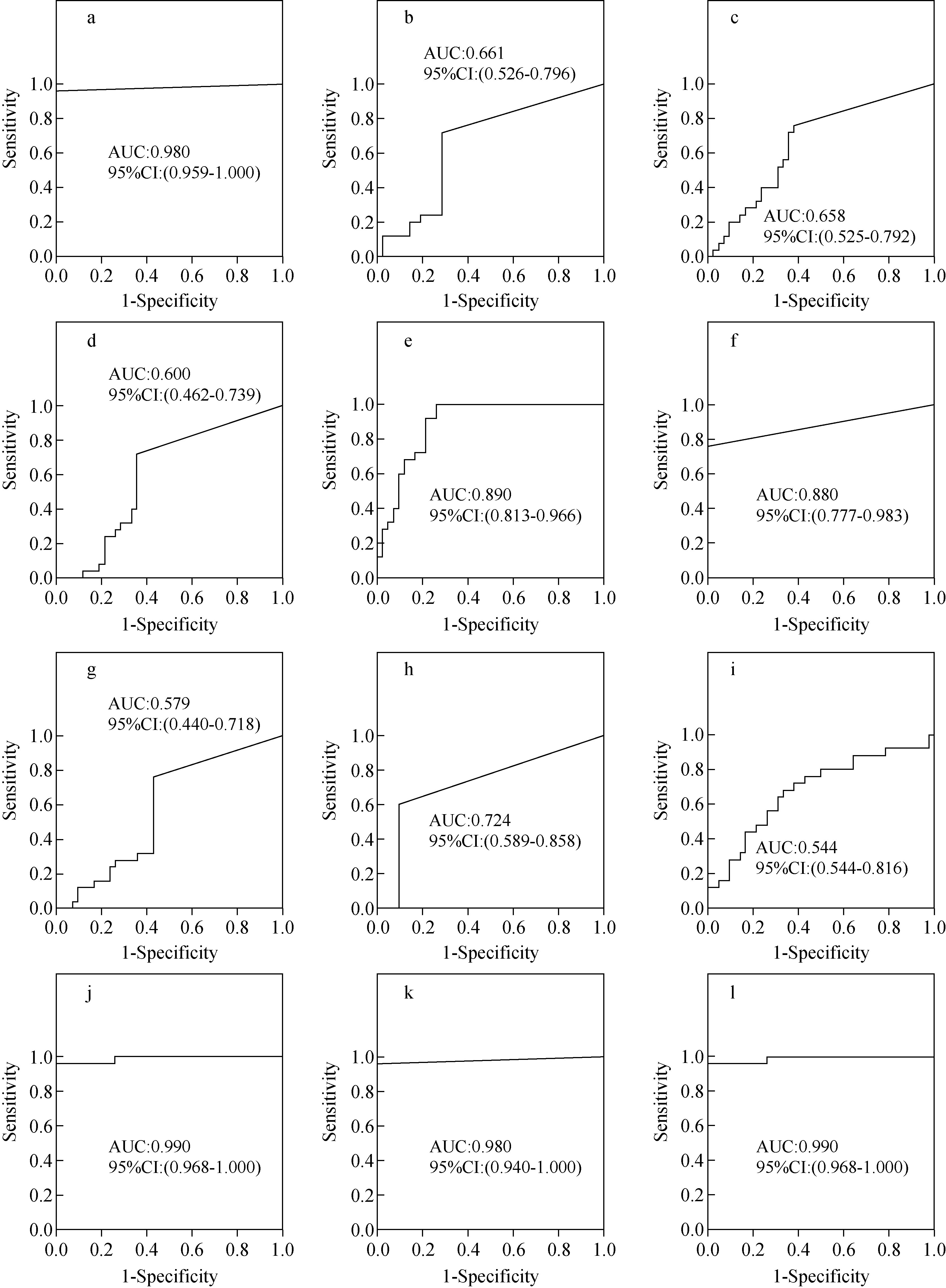
注:a.20-hydroxy-LTB4;b.8-iso-15-keto-PGF2α;c.17,18-DiHETE;d.5,6-DHET;e.13-HODE;f.17,18-EpETE;g.16-HDoHE;h.15-HpETE;i.DHA;j.20-hydroxy-LTB4+13-HODE;k.20-hydroxy-LTB4+17,18-EpETE;l.20-hydroxy-LTB4+13-HODE+17,18-EpETE图8 急性脑缺血和脑出血的候选生物标志物的受试者工作曲线Fig.8 Receiver operating characteristic curves of candidate biomarkers between ACI and ICH
在健康组和脑卒中组中,将AUC较高的AA和13-HpODE组成一个诊断组合,经Logistic回归分析后,得到该组合对疾病的诊断概率值,然后以此概率值计算该诊断组合的AUC。联合AA和13-HpODE对脑卒中的诊断评价,其AUC是0.996,该结果与单独使用AA诊断脑卒中的能力基本一致。同理,在区分ACI和ICH时,选择了AUC较高的几种脂肪酸形成3个诊断组合:20-hydroxy-LTB4和13-HODE、20-hydroxy-LTB4和17,18-EpETE、20-hydroxy-LTB4和13-HODE以及17,18-EpETE。结果表明,20-hydroxy-LTB4联合17,18-EpETE的诊断性能与单独使用20-hydroxy-LTB4的相同,20-hydroxy-LTB4、13-HODE和17,18-EpETE等3个组分的联合与20-hydroxy-LTB4和13-HODE 2个组分的联合诊断价值一致,但略高于单独使用20-hydroxy-LTB4,示于图8。结果表明,联合使用20-hydroxy-LTB4和13-HODE是特异性区分急性脑缺血和脑出血的最佳组合(AUC:0.990)。
2.5 讨论
与炎症和氧化应激相关的脂质代谢的改变是心脑血管疾病中硬化斑块形成及其相关病理变化的主要驱动因素之一[20]。研究结果表明,脂肪酸结合代谢组学的方法能够区分脑卒中患者与健康人之间的差异,此外,通过比较急性脑缺血患者和脑出血患者血浆的脂肪酸代谢物质,筛选并评估出3个能够区分这2种脑卒中亚型的潜在生物标志物。
上述筛选到的一些差异脂肪酸及其代谢产物主要富集在AA、LA(亚油酸)、EPA以及DHA的代谢途径中,示于图9。其中,AA、LA属于ω-6系列的多不饱和脂肪酸,DHA、EPA属于ω-3系列。这些多不饱和脂肪酸是神经、内分泌以及免疫系统的神经递质,能够改变细胞膜的流动性,影响神经递质的合成及释放,而且ω-3和ω-6系列的多不饱和脂肪酸在多种疾病中发挥着重要的药理作用[21-22]。
本研究观察到脑卒中患者血浆中AA的表达水平显著升高,DHA的表达水平显著下降。AA和DHA是神经细胞膜磷脂中常见的多不饱和脂肪酸。AA代谢物的主要作用是促进急性炎症反应,与急性中风、全脑缺血、蛛网膜下腔出血和抗凝相关的出血转化密切相关,也有研究报道[23-24],食用过多的AA会增加梗死的风险。DHA是神经系统细胞生长及维持的一种主要成分,其在大脑中的积累与神经炎症的减少和抗凋亡途径的激活有关[25]。DHA可通过脂氧合酶途径代谢转变为有生物活性的脂质分子,如保护素、消退素等,这类物质的生理功能有强大的免疫特性,有助于消炎和清除炎症相关组织损伤[26-27]。本研究还观察到脑卒中血浆中DHA的代谢产物16-HDoHE相较于健康人显著下降,这可能与脑卒中后的不良预后有关。Edin等[28]报道,9,10-DiHOME能增加脑缺血后的冠状动脉阻力,显著降低脑缺血后的功能恢复,13-HpODE会减少细胞的氧化磷酸化,且可能有促进细胞色素P450的抗氧化反应和解毒作用的能力[29],这两者都是亚油酸的氧化产物。本研究中,9,10-DiHOME在脑卒中血浆中的表达量是下降的,这可能与机体的负反馈调节机制有关;13-HpODE在脑卒中的表达降低可能与疾病的不良预后有关。
在评估能区分急性脑梗死和脑出血的候选生物标志物时,本研究结果表明,20-hydroxy-LTB4的AUC高达0.980,是最具潜力区分脑卒中分型的物质。LTB4是白三烯类化合物,羟基化改变了LTB4的物理特性,降低了非特异性的细胞结合,因此20-OH-LTB4作为细胞外效应物具有更大的潜力,并且可以比LTB4更准确地视为激素。20-OH-LTB4是BLT受体的弱激动剂,具有对嗜中性粒细胞和LTB4的共同结合特性,脑出血中高水平的20-OH-LTB4可能与BLT受体的激活有关,BLT受体可以增强血管通透性并促进中性粒细胞浸润和炎性细胞粘附[30]。此外,13-HODE(AUC:0.890)、17,18-EpETE(AUC:0.880)也具有良好的特异性区分这2种脑卒中分型的能力。13-HODE是亚油酸的氧化产物,研究表明,内源性的HODEs具有一定的病理生理学作用,对动脉粥样硬化和乳腺癌等疾病的发生发展具有促进作用[31-32]。本研究结果显示,脑出血中高水平的13-HODE可能表明该物质对脑卒中的发生发展有一定的促进作用。17,18-EpETE是EPA的代谢产物,其具有有效的抗过敏和抗炎特性,且有一定的限制线粒体损伤的细胞保护作用[33-34]。脑出血后,各种炎症因子会在大脑受损区域聚集,过度的炎症反应可能会诱导机体的抗炎机能增加,以利于清除炎症因子,使受损的脑组织得以修复。在本研究结果中,17,18-EpETE在脑出血中的表达量增高可能与机体的抗炎机能增加有关。
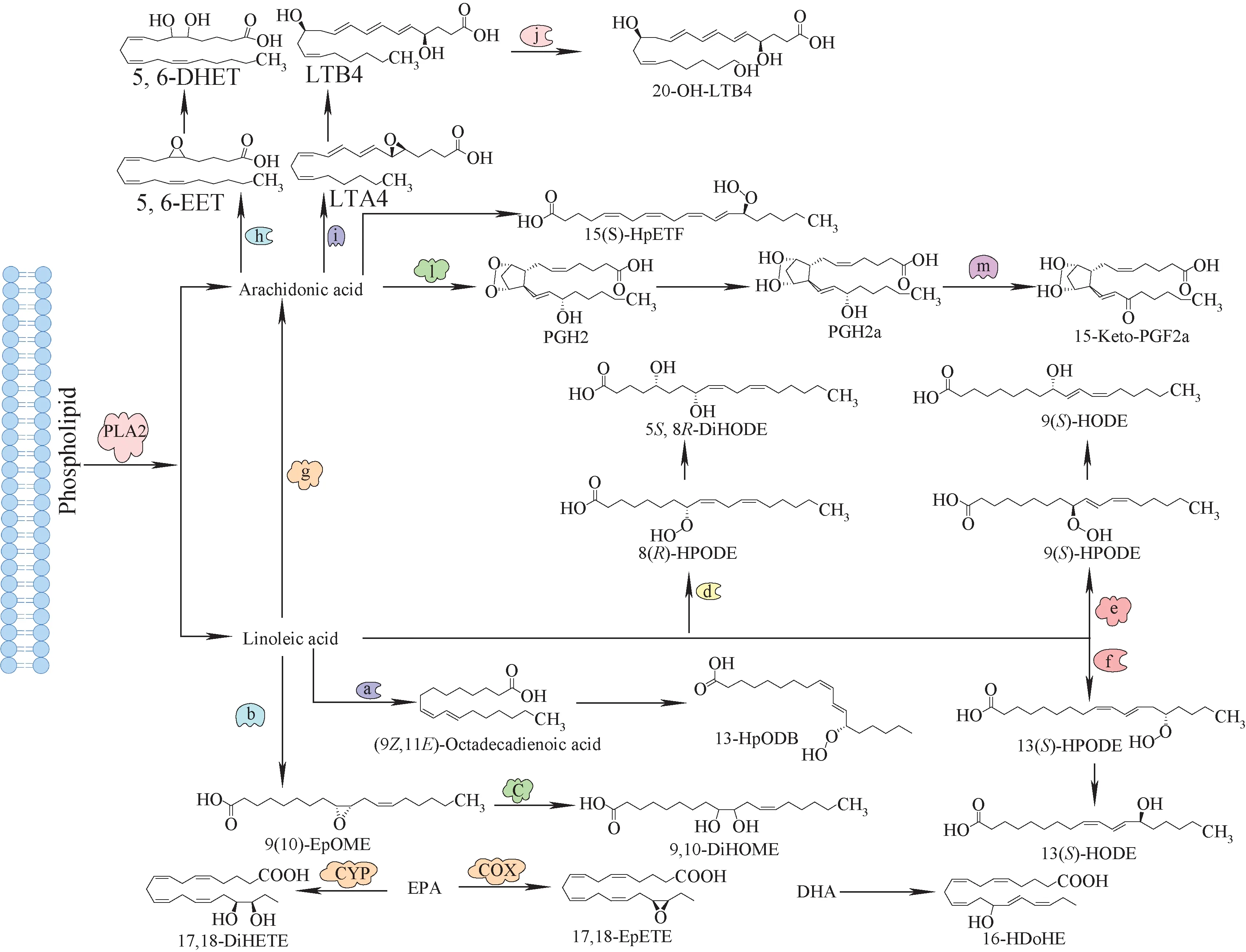
注:PLA2:磷脂酶2;COX:环氧合酶;CYP:细胞色素P450酶;a.亚油酸异构酶;b.CYP1A2;c.水解酶;d.亚油酸8R-脂氧合酶;e.LOX1-5;f.LOX2S;g.酰基-CoA去饱和酶;h.CYP2B6;i.ALOX5;j.CYP4F2;k.ALOX15;l.COX1;m.NADP+图9 花生四烯酸、亚油酸、二十碳五烯酸、二十二碳六烯酸的相关代谢通路Fig.9 Metabolic pathways related to arachidonic acid, linoleic acid, eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA)
3 结论
本研究通过靶向脂肪酸代谢组学结合UPLC-MS分析技术,诊断和区分脑卒中不同亚型。结果表明,AA和13-HpODE是诊断脑卒中的敏感指标;20-hydroxy-LTB4、13-HODE、17,18-EpETE能特异性区分急性脑缺血和脑出血这2种脑卒中亚型。该结果为脂肪酸类生物标志物在脑卒中的诊断及其分型区分,以及发病机理的研究提供了科学依据。

