中药基于ABCA1介导巨噬细胞胆固醇流出防治动脉粥样硬化的研究进展
张 悦,曾文赟,张晓璐,王双翠,张文澜,姜希娟,王一婧
(天津中医药大学,天津 301617)
动脉粥样硬化(atherosclerosis,AS)是以胆固醇为主的脂质在动脉内膜沉积,引起内膜灶性纤维性增厚,泡沫细胞崩解、坏死,形成粥样物为特征的慢性炎症性疾病。AS早期的主要特征是泡沫细胞在动脉内膜集聚,而泡沫细胞是主要源于脂质超负荷的单核-巨噬细胞。以胆固醇为主的脂质在动脉内膜上沉积过多是导致动脉粥样硬化的基本原因和机制,减少和清除多余脂质的唯一途径依赖于胆固醇逆向转运(RCT),而三磷酸腺苷结合盒转运子(ABCA1)介导的胆固醇流出被认为是RCT最主要的环节。因此,促进巨噬细胞内脂质RCT对抑制泡沫细胞形成及防治AS具有明确作用,而巨噬细胞内的胆固醇流出是RCT的重要环节。胆固醇流出过程受多因子调控,包括与游离的贫脂载脂蛋白前β-HDL或apoA-I结合的ABCA1、与HDL结合的B族1型清道夫受体(SR-B1)及三磷酸腺苷结合盒转运子G1(ABCG1)等[1](见图1)。临床一般选择抑制胆固醇合成的他汀类药物防治AS,或采用放置支架或旁路移植手术治疗严重的狭窄或闭塞血管再通。但药物治疗和手术治疗都对人体产生一定损害作用,如他汀类药物对人体肝脏、胃肠、肌肉及皮肤都存在不可忽视的损害作用[2-3],而手术治疗风险大,费用也较为昂贵。近年来,传统中草药防治AS由于不良反应小、疗效显著以及作用多层次、多靶点等优点受到越来越多的关注。本文从受体ABCA1介导巨噬细胞内胆固醇流出入手,概括了近几年来中药在防治动脉粥样硬化方面所取得的进展,为相关基础及临床研究提供理论和文献依据。
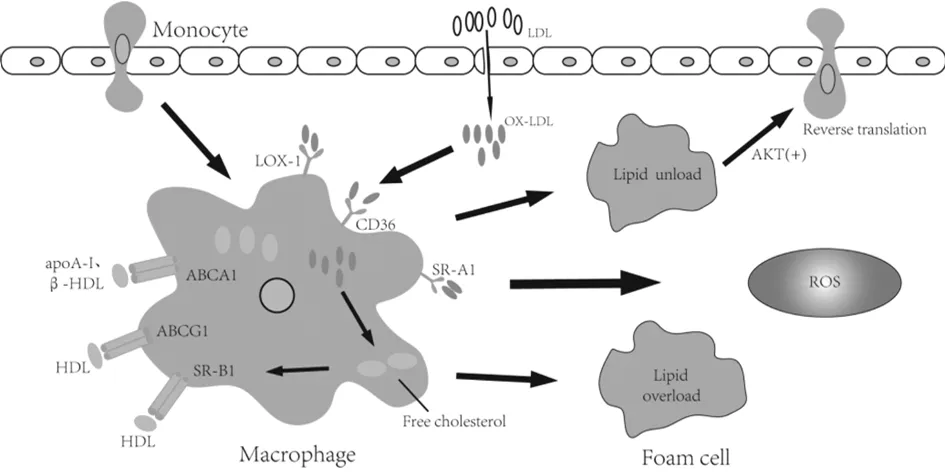
注:动脉内皮损伤后,LDL进入内膜被氧化为ox-LDL,随后被巨噬细胞通过表面受体CD36、SR-A1等吞噬,造成ox-LDL携带的胆固醇在巨噬细胞内蓄积。若游离胆固醇及时通过表面受体ABCA1、ABCG1等介导流出,同时通过AKT途径反向翻译来减少泡沫细胞形成,可以延缓AS发展;若胆固醇大量蓄积,胆固醇流出障碍,则脂质超负荷的巨噬细胞转变为泡沫细胞,并释放ROS,加速AS进展。
1 ABCA1介导巨噬细胞胆固醇流出
ABC超家族是一类ATP驱动泵,其主要作用于介导胆固醇流出,在脂肪细胞、巨噬细胞、成纤维细胞和其他外周组织细胞中表达[4]。常见参与胆固醇流出的ABC家族成员主要包括ABCA1、ABCG1、ABCG5等[5],而其中ABCA1和ABCG1被认为是该过程最关键的成员,两者相配合共同完成巨噬细胞胆固醇的RCT过程[6]。RCT在脂质代谢中作用巨大,RCT途径异常会导致胆固醇外流减少,脂质在动脉内膜的沉积加快,促进AS发生发展[4]。AB-CA1是一种促进细胞内胆固醇流出的膜整合蛋白,作用于RCT的起始环节,被称作“RCT守门人”,且大量研究证实其在整个逆转运过程中起限速作用[7]。研究发现,ABCA1基因缺失突变引起Tangier病,Tangier病是一种罕见的遗传代谢障碍疾病,以出现大量胆固醇蓄积、低apoA-I表达及高密度脂蛋白严重缺乏等现象为特点[8]。
2 多通路调控ABCA1的表达
2.1PPARs通路 过氧化物酶体增殖剂激活受体(peroxisome proliferators-activated receptors,PPARs)是一种核受体,有PPARα、PPARβ/δ与PPARγ3种亚型。近期研究表明,PPARs可通过肝X受体α(主要是LXRα)影响ABCA1的表达以调控细胞胆固醇流出[9]。Ren等[10]以RAW264.7巨噬细胞衍生的泡沫细胞为模型,分别转染PPARγ siRNA和LXRα siRNA后发现 PPARγ/LXRα通路是ABCA1的上游信号,该通路能够调控胆固醇的流出。He等[11]也发现激活 PPARγ 后巨噬细胞内 LXRα、ABCA1和ABCG1 的表达均上调,胆固醇流出量显著增加,而选择性沉默 PPARγ 基因则出现相反的结果[12]。另有研究表明PPARα也可通过激活LXRα上调ABCA1活性,介导氧化型脂质从泡沫细胞转运至外周的 HDL参与RCT过程[13]。
2.2NF-κB通路 NF-κB是从B淋巴细胞细胞核中提取到的转录因子,可以有效地调节炎性因子的基因表达,抑制AS事件的发生[14]。陈筠等[15]用THP-1巨噬细胞源性泡沫细胞为模型发现,NF-κB活化后促进miR-33s及其宿主SREBPs的表达, 进而调控ABCA1表达以影响胆固醇的流出。还有研究发现,巨噬细胞激活脂肽-2(MALP-2)通过激活THP-1巨噬细胞中的TLR2/NF-кB/ZNF202通路下调ABCA1的表达[16]。TNF-α亦可通过活化巨噬细胞内NF-κB信号以抑制ABCA1的活性,大量脂质在细胞蓄积,促进泡沫细胞形成[17-18]。
2.3腺苷酸活化蛋白激酶(AMPK)通路 AMPK是一种丝氨酸/苏氨酸激酶,由 α、β 和 γ 3个亚基组成,其中 AMPK-α被认为是 AMPK 发挥生物学作用的关键。AMPK在巨噬细胞胞浆中高度表达,为细胞能量代谢状态的传感器,相关研究指出 AMPK的激活参与胆固醇流出过程。有研究指出AMPK可通过上调巨噬细胞表面ABCA1、ABCG1的表达,促进胆固醇流出[19]。Kemmerer等[20]进一步研究发现AMPK上调巨噬细胞 ABCA1表达的作用依赖于LXRα的激活,而在给予AMPK siRNA干预后LXRα、ABCA1的表达均降低,胆固醇外流明显受限。还有研究发现,AMPK激动剂AICAR可通过上调巨噬细胞LXRα、ABCG1的表达,促进胆固醇外流,减小 apoE-/-小鼠的AS病变程度;相反,使用AMPK抑制Compound C将阻断此过程的发生[21],加速AS进程。
2.4PCSK9通路 前蛋白转化酶枯草溶菌素9(proprotein convertase subtilise kexin 9,PCSK9)是一种前蛋白转化酶,表达在肝、肾等多个脏器中。现有研究发现,PCSK9可影响ABCA1介导的RCT途径调控胆固醇流出,在AS的形成和发展过程中发挥重要作用[22]。Li等[23]实验研究发现,槲皮素通过调节AS模型小鼠PCSK9和ABCA1的表达,有效干预AS的发生发展。同样有研究以高脂喂养的apoE-/-小鼠为模型研究发现PCSK9通过下调ABCA1基因和蛋白的表达,直接抑制细胞内的胆固醇流出,进而抑制AS的发生发展,减少心血管疾病的发生概率[24]。
3 中药基于ABCA1介导巨噬细胞胆固醇流出以防治AS
中医理论中未有一个明确的病名与AS相对应,根据临床表现,可将其归于“眩晕”“胸痹”“中风”等范畴[25]。现代医家认为AS病理变化以痰浊、血瘀为主,将AS主要分为痰瘀互结、气滞血瘀、气阴两虚和气虚血瘀[26]四大主要证型,与之相对应,提出化瘀祛痰、理气活血、益气养阴、益气活血的治疗原则。传统中药复方具有多层次、多靶点等特点,而现代中药单体具有靶点精准、起效迅速等特点,在临床和基础研究中广泛应用于防治AS。近年来大量研究证实部分中药复方及单体可通过激活ABCA1活性,促进巨噬细胞胆固醇流出,从而抑制AS进展[25-26]。
3.1中药复方 临床研究证实,由制半夏、建泽泻、海藻、丹参等组成的祛痰化瘀方可降低AS患者的血脂水平,同时可通过激活LXRα信号进而上调ABCA1表达,改善机体脂质代谢[27]。经典的化痰方泽泻汤[28]和二陈汤[29]亦可通过上调高脂动物模型中巨噬细胞ABCA1表达,促进胆固醇流出并减少AS斑块形成。在“大柴胡汤”基础上加丹参及泽泻组成的通脉降浊煎剂以祛痰化瘀为治疗原则,促进ABCA1表达,从而促进胆固醇流出[30]。丹蒌片可用于治疗痰瘀互结型AS,Hao等[31]用丹蒌片乙醇提取物干预apoE-/-小鼠AS模型验证,药物通过激活PPARα/ABCA1信号通路加速胆固醇排出,减小AS模型小鼠斑块面积。近期研究发现,有活血化瘀、健脾渗湿之功的降脂通络方,亦可通过上调胆固醇逆转运蛋白ABCA1和apoA-1的表达,从而用于防治AS[32]。
由人参、三七、法半夏、红花等组成的护心方[33]以益气活血化瘀为原则,亦可通过提高ABCA1蛋白表达从而延缓AS发生发展。宁心痛颗粒由川芎、黄芪等组成,具有益气活血的功效。相关实验结果显示,宁心痛颗粒可诱导细胞中PPARγ、LXRα及ABCA1的表达上调,同时抑制脂蛋白吞噬受体SR-A1、CD36的表达,表明宁心痛颗粒对泡沫细胞胆固醇流出也具有促进作用[34]。黄丹娥等[35]研究发现由绞股蓝、银杏叶等组成的银蓝调脂胶囊主治气滞血瘀型AS,通过作用于LXRα并上调其基因表达,从而促进下游ABCA1基因和蛋白表达,提高巨噬细胞胆固醇流出率。
3.2中药提取物 临床上中医经常使用活血化瘀、清热解毒、益气、理气、养阴等类中药治疗AS所致心脑血管疾病,并取得了较为显著的疗效。现代药理学研究发现这些中药中有部分是通过直接或间接调控ABCA1介导的胆固醇流出从而发挥防治AS的作用。随着现代科技的进步,中药提取的方法越来越多样化,越来越科学,中药提取物由于作用靶点准确,逐渐被人们所接受。现总结近5年来不同类型中药单体调ABCA1介导的胆固醇流出的文献,见表1。
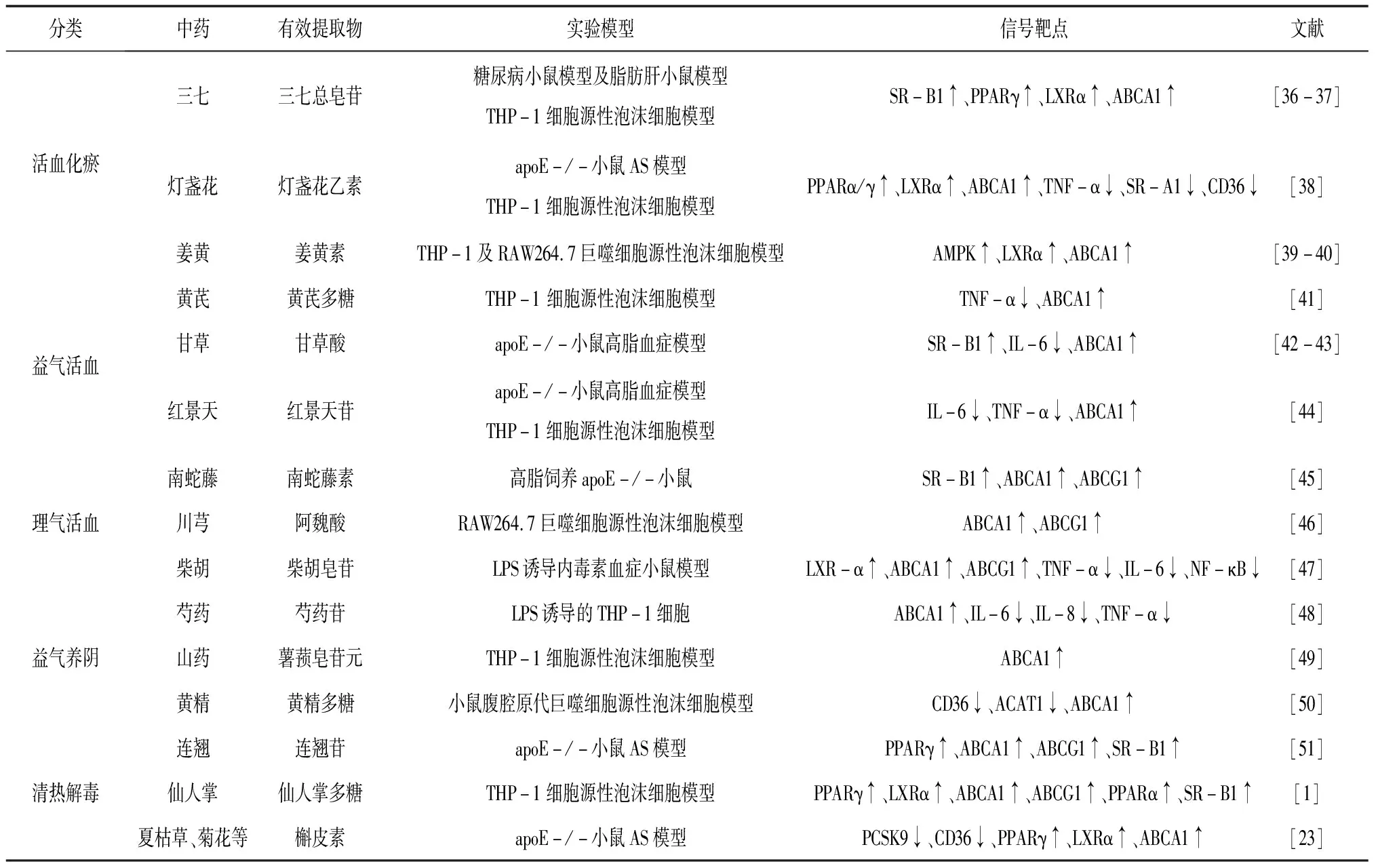
表1 中药提取物调控ABCA1介导的胆固醇流出
4 总结与展望
ABCA1介导巨噬细胞胆固醇流出有望成为临床治疗AS的重要手段。多种中药复方和单味药及其有效成分呈现影响ABCA1表达进而介导胆固醇流出的功效,这给中医临床治疗AS提供了可行的思路和研究方向,但中药作用机制复杂,其机制尚待深入研究以明确靶点,研究和应用的系统化、规范化也亟待重视和解决。
利益冲突:所有作者均声明不存在利益冲突。

