肥胖型PCOS伴胰岛素抵抗患者慢性低度炎症状态及补肾化痰方的干预作用研究
孙 淼,毛 新,杨艳婷,侯丽辉,孟小钰
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江省传染病防治院,黑龙江 哈尔滨 150500;3.黑龙江中医药大学第一临床医学院,黑龙江 哈尔滨 150040)
多囊卵巢综合征(PCOS)的病因复杂,目前仍不清楚。大量研究显示PCOS患者存在外周血炎症因子水平升高,骨骼肌、脂肪组织、胰腺、肝脏甚至脑组织中也存在炎症因子水平升高的表现,提示慢性低度炎症与PCOS的发生发展有关,且炎症状态是2型糖尿病及心血管疾病的主要致病因素[1-4]。C反应蛋白(CRP)、白细胞介素-6(IL-6)、IL-2、IL-8、肿瘤坏死因子-α(TNF-α)等均是炎症反应的重要细胞因子,这些炎症因子可以通过信号转导途径介导胰岛素信号通路,使患者产生胰岛素抵抗[5],从而参与PCOS的病理生理过程。大量动物及临床研究证实抗炎治疗对于PCOS病理状态有改善作用,尤其中药复方及单体对于PCOS慢性低度炎症作用显著[6-8]。侯丽辉教授临床治疗PCOS 30余年,提出补肾化痰方能够通过补肾健脾、化痰祛湿、活血化瘀作用,有效改善PCOS患者胰岛素抵抗状态,降低雄激素、血脂[9-11]。本研究进一步观察了肥胖型PCOS伴胰岛素抵抗患者慢性低度炎症的状态及补肾化痰方的干预作用,旨在为中医药治疗PCOS思路提供更充分的临床证据。
1 资料与方法
1.1纳入标准 符合2003年鹿特丹会议上制定的PCOS标准[12]和2000年亚太地区肥胖诊断标准[13][24 kg/m2≤体质指数(BMI)<30 kg/m2],胰岛素抵抗指数(HOMA-IR)≥2.69;服药过程中无生育要求;患者自愿参与并签署知情同意书。
1.2排除标准 其他原因所致的内分泌或激素异常者;入组前3个月内曾用过激素类药物者;伴心肝肾等其他系统疾病者。
1.3一般资料 研究通过黑龙江中医药大学附属第一医院伦理委员会批准(HZYLLKY202001702),前瞻性选择2020年1—10月就诊于黑龙江中医药大学附属第一医院妇科门诊的肥胖型PCOS伴胰岛素抵抗患者70例,年龄20~40(25.2±4.4)岁,均符合上述标准。根据随机数字表法将患者分为对照组与治疗组各35例,其中对照组试验终末脱落4例。治疗组35例,年龄(25.0±4.3)岁,PCOS病程0.6~10年;对照组31例,年龄(25.3±4.4)岁,PCOS病程0.8~10年。2组年龄、病程比较差异均无统计学意义(P均>0.05)。
1.4治疗方法 对照组:盐酸二甲双胍片(格华止,中美上海施贵宝制药有限公司,生产批号:160112)口服,0.5 g/次,2次/d,共服用3个月。治疗组:盐酸二甲双胍片用法同对照组,同时给予补肾化痰方汤剂治疗,药物组成:苍术15 g、黄芪30 g、丹参10 g、茯苓15 g、仙灵脾20 g,药物来源于黑龙江中医药大学附属第一医院,煎煮成300 mL/剂,分2次口服,共服用3个月。
1.5观察指标 ①人体测量学相关指标:治疗前后分别测量2组患者体重、收缩压、舒张压、腰围、臀围,计算腰臀比。②血液学指标:治疗前后分别于自然月经周期或者药物撤退性出血第3~5天晨起空腹静脉釆血,化学发光法测定糖脂代谢相关指标,包括空腹血糖(FPG)、空腹胰岛素(FINS)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、载脂蛋白A(ApoA)、载脂蛋白B(ApoB),计算HOMA-IR(FPG×FINS/22.5);放免法测定性激素相关指标,包括黄体生成激素(LH)、促卵泡生成素(FSH)、睾酮(T)、雄烯二酮(AND)、硫酸脱氢表雄酮(DHEAS)、性激素结合雄蛋白(SHBG);按照Luminex因子检测系统提供的试剂盒(MILLIPLEXMAP, 美国Luminex公司)操作说明检测炎症相关指标,包括IL-2、IL-6、IL-8、TNF-α,采用Luminex系统检测读取滤板荧光强度,自动计算检测因子的数据。
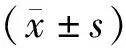
2 结 果
2.12组治疗前后人体测量学相关指标比较 治疗3个月后,2组的舒张压、收缩压、体重、BMI、腰围、臀围及腰臀比均较治疗前有所降低,但差异均无统计学意义(P均>0.05);2组治疗后各指标比较差异均无统计学意义(P均>0.05)。见表1。
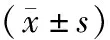
表1 2组肥胖型PCOS伴胰岛素抵抗患者治疗前后人体测量学指标比较
2.22组治疗前后糖脂代谢相关指标比较 治疗3个月后,2组FINS、HOMA-IR、TG水平均较治疗前明显降低(P均<0.05);治疗组治疗后TG水平明显低于对照组(P<0.05),其余指标2组比较差异均无统计学意义(P均>0.05)。见表2。
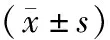
表2 2组肥胖型PCOS伴胰岛素抵抗患者治疗前后糖脂代谢相关指标比较
2.32组治疗前后性激素相关指标水平比较 治疗3个月后,2组SHBG水平均明显高于治疗前(P均<0.05),其余指标均无明显变化(P均>0.05);治疗后,2组各指标比较差异均无统计学意义(P均>0.05)。见表3。
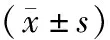
表3 2组肥胖型PCOS伴胰岛素抵抗患者治疗前后性激素指标水平比较
2.42组治疗前后炎症因子相关指标水平比较 治疗3个月后,2组血清IL-2、IL-6、IL-8、TNF-α水平均较治疗前明显降低(P均<0.05),但治疗后2组间各指标比较差异均无统计学意义(P均>0.05)。见表4。
表4 2组肥胖型PCOS伴胰岛素抵抗患者治疗前后炎症因子水平比较
3 讨 论
中医将PCOS一般归属于“月经后期”“不孕症”“崩漏”等疾病范畴,古代及现代医家认为PCOS中医病机以“痰湿”居多,认为痰湿壅滞,脂膜闭塞子宫导致月经不调、不孕等。侯丽辉教授在古人及现代医家的理论基础之上,提出“痰瘀胞宫”的病机理论,认为痰浊壅盛、膏脂满溢,使形体肥胖,气血运行不畅,结成窠囊,卵巢呈多囊样改变。侯教授根据多年临床治疗PCOS经验,创制出“补肾化痰方”这一有效方剂,该方中黄芪为君药,既能补气健脾,又能利尿消肿;苍术既能祛湿又能健脾;仙灵脾补肾壮阳,祛风除湿;丹参活血调经,祛瘀止痛;茯苓淡渗利水,健脾除湿。全方共奏补肾健脾、化痰祛瘀之功。
痰湿型PCOS以肥胖、胰岛素抵抗为主要特征,而肥胖、胰岛素抵抗与慢性低度炎症密切相关,所以PCOS又被称为低度慢性炎症性疾病[14]。大量研究发现TNF-α参与了PCOS、胰岛素抵抗、肥胖、高雄激素血症甚至排卵障碍等疾病过程[15-17]。TNF-α在脂肪组织中高表达,可抑制脂蛋白酶的活性使胰岛素信号传导被削弱,从而抑制胰岛素的分泌,最终促进胰岛素抵抗发生。TNF-α与雄激素之间也存在一定的相关性,高雄激素血症型PCOS患者TNF-α水平明显升高[18]。IL-2主要由T细胞产生又称T细胞生长因子,通过自分泌和旁分泌方式发挥效应,通过活化T细胞产生细胞因子,同时刺激NK细胞及B细胞增殖,促进B细胞分泌抗体并激活巨噬细胞。研究发现PCOS患者的卵泡液中IL-2水平呈现高表达[19]。IL-6是一种多功能的糖蛋白细胞因子,参与排卵及排卵后卵巢修复,PCOS患者体内IL-6水平升高[15],可以抑制孕酮、雌二醇和睾酮的表达,同时与肥胖、胰岛素抵抗密切相关[20-21]。IL-8主要由单核-巨噬细胞产生,其通过吸引和激活中性粒细胞使机体局部的炎症反应增强。有研究显示,PCOS患者血清IL-8水平显著高于正常对照组[22-23]。上述研究均提示肥胖型PCOS患者炎症因子分泌异常,进而促发炎症反应,降低胰岛素敏感性,间接促使胰岛素抵抗发生、发展,出现代偿性高胰岛素血症,抑制SHBG分泌。相关研究发现体外补充SHBG可以抑制脂多糖诱导的脂肪细胞和巨噬细胞中的炎症因子(IL-6及TNF-α)释放及JNK、ERK的磷酸化,SHBG的升高对于代谢综合征具有保护作用[24]。
本研究结果显示,肥胖型PCOS伴胰岛素抵抗患者血清IL-2、IL-6、IL-8、TNF-α水平均升高,说明肥胖型PCOS伴胰岛素抵抗患者存在低度炎症反应。治疗3个月后,2组体重、BMI、腰围、臀围及腰臀比均较治疗前降低不明显,这可能与用药周期较短、样本量较小有关;2组FINS、HOMA-IR、TG、IL-2、IL-6、IL-8、TNF-α水平均明显降低,SHBG水平均明显升高,且治疗组治疗后TG水平明显低于对照组。提示补肾化痰方联合二甲双胍治疗降低TG作用更显著,有助于降低肥胖型PCOS伴胰岛素抵抗患者发生远期心血管疾病的风险。但是由于本研究纳入样本较少,观察时间较短,补肾化痰方对于糖脂代谢异常治疗效果有待进一步研究证实。
利益冲突:所有作者均声明不存在利益冲突。

