核苷(酸)类似物序贯联合聚乙二醇干扰素α治疗血清HBsAg低水平的慢性乙型肝炎患者疗效分析*
吴凤萍,鲁 瑞,刘怡欣,王怡恺,田 燕,张 欣,贾晓黎,党双锁
乙型肝炎病毒(hepatitis B virus,HBV)感染所引起的慢性乙型肝炎(chronic hepatitis B,CHB)有进展为肝硬化(liver cirrhosis,LC)甚至肝细胞癌(hepatocellular carcinoma, HCC)的风险[1]。抗病毒治疗可以有效地控制肝病的进展,降低LC和HCC的发生[1]。近年来,多项研究已表明单用核苷(酸)类似物(nucleos(t)ide analogs, NAs)或聚乙二醇干扰素α(peginterferon alpha,Peg-IFN-α)治疗CHB患者,达到HBsAg清除或临床治愈的比例非常低,而两类药物的联合应用则有望提高疗效,有助于进一步追求临床治愈的目标[2, 3]。本研究探讨了应用NAs序贯联合Peg-IFN-α治疗血清HBsAg低水平的CHB患者的疗效和安全性,现将结果报道如下。
1 资料与方法
1.1 一般资料 2015年11月~2018年10月在西安交通大学第二附属医院感染病科就诊的CHB患者106例,男性76例,女性30例;年龄为19~62岁,平均年龄为38.6±11.0岁。诊断符合2015年中华医学会肝病学分会和感染病学分会修订的《慢性乙型肝炎防治指南》的诊断标准[2]。纳入标准:(1) 年龄18~65岁;(2) 经NAs治疗1年以上后达到血清HBsAg≤1500 IU/mL、HBeAg转阴、HBV DNA <20 IU/mL;(3) 血清胆红素和转氨酶均正常;(4) Fibroscan检测显示肝硬度测定(LSM)为9.0 ≤ LSM < 12.0 Kpa。排除标准:(1) 合并严重的心、脑、肺、肾、血液系统疾病;(2) 伴有甲状腺疾病、视网膜病变、银屑病、神经性耳聋、精神病或有精神疾病史;(3) 既往接受过IFN-α或Peg-IFN-α治疗;(4) LC或HCC患者;(5) 有酗酒、吸毒史或未能控制的癫痫、糖尿病、高血压和自身免疫性疾病;(6) 合并其它嗜肝病毒感染和(或)HIV 感染;(7) 妊娠或哺乳期妇女。本研究已通过我院医学伦理委员会批准,所有患者入组前签署了书面知情同意书。
1.2 治疗方法与随访 根据患者治疗意愿分为两组,42例患者在继续NAs治疗的基础上联合应用Peg-IFNα-2a(上海罗氏制药有限公司)180μg皮下注射,1次/w或Peg-IFNα-2b(厦门特宝生物工程股份有限公司)180μg皮下注射,1次/w,治疗48 w;另64例患者继续单用原NAs治疗,观察48 w。随访至96 w(即停用Peg-IFN-α后或继续口服NAs治疗,再随访48 w)。两组基线资料均衡,具有可比性(P>0.05,表1)。
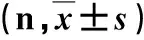
表1 106例患者基线资料比较
1.3 检测和检查 使用罗氏公司生产的全自动AmpliPrepCOBAS TaqMan 48系统检测仪及其配套试剂检测血清HBV DNA;使用美国雅培公司生产的Architect i2000 化学发光免疫分析仪及其配套试剂检测血清HBV标志物(血清HBsAg<0.05 IU/mL被定义为 HBsAg转阴,血清 HBsAb ≥10 mIU/mL被定义为HBsAb阳性);使用上海科华生物工程股份有限公司生产的奥林巴斯AU2700 生化仪检测肝功能;使用Echosens公司的FibroScan 502行LSM测定,单位为千帕(kPa)。

2 结果
2.1 两组血清HBsAg转阴率和血清学转换率比较 在序贯联合组,有41例患者完成了48 w的Peg-IFN-α治疗,最终有40例患者接受随访至96 w;在NAs组,有60例患者完成了96 w随访。本研究采用意向性分析(intention-to-treat analysis,ITT分析,即对所有进入本研究的患者进行疗效和安全性分析,或对脱落的病例被认为无效),结果在48 w和96 w时,序贯联合组血清HBsAg转阴率和血清学转换率均显著高于NAs组,差异均有统计学意义(P均<0.001,表2)。

表2 两组HBsAg转阴率和血清学转换率(%)比较
2.2 两组血清HBsAg动态变化比较 在治疗12 w后,序贯联合组血清HBsAg水平均显著低于NAs组,差异具有统计学意义(P均<0.001,表3)。
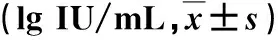
表3 两组HBsAg水平动态变化比较
2.3 两组血清ALT水平动态变化比较 见表4。

表4 两组血清变化比较
2.4 两组LSM变化比较 见表5。
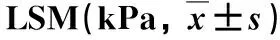
表5 两组变化比较
3 讨论
NAs和Peg-IFN-α均为慢性乙型肝炎防治指南推荐的抗HBV感染的一线药物,但两者抗HBV的作用机制不同[1]。NAs主要通过竞争性抑制HBV DNA聚合酶的活性而直接抑制HBV DNA的复制,具有抗病毒作用强、安全性好等特点,但血清HBsAg清除率低[4]。IFN-α具有抗病毒和免疫调节双重作用。它可以诱导具有抗病毒作用的干扰素刺激基因的表达,活化并增强T淋巴细胞、巨噬细胞、自然杀伤细胞功能,诱导脱氨酶载脂蛋白B mRNA编辑酶催化多肽3A的表达而降解HBV复制模板共价闭合环状DNA(covalently closed circular DNA, cccDNA),从而彻底清除HBsAg[5]。多项临床研究已证实联合使用抑制病毒复制和调节宿主免疫的治疗方法,通过不同机制的协同作用可以有效地提高CHB患者血清HBsAg 转阴率及血清学转换率[6-9]。然而,目前关于两类药物联合使用治疗血清低水平HBsAg的CHB患者的疗效仍不明确。
本研究中42例NAs经治的血清低水平HBsAg的CHB患者通过序贯联合Peg-IFN-α治疗,获得了较好的疗效。在治疗48 w 末,血清HBsAg转阴率及血清学转换率分别为19.0%和14.3%,在随访48 w时分别提高到21.4%和19.0%,显著高于未序贯联合Peg-IFN-α而继续单用NAs治疗的CHB患者。该研究结果表明对于NAs经治的低水平HBsAg的CHB患者,采用NAs与Peg-IFN-α序贯联合治疗可以充分地发挥两者的协同抗病毒作用,从而有效地提高HBsAg 转阴率及血清学转换率。
本研究结果显著优于法国学者Marcellin et al报道的应用富马酸替诺福韦酯与Peg-IFN-α初始联合治疗方案的研究结果,其血清HBsAg清除率仅为9.0%[7]。分析其原因可能为本研究所采用的治疗方案是一种优化的联合治疗方案,所选患者是经过长期NAs治疗后实现HBV DNA持续抑制、HBeAg阴转且HBsAg降至低水平的患者,属于Peg-IFN-α治疗的优势患者[10]。 既往研究发现高水平的HBsAg、HBeAg和HBV DNA 可以导致机体HBV特异性T细胞的耗竭,Thl/Th2比例失衡,诱导机体免疫耐受,从而降低机体对Peg-IFN-α的治疗应答[11-14]。长期NAs治疗可以有效地抑制HBV DNA复制并且降低HBsAg水平,促使机体免疫功能的恢复,进而提高机体对Peg-IFN-α的应答[15]。
然而,我们前期已发表的研究显示NAs序贯联合Peg-IFN α-2a治疗血清HBsAg≤ 1500 IU/mL的CHB患者可实现37.4% HBsAg转阴率和29.7%血清学转换率,显著优于本研究的疗效[6]。分析其原因可能为前期研究所入选的患者是LSM <9.0 kPa的CHB患者,而本研究的患者是伴有肝纤维化(9.0 ≤ LSM < 12.0 Kpa)的患者,提示CHB伴有肝纤维化可能会影响对Peg-IFN-α治疗的应答。
本研究中我们观察到序贯联合组患者在使用Peg-IFN-α治疗前基线ALT水平正常,与NAs治疗患者无统计学差异,而78.6%患者在使用Peg-IFN-α治疗过程中出现了ALT升高,而在停用Peg-IFN-α治疗后,ALT也逐渐恢复至正常水平,推测Peg-IFN-α可以导致CHB患者免疫功能的激活,而既往研究发现这种免疫功能的激活又会促进HBsAg的清除[16]。
本研究发现在随访48 w时,序贯联合组患者LSM显著低于NAs组,推测Peg-IFN-α治疗可以有效地改善肝纤维化程度[17]。然而,有趣的是我们观察到在48 w治疗结束时序贯联合治疗组患者LSM水平显著高于NAs组,可能为Peg-IFN-α治疗导致肝脏炎症反应影响了LSM的评估[18]。本研究结果显示序贯联合组患者所发生的不良反应均为Peg-IFN-α的常见不良反应,无严重不良反应发生。
本研究存在以下两点局限性:一、使用瞬时弹性成像进行无创性肝脏硬度测定不能取代肝组织活检。虽然肝穿刺活检是诊断肝纤维化分期的金标准,但由于其具有侵袭性、取样偏差、观察者间偏差、观察者内偏差、胆漏和出血等风险[19],在临床实践中难以广泛实施。瞬时弹性成像是一种较为成熟的无创检查技术,在胆红素和转氨酶均正常的情况下能够比较准确地识别出轻度肝纤维化和进展期肝纤维化或早期肝硬化[20];二、样本量偏小。后续我们将会开展多中心研究进一步扩大样本量,继续观察该治疗方案的疗效和安全性。

