西罗莫司对肝脏热缺血-再灌注损伤小鼠肝组织TLR4表达和细胞自噬功能的影响*
唐双意,王希斌,丘 岳,覃福礼,张宏亮,蒋 霞
肝脏缺血-再灌注(ischemia-reperfusion,I/R)损伤是指中断的肝脏血供重新恢复血供灌注后所引起的肝组织损伤的病理生理过程[1,2]。肝脏I/R损伤是肝移植、肝切除和外伤后肝损伤的主要原因,然而目前临床上针对肝脏I/R损伤仍缺乏有效的保护手段。西罗莫司是一种大环内酯类化合物,作为主要的免疫抑制剂在器官移植术后抗排异反应中被广泛应用。在体内,西罗莫司通过抑制哺乳类雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)发挥免疫抑制活性。文献[3]报道,在大鼠肾脏I/R损伤模型,西罗莫司能减少肾小球滤过率下降,减轻肾组织损伤。国内报道[4]显示,西罗莫司在大鼠肝脏I/R损伤过程中具有保护作用。然而,目前对西罗莫司抗I/R损伤的具体机制尚不完全清楚。本研究通过构建小鼠部分肝脏I/R损伤模型,观察了西罗莫司预处理的保护作用,并从Toll样受体4(Toll-like receptor 4,TLR4)介导的免疫炎症损伤和自噬方面探讨了其可能的作用机制,以期为肝脏I/R损伤的治疗寻找新思路。
1 材料与方法
1.1 动物、主要试剂与仪器 雄性Balb/c小鼠40只,6~8周龄,购自北京维通利华实验动物技术有限公司【合格证号:SCXK(京)2020-0029】。西罗莫司(美国Selleck公司,纯度≥98%);检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)试剂盒(南京建成生物工程研究所);兔抗小鼠TLR4抗体(Santa Cruz公司);兔抗小鼠P65、抗p-P65、抗微管相关蛋白1轻链3-Ⅱ(LC3B-Ⅱ)、抗GAPDH抗体和HRP标记的羊抗兔二抗(美国CST公司);兔抗小鼠P62抗体(Eptomics公司);全自动酶标免疫分析仪(Biotex公司);全自动生化分析仪(日本Hitachi公司);蛋白电泳和转膜仪(美国Bio-Rad公司);透射电子显微镜(荷兰FEI公司)。
1.2 动物模型的制备 将40只小鼠适应性喂养后,随机分为对照组、模型组、小剂量(1 mg.kg-1)和大剂量西罗莫司干预组(3 mg.kg-1),每组10只。在西罗莫司干预组,分别于术前2 d开始腹腔注射给药,连续2 d,在对照组和模型组,则给予等量的生理盐水腹腔注射。手术当日,给予小鼠戊巴比妥60 mg.kg-1深度麻醉,仰卧位固定。消毒腹壁皮肤并于小鼠下腹部行T型切口,小心分离皮肤、剪开腹膜,充分暴露腹腔、解剖小叶韧带后,以微血管夹阻断Glison鞘的左支和中支,可见小鼠肝脏中叶和左外叶呈暗红色或灰白色改变,而右叶颜色鲜红不变。在60 min后,移除微血管夹,待缺血肝叶恢复血色后,缝合腹腔[5];在对照组采用同样的手术方式,但术中不使用微血管夹阻断血供。恢复再灌注6 h后,每组取6只小鼠经眼眶取血后处死,取肝组织,用生理盐水充分冲洗并吸取表面水分,一部分置于10%福尔马林中固定24 h,常规石蜡包埋、切片,进行HE染色;另一部分使用2.5%戊二醛固定,制作电镜切片,将其余肝组织置于-80℃冰箱保存。
1.3 血清指标检测 使用全自动血生化分析仪及相应的试剂盒检测血清ALT和AST活力;采用ELISA法检测血清TNF-α和IL-6。
1.4 肝组织蛋白表达检测 取各组小鼠肝组织,加入组织裂解液,匀浆,提取蛋白,采用BCA法定量蛋白质。取50 μg样品蛋白,经聚丙烯酰胺凝胶电泳,转印至硝酸纤维素膜,使用5%脱脂牛奶室温封闭2 h,以GAPDH为内参,分别加入抗TLR4、抗P65、抗p-P65、抗LCB-Ⅱ和抗P62抗体,4℃孵育过夜,TBST洗膜3次。最后,加二抗室温下孵育2 h,采用ECL法显色,应用Image J软件分析蛋白条带灰度值,计算各蛋白相对表达量。
1.5 肝组织自噬小体检测 取约1mm3肝组织,使用2.5%戊二醛固定。超薄切片,用醋酸铀和柠檬酸铅双重染色。使用Tecnai G2透射电子显微镜获取图像,随机取每个肝脏样本10张显微照片,计数自噬小体总量。

2 结果
2.1 各组小鼠血清AST和ALT水平比较 与对照组比,模型组小鼠血清AST和ALT水平均显著升高(P<0.05);与模型组比,小剂量和大剂量西罗莫司干预组小鼠血清AST和ALT水平均显著降低(P<0.05,表1)。

表1 各组小鼠血清AST和ALT水平比较
2.2 各组小鼠肝组织病理学表现 对照组小鼠肝组织结构正常,肝小叶结构完整,肝细胞呈条索状排列,未见变性、坏死细胞;模型组可见肝小叶结构不清,网状纤维支架塌陷,细胞排列紊乱,胞质疏松,细胞呈空泡样变,可见大片状肝细胞坏死,且炎性细胞浸润明显;在小剂量和大剂量西罗莫司干预组肝细胞空泡样变和坏死程度有不同程度的减轻,炎性细胞浸润均明显减少(图1)。
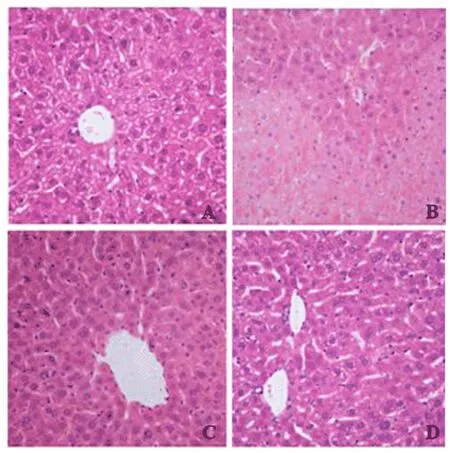
图1 各组小鼠肝组织病理学表现(HE,200×) A:对照组;B:模型组;C:小剂量干预组;D大剂量干预组
2.3 各组小鼠血清细胞因子水平比较 与对照组比,模型组小鼠血清TNF-α和IL-6水平均显著升高(P<0.05);与模型组比,小剂量和大剂量西罗莫司干预组小鼠血清细胞因子水平均显著降低(P<0.05,表2)。
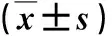
表2 各组小鼠血清细胞因子水平比较
2.4 各组小鼠肝组织TLR4/NF-κB信号通路相关蛋白表达情况 与对照组比,模型组小鼠肝组织TLR4蛋白表达和p-p65/p65比值均显著升高(P<0.05);与模型组比,小剂量和大剂量西罗莫司干预组小鼠肝组织TLR4和p-p65/p65比值均显著降低(P<0.05,图2)。
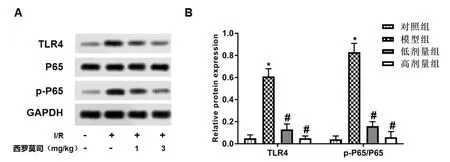
图2 各组小鼠肝组织TLR4/NF-κB信号通路相关蛋白表达情况 与对照组比,*P<0.05;与模型组比,#P<0.05
2.5 各组小鼠肝组织自噬相关蛋白表达和自噬小体数量比较 与对照组比,模型组小鼠肝组织LC3B-Ⅱ和P62蛋白表达及自噬小体数量差异均无统计学意义(P>0.05);与模型组比,小剂量和大剂量西罗莫司干预组小鼠肝组织LC3B-Ⅱ和P62蛋白表达水平及自噬小体数量均显著增加(P<0.05,图3)。
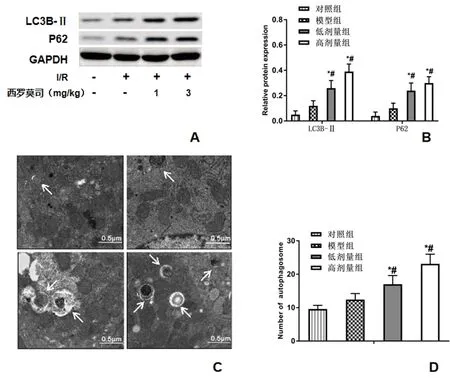
图3 各组小鼠肝组织自噬相关蛋白表达和自噬小体数量比较 A:各组小鼠肝组织LC3B-Ⅱ和P62蛋白表达(Western blot);B:各组小鼠肝组织LC3B-Ⅱ和P62蛋白相对表达水平;C:各组小鼠肝组织自噬小体数量(透射电镜,6000×);D:各组小鼠肝组织自噬小体数量比较与对照组比,*P<0.05;与模型组比,#P<0.05
3 讨论
本研究采用手术夹闭小鼠Glison鞘左支和中支构建部分肝脏热I/R模型,模型制备获得成功。肝组织学检查显示,模型组出现细胞排列紊乱,小叶结构不清,细胞空泡样变,炎性细胞浸润等明显异常表现,符合肝脏热I/R损伤的病理学表现。另外,血清学检测发现与对照组相比,模型组血清ALT和AST大幅升高,结合上述几点可见本研究小鼠部分肝脏热I/R损伤模型构建成功。本研究在小剂量和大剂量西罗莫司预处理均可以有效降低小鼠血清ALT和AST活性,肝细胞变性和炎性浸润明显改善,提示该药能明显改善肝I/R病程学损伤。
肝脏I/R损伤是一种先天免疫系统主导的局部炎症反应,在肝脏I/R期间,损伤或坏死的细胞释放损伤相关分子模式分子,进一步激活模式识别受体,从而诱导强烈的炎症反应和组织损伤[5-7]。TLR4作为一种重要的模式识别受体,研究[8]表明在肝脏I/R损伤中,炎症和免疫反应主要取决于TLR4的活化程度。另有研究[9]发现,在肝脏热I/R损伤模型小鼠,TLR4信号通过招募下游MyD88蛋白介导了NF-κB的活化,扩大肝脏炎症反应并进一步引起肝细胞凋亡。NF-κB作为一种重要的细胞转录因子,NF-κB磷酸化是其活化进入胞核与靶序列结合,促进靶基因表达的关键标志[10,11]。本研究在小剂量和大剂量西罗莫司干预组均可以明显下调TLR4表达并抑制NF-κB(p65)的磷酸化水平,因此推测西罗莫司可能通过抑制TLR4/NF-κB信号通路激活,减轻小鼠肝脏I/R。西罗莫司还可以明显下调血清TNF-α和IL-6水平,提示西罗莫司干预通过抑制NF-κB激活和随后的炎症反应减轻了小鼠肝脏I/R损伤。
越来越多的证据表明,自噬参与了多种肝脏疾病过程,包括毒素和药物诱导的肝损伤、非酒精性脂肪性肝病、酒精性肝病、病毒性肝炎和肝细胞癌等[12,13]。自噬被证实在肝脏I/R损伤中具有保护作用[14,15],诱导自噬已成为I/R损伤后改善肝功能的潜在新策略。在肝脏I/R损伤过程中,自噬通过提供氨基酸和ATP等必要的生存物质,使肝脏细胞在经历I/R时更容易适应缺血和缺氧,从而减轻组织损伤。自噬能力受损或自噬小体数量不足是导致肝脏I/R损伤的关键机制之一[16]。LC3B-Ⅱ存在于自噬小体膜上,其表达增多使吞噬泡膜伸长并诱导出现自噬小体。自噬小体进一步与溶酶体融合产生自噬性溶酶体,降解摄入的细胞内容物[17]。p62是一种泛素结合蛋白,能与自噬体膜蛋白结合,使得含有p62的蛋白聚集物能被结合至自噬小体上被分解[18,19]。本研究在恢复再灌注6 h时,西罗莫司干预组小鼠肝组织LC3B-Ⅱ和P62蛋白表达水平较模型组显著升高。透射电镜检测自噬小体发现,西罗莫司预处理可诱导小鼠肝细胞自噬小体的产生。

