离心/膜分离组合式双重血浆置换治疗重症狼疮性肾炎的临床研究
董建华 黄 力 李 川 孔 凌 黄丽璇 范文静 吴 边 胡伟新 葛永纯
双重血浆置换(DFPP)可选择性清除血浆中致病抗体,将正常血浆成分(如白蛋白等)回输体内,减少血制品需求量,已广泛应用于重症狼疮性肾炎(LN)等自身免疫性疾病的治疗[1-8]。DFPP多采用中空纤维滤器分离血浆和血细胞(膜式),其血浆提取率低,溶血、滤器凝血等并发症高发,一定程度上限制了其临床应用[9]。国家肾脏疾病临床医学研究中心于2016年首次对DFPP进行技术改进,将离心式血浆分离引入DFPP,利用血浆和血细胞成分比重的差异,通过离心分层分离血浆,创建了离心/膜分离组合式(简称组合式)DFPP治疗模式[10-11],本文通过回顾性研究,观察组合式DFPP治疗重症LN的临床疗效、安全性。
对象和方法
研究对象选取2016年5月至2020年1月在国家肾脏疾病临床医学研究中心住院确诊为重症LN患者共256例,其中接受DFPP治疗的重症LN患者56例。
纳入标准:(1)患者均符合1997年美国风湿病学会系统性红斑狼疮(SLE)诊断标准[12],存在肾脏损害临床表现;(2)符合2019年美国血浆置换学会(ASFA)血浆置换治疗的指征[1]:①临床表现为急进性肾炎综合征、血栓性微血管病(TMA);②或肾活检光镜下见新月体超过50%,弥漫性嗜复红物沉积,有狼疮性血管病变;③或血清自身抗体[抗核抗体(ANA)、抗dsDNA]高滴度阳性;④或同时出现弥漫性肺泡出血(DAH)、狼疮性脑病、抗磷脂抗体综合征(APS)等重要脏器损伤。
排除标准:(1)合并严重细菌感染或活动性病毒感染;(2)伴有严重心脑血管疾病,病情危重;(3)凝血功能检测异常,有出血倾向或活动性出血患者(DAH除外)。
临床观察指标患者年龄、性别、SLE病程、狼疮活动指数(SLE-DAI)、临床表现、肾脏病理分型、治疗方案。采集DFPP治疗前后和随访3月时血常规、血清肌酐、ANA、抗dsDNA、抗C1q抗体、抗磷脂抗体、补体C3和C4、尿蛋白定量和尿红细胞计数。每次DFPP治疗前和治疗次日监测凝血酶原时间(PT)、部分凝血酶原时间(APTT)、纤维蛋白原(Fib)、活化凝血时间(ACT)和血小板。
急性肾损伤(AKI)诊断及分期依据改善全球肾脏预后组织(KDIGO)指南[13]。LN肾脏病理类型参照2003年ISN/RPS分型标准[14]。自身抗体高滴度阳性指ANA≥1∶ 512和(或)抗dsDNA≥1∶ 10。
DFPP疗效评价评价两种DFPP治疗模式对重症LN的临床疗效,及血管通路、抗凝剂用量、治疗耗材费用(包括滤器、管路、中心静脉导管、留置针和抗凝剂)及不良反应等方面的差异。随访时间截止2020-09-01,观察接受肾脏替代治疗(RRT)患者随访3月后摆脱透析的比例。
DFPP治疗方案
组合式DFPP 采用动静脉穿刺或中心静脉留置双腔导管作为血管通路(图1A)。全血流经连续血浆分离装置Cobe Spectra(Cobe Laboratories,Lakewood,CO)进行血浆分离,血流量30~50 ml/min,分离机转速2 000~2 400 r/min。抗凝剂为4%枸橼酸液或联合小剂量低分子肝素(LMWH),4%枸橼酸液与血液的输入速度比为1∶ 15~20。血浆分离速度20~30 ml/min,分离出的血浆进入二级滤器血浆成分分离器EC20W(Asahi Kasei Medical CO.Ltd.日本),滤出血浆回输至患者体内。
膜式DFPP 采用中心静脉留置双腔导管作为血管通路(图1B),LMWH抗凝,维持ACT为正常值的2~2.5倍。全血流经血浆分离器MPS07(Bellco s.p.a意大利),血流速度100~120 ml/min,滤出的血浆进入二级滤器血浆成分分离器EC20W,血浆分离速度20~30 ml/min,滤出血浆回输至患者体内。后续操作两种模式相同,被截留的血浆成分滞留在二级滤器中不断再循环,血浆流量为60 ml/min,当二级滤器前压力逐步升至>180 mmHg时停止分离血浆,用生理盐水800 ml冲洗二级滤器,丢弃二级滤器中仍残留的血浆成分。
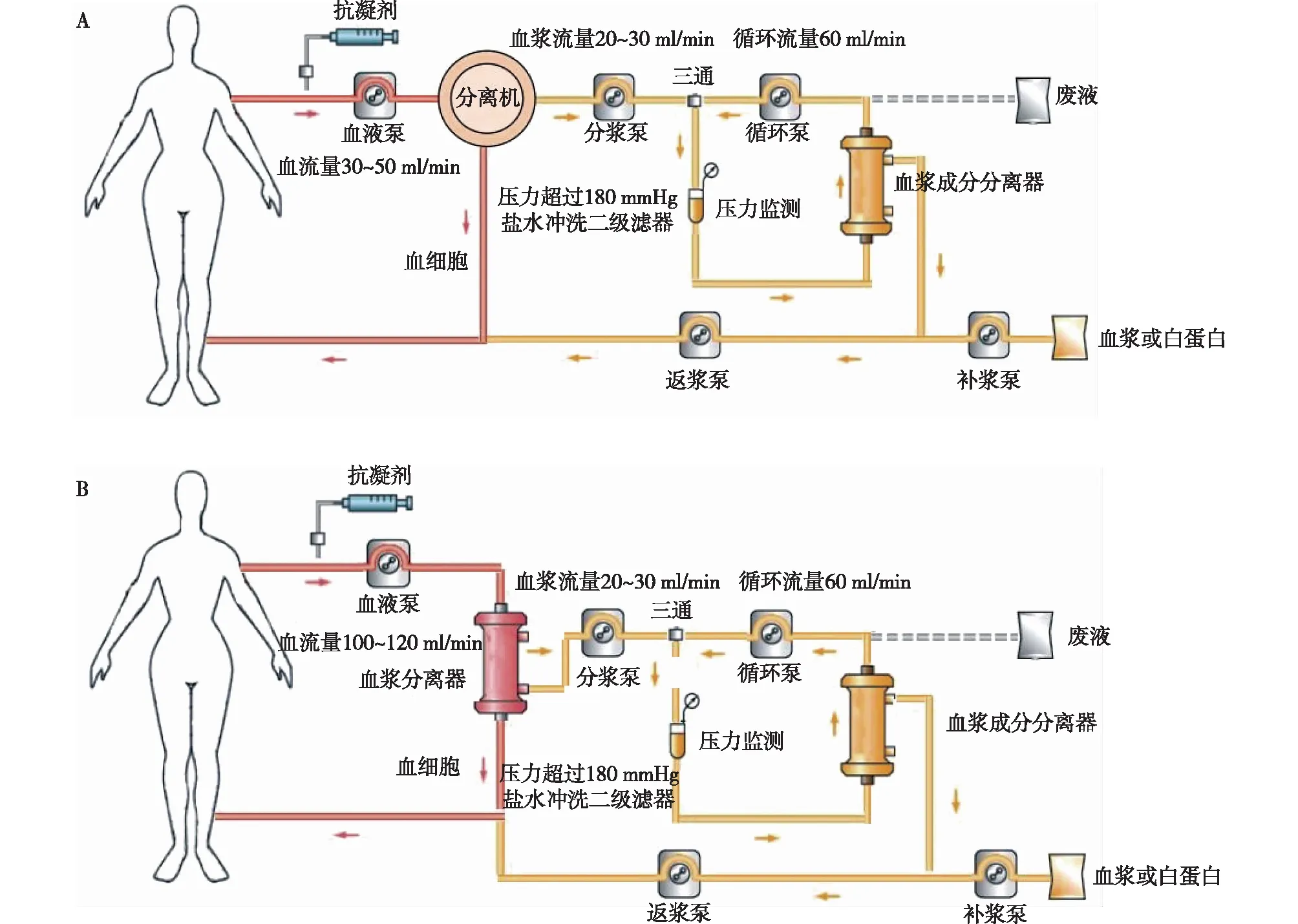
图1 离心/膜分离组合式双重血浆置换(A)和膜式双重血浆置换(B)示意图
每次DFPP治疗处理血浆量为1.5~2倍血浆容量,每次补充人血白蛋白30~40g及新鲜或冰冻血浆200~400 ml。
统计学方法所有数据均采用《SPSS 20》软件进行统计分析和处理。若计量资料服从正态分布,以均数±标准差表示,两组间比较采用两独立样本t检验;若计量资料不服从正态分布,以中位数(四分位间距)表示,两组间比较采用秩和检验(Kruskal-Wallis H检验)。计数资料以百分率表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一般情况56例重症LN患者中,组合式DFPP 38例,膜式DFPP 18例,两组患者在治疗基线时的临床表现、实验室检查、病理表现和治疗方案等指标均无统计学差异(表1)。
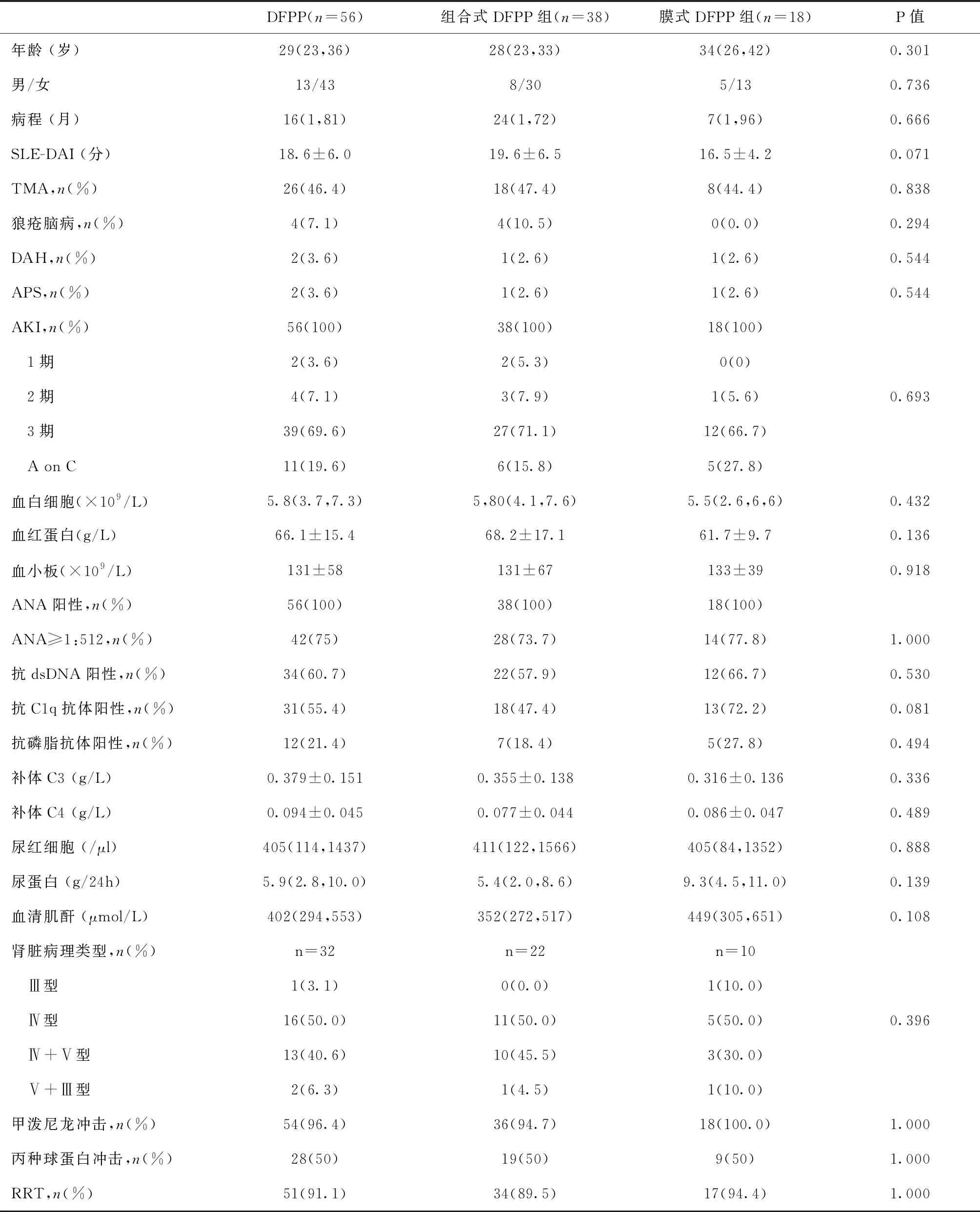
表1 接受组合式DFPP和膜式DFPP治疗的重症LN患者的基线特点
临床疗效所有患者共接受142次DFPP治疗,其中组合式97例次、膜式45例次,平均2.5次DFPP治疗。DFPP治疗后,51例(91.1%)ANA滴度下降,34例(100%)抗dsDNA滴度下降,其中5例ANA转阴,20例抗dsDNA转阴,抗C1q抗体和抗磷脂抗体阳性率均显著下降。尿蛋白、尿红细胞和血清肌酐均显著下降,血红蛋白显著升高,补体C4较治疗前略下降。
随访3月,1例患者死于重症肺部感染,51例RRT患者中31例(60.8%)摆脱透析。ANA和抗dsDNA高滴度比例、贫血、低补体血症均明显改善,摆脱透析患者血清肌酐、尿蛋白和尿红细胞均持续改善(表2)。
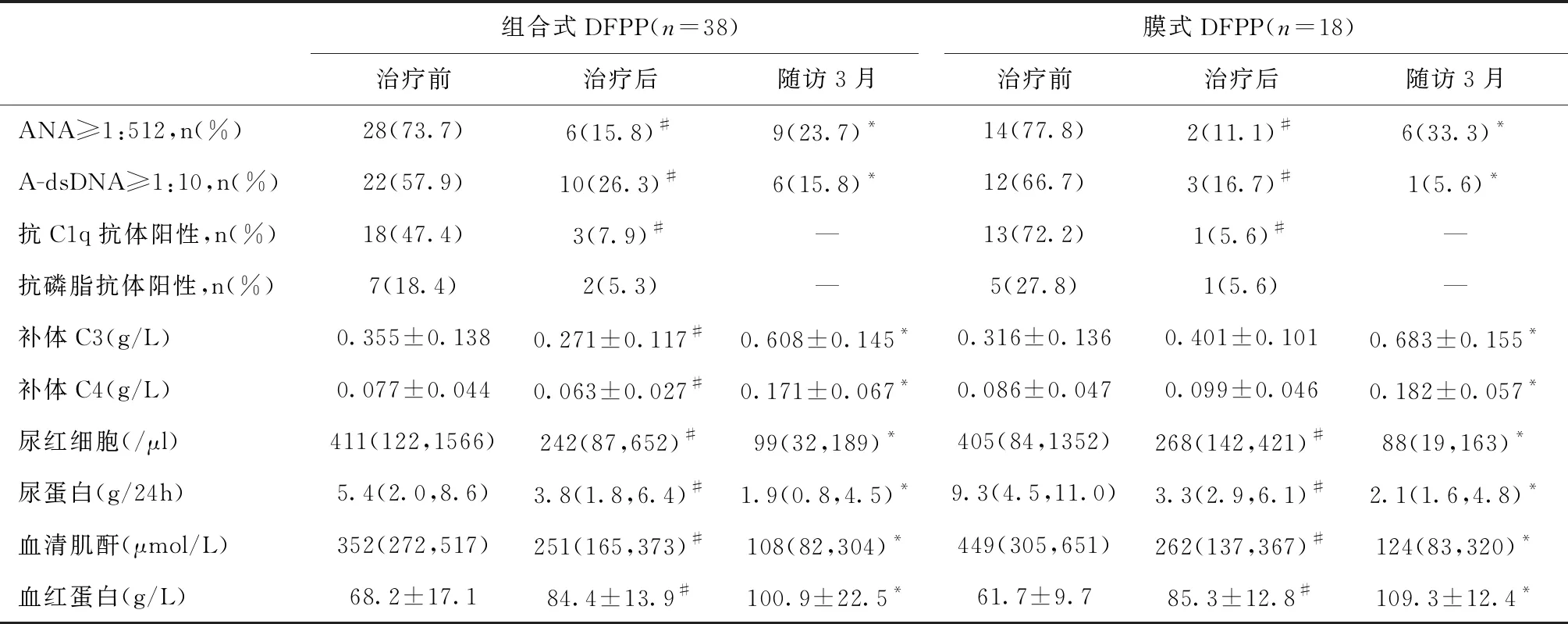
表2 重症LN患者DFPP治疗前、治疗后及随访3月临床指标比较
组合式与膜式DFPP比较膜式DFPP均以中心静脉导管为血管通路,而组合式DFPP中6例患者(15.8%)以穿刺动静脉作为血管通路。29例(76.3%)组合式DFPP单纯采用4%枸橼酸液抗凝,9例(23.7%)采用4%枸橼酸液联合LMWH抗凝,LMWH剂量显著低于膜式DFPP所需剂量(1 174±243 IUvs4 106±399 IU,P<0.001),两种DFPP模式治疗过程中均无凝血事件发生。单次组合式DFPP治疗耗材费用显著低于膜式DFPP(4340.2±237.0元vs5677.0±0.0元,P<0.001)。
组合式DFPP治疗后出现补体C3、C4一过性下降,而膜式DFPP治疗后补体无变化,随访3月时补体C3、C4均显著升高(表2)。组合式DFPP组34例患者接受RRT治疗,其中23例(67.6%)最终摆脱透析;膜式DFPP组17例患者接受RRT治疗,其中8例(47.1%)摆脱透析,但两组无统计学差异(χ2=2.015,P=0.225)。膜式DFPP单次治疗后PT延长更明显,而APTT延长和FIB、血小板降低在两组间无差异(表3)。
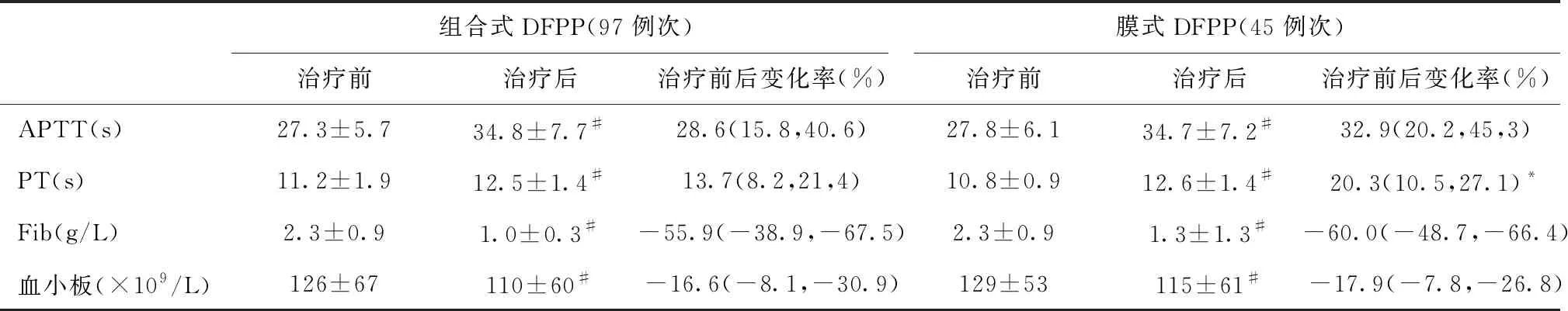
表3 两种DFPP模式治疗前后凝血功能和血小板变化
不良反应DFPP治疗过程中共发生6例次(4.2%)不良反应。其中,组合式DFPP组中4例次(4.1%)出现口周或四肢远端麻木感、手足搐搦,静脉补充钙剂后症状消失,无低血压和Q-T间期延长等心律失常表现。膜式DFPP组中2例次(4.4%)出现出血事件,1例为皮肤淤斑、鼻衄,1例治疗后肺出血。
讨 论
2019年欧洲抗风湿病联盟联合欧洲肾脏学会-欧洲透析和移植学会(EULAR/ERA-EDTA)关于LN管理建议[15]及ASFA血浆置换指南[1]均推荐血浆置换作为重症LN的治疗措施。DFPP是在PE的基础上通过两级滤器,高选择性的清除大分子致病物质。本单位前期研究证实膜式DFPP联合免疫制剂治疗能快速清除重症LN患者自身抗体,缓解狼疮活动,改善肾功能[7];尤其是对伴TMA的LN患者[8]。然而,膜式DFPP需采用LMWH抗凝增加危重患者出血风险,治疗耗材费用较高,在一定程度上限制了其临床应用。本中心位创建的组合式DFPP模式,以离心式血细胞分离机代替一级血浆分离器,单纯枸橼酸抗凝或枸橼酸联合小剂量LMWH抗凝,降低出血风险。本研究首次观察比较了两种DFPP模式在治疗重症LN的临床疗效及技术层面的差异,结果显示两种DFPP模式治疗后及随访3月后,自身抗体滴度显著下降,尿蛋白、尿红细胞及血清肌酐均明显改善,两者疗效相当。
膜式DFPP血浆提取率低,对血流量要求较高,需要留置中心静脉导管。组合式DFPP可最大限度分离血浆与血细胞,获得更高的血浆流量,对血流量要求低。因此,组合式DFPP可直接穿刺桡动脉、肘正中静脉等外周血管作为血管通路,17G穿刺针能获得80 ml/min以上血流量,可以满足治疗需求[16]。临床上若患者无RRT治疗需求,组合式DFPP无需留置中心静脉导管,可避免导管相关感染及血栓形成等并发症。
膜式DFPP需用LMWH抗凝,由于LMWH可额外与血浆蛋白结合,会随血浆被清除,故LMWH用量较高[17],无疑会增加出血风险;对于抗凝血酶Ⅲ活性<50%的患者,LMWH抗凝效果不佳。而这些情况在重症LN患者中并不少见,限制了膜式DFPP的临床应用。体外循环局部枸橼酸抗凝对体内正常凝血状态影响小,可避免出血风险,已在RRT中广泛应用。组合式DFPP对系统性抗凝需求低,采用单纯4%枸橼酸抗凝或枸橼酸联合小剂量LMWH抗凝,即可完成治疗过程,无体外循环凝血和出血事件发生。在联合抗凝患者中LMWH应用剂量远低于膜式DFPP,而膜式DFPP中2例出现出血并发症。
DFPP在清除致病抗体的同时会丢失凝血因子及FIB,单次DFPP治疗后凝血因子由血管外重新分布到血管内,随后机体合成增加。因此,凝血因子多在单次治疗结束后4h内迅速反弹。本研究单次DFPP治疗后凝血功能为治疗次日复查,结果显示膜式DFPP的PT延长仍高于组合式DFPP,可能与应用大剂量LMWH抗凝有关。膜式DFPP治疗后FIB下降率高于组合式DFPP,可能与血浆分离器膜增加FIB吸附有关[18]。
本研究中组合式DFPP易发生口周或四肢远端麻木感、手足搐搦等低血钙临床表现,其主要原因为治疗过程中的枸橼酸螯合钙离子,致血清离子钙降低。组合式DFPP除局部抗凝的枸橼酸外,治疗结束后补充的新鲜冰冻血浆或人血白蛋白均含有枸橼酸成分,同时DFPP治疗过程亦可清除部分钙,这些均是导致组合式DFPP治疗过程发生低钙血症的原因。本研究中出现低钙临床表现的4例患者,经静脉补充钙剂后症状均消失。因此,在组合式DFPP治疗过程中需监测血钙、适量补充钙剂,提高治疗安全性。
本研究为回顾观察性研究,存在一定局限性,部分患者资料收集不全,随访时间、治疗方案不统一,影响组合式DFPP治疗重症LN的预后判断。未来还需前瞻性对照研究进一步证实组合式DFPP改善肾脏远期预后,及在其他疾病领域的应用价值。
综上所述,本研究发现组合式DFPP在重症LN临床治疗效果方面与膜式DFPP无差异,可采用单纯枸橼酸或枸橼酸联合小剂量LMWH抗凝,无严重不良反应,且治疗费用低,具有良好的技术优势和卫生经济学效益,可作为重症LN的治疗手段加以推广应用。

