miR-601在胃癌中的表达及其对胃癌细胞凋亡、侵袭的影响
王石健 陈旭丽
胃癌是全球第5大常见的恶性肿瘤,也是第3大癌症死亡原因,每年约有723 000例胃癌患者死亡[1],且大多数患者首次发现时已处于晚期。尽管晚期胃癌可通过手术和(或)化学疗法治疗,但患者总体5年生存率仍不到24%[2-3]。胃癌的特征是致癌基因发生了多种遗传和表观遗传学改变,这些改变扰乱了关键基因的表达[4-5]。然而,胃癌发生、发展的确切分子机制尚未完全阐明,因此发现潜在胃癌发生、发展的分子生物标志物具有重要的意义。miRNA是一类内源性小分子非编码RNA分子,可通过与mRNA的3′-非翻译区结合从而在转录后调控基因表达[6]。研究发现,miR-601与前列腺癌、食管鳞状细胞癌、肝癌、胰腺癌等多种肿瘤的发生、发展密切相关[7-10]。目前,miR-601在胃癌中的研究不多,miR-601如何介导胃癌的发生、发展需要进一步研究[11]。本文将探讨miR-601在胃癌中的表达及其对胃癌细胞凋亡、侵袭的影响。
1 对象和方法
1.1 对象 选取2018年8月至2019年8月台州市立医院收治的经病理学检查确诊为胃癌的30例患者的癌组织及相应癌旁(距离肿瘤≥2 cm)正常组织标本。纳入标准:(1)患者术前未进行放、化疗等手段治疗;(2)患者未患有其他重大疾病。本研究经本院医学伦理委员会批准,所有患者及家属均知情同意。
1.2 材料和试剂 人胃癌细胞株AGS、HGC-27、MGC-803和正常胃细胞株GES-1均购自中科院上海细胞库;RPMI1640培养基购自美国Gibco公司(批号:A4192301);噻唑蓝(MTT)粉末购自上海碧云天有限公司(批号:ST1537);引物由上海生工生物工程公司合成;RNA提取试剂TRIzol、real-time PCR试剂盒、反转录试剂盒及Lipofectamine 3000均购自美国Invitrogen公司(批号:15596018、A28138、12594100 及 L3000001);miR-601抑制物(miR-601 inhibitor)和阴性对照序列(inhibitor NC)均由上海吉玛基因公司设计合成;AnnexinV-APC/7-AAD细胞凋亡检测试剂盒购自北京百奥莱博科技有限公司(批号:SY0478);Transwell小室购自美国Corning公司(批号:354480);基质金属蛋白酶(MMP)-2、MMP-9、GADPH抗体均购自英国Abcam公司(批号:ab92536、ab76003及 ab9485)。
1.3 方法
1.3.1 细胞培养 将人胃癌细胞株AGS、HGC-27、MGC-80、正常胃细胞株GES-1用含10%FBS和1%链霉素的RPMI1640培养基于37℃、5%CO2的培养箱中培养。
1.3.2 细胞转染及分组 将AGS细胞按照3×105个细胞/孔接种在6孔板中培养,培养24 h后,当细胞融合为一层时进行细胞转染。用转染试剂Lipofectamine 3000将miR-601 inhibitor和inhibitor NC转染AGS细胞,并分为miR-601 inhibitor组和inhibitor NC组。具体操作严格按照转染试剂盒说明书进行。转染48 h后收集总RNA,进行后续的实验检测。
1.3.3 miR-601相对表达量检测 采用qRT-PCR法。采用TRIzol提取总RNA,以RNA为模板,根据反转录试剂盒说明书反转录合成,按照real-time PCR试剂盒的说明书进行反应,扩增miR-601。定量PCR条件:95℃,10 min(1 个循环),95 ℃、15 s,60 ℃、60 s(40 个循环),95 ℃、15 s,60 ℃、60 s,95 ℃、15 s。引物序列:miR-601-F:5′-CACTAGATTGTGAGCTCCTGGA-3′,miR-601-R 5′-GTGCAGGGTCCGAGGT-3′;GAPDH-F:5′-TCAA -GAAGGTGGTGAAGCAGG-3′,GAPDH-R:5′-TCAAAG GTGGAGGAGTGGGT-3′。U6为内参照,以miR-60与U6拷贝数的比值为 miR-601相对表达量,采用2-ΔΔCt法进行计算。
1.3.4 细胞抑制率检测 采用MTT法。将转染后的AGS细胞按照2×103个细胞/孔接种于96孔板中,分别在24、48和72 h时每孔加入MTT溶液,再培养4 h后弃培养上清液,加入150 μl DMSO,室温振荡5 min溶解甲臜结晶,在波长490 nm处用酶标仪检测相应的吸光度值(OD值),计算细胞抑制率,细胞抑制率=1-miR-601 inhibitor组OD值/inhibitor NC组OD值×100%。
1.3.5 细胞凋亡率检测 采用流式细胞术。将转染后的AGS细胞按照3×105个/孔接种在6孔板中培养,收集细胞上清液,PBS清洗后加入不含EDTA的胰蛋白酶消化细胞,收集细胞,于4℃下1 100 r/min离心5 min,重悬细胞后加入流式管。流式管避光加入5 μl AnnexinV-APC染色10 min,再加入5 μl 7-AAD染色5 min,用流式细胞仪进行收集检测。
1.3.6 细胞迁移能力检测 采用细胞划痕实验。将转染后的AGS细胞按照3×105个细胞/孔接种在6孔板中培养,并继续培养孵育至生长为80%左右,用200 μl无菌移液器枪头每孔垂直划3条平行线;弃培养基,PBS洗涤,加入无血清培养基培养,拍照时用PBS缓冲液代替培养基,随机取10个视野,在0 h和24 h通过倒置显微镜拍摄,计算细胞迁移率,细胞迁移率=(0 h划痕宽度-培养后划痕宽度)/0 h划痕宽度×100%。
1.3.7 细胞侵袭能力检测 采用Transwell小室实验。将事先液化的Matrigel用无血清RPMI1640培养基1∶6比例稀释,取100 μl转染后的AGS细胞加入上层Transwell小室,37℃使其固化,继续培养24 h,取出小室后用棉签拭去上层小室未迁移的细胞,甲醇固定细胞,结晶紫染色,随机取10个视野,通过倒置显微镜拍摄,计算细胞侵袭数。
1.3.8 MMP-2、MMP-9蛋白相对表达量检测 采用Western blot法。将转染后的AGS细胞按照3×105个/孔接种在6孔板中培养,加入细胞裂解液裂解,离心收集细胞裂解液。制备分离胶和浓缩胶,蛋白上样电泳,再转移到PVDF膜上,封闭,加入一抗再孵育24 h,然后加入二抗再室温孵育2 h,显影曝光。使用软件分析蛋白条带,计算蛋白相对表达量。

2 结果
2.1 不同组织或细胞中miR-601相对表达量比较 与癌旁正常组织比较,胃癌组织中miR-601相对表达量明显升高,差异有统计学意义(P<0.01);与GES-1比较,其余3株胃癌细胞miR-601相对表达量均明显升高,差异均有统计学意义(均P<0.05);与inhibitor NC组比较,miR-601 inhibitor组miR-601相对表达量明显升高,差异有统计学意义(P<0.01)。见表1~3。

表1 胃癌组织和癌旁正常组织中miR-601相对表达量比较

表2 不同细胞株中miR-601相对表达量比较

表3 两组细胞中miR-601相对表达量比较
2.2 两组细胞抑制率比较 结果显示与inhibitor NC组相比,转染 miR-601 inhibitor后 24、48、72 h时 miR-601 inhibitor组细胞抑制率均较低,差异均有统计学意义(均 P<0.05),见图 1。

图1 两组细胞抑制率比较(与inhibitor NC组比较,*P<0.05,**P<0.01)
2.3两组细胞凋亡率比较 与inhibitor NC组比较,miR-601 inhibitor组的细胞凋亡率明显增加,差异有统计学意义(P<0.01)。见图 2、表 4。
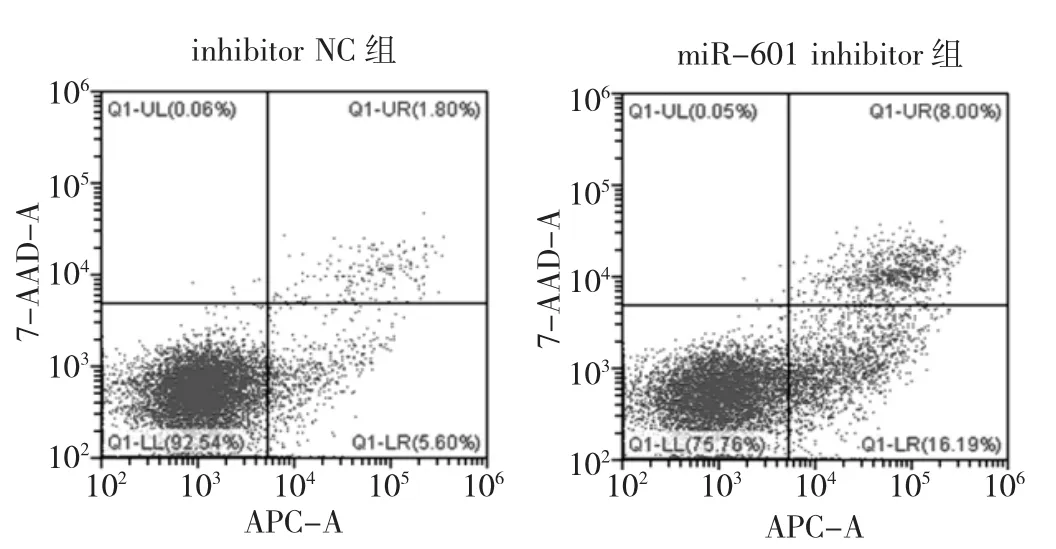
图2 两组细胞凋亡率的流式细胞图

表4 两组细胞凋亡率比较(%)
2.4 两组细胞细胞迁移率和细胞侵袭数比较 与inhibitor NC组比较,miR-601 inhibitor组的细胞迁移率明显升高,而细胞侵袭数明显减少,差异均有统计学意义(均 P<0.05),见图 3、表5和图4(插页)、表6。

表5 两组细胞迁移率比较(%)

表6 两组细胞侵袭数比较(个)
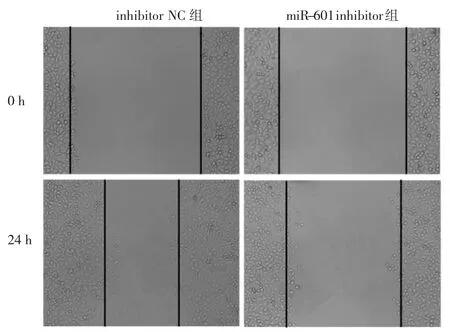
图3 两组细胞划痕实验图

图4 两组细胞侵袭数比较(结晶紫染色,×200)
2.5 两组细胞MMP-2、MMP-9蛋白相对表达量比较与inhibitor NC组比较,miR-601 inhibitor组MMP-2和MMP-9蛋白相对表达量均明显降低,差异均有统计学意义(均P<0.05),见图 5和表7。
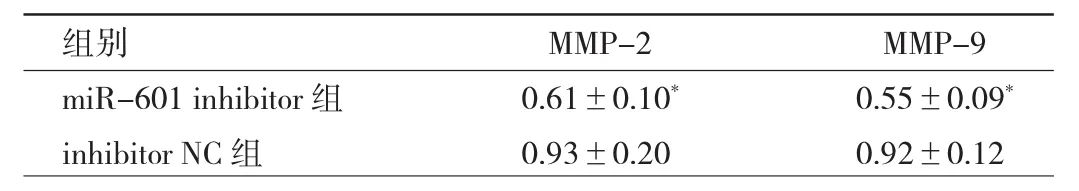
表7 两组细胞MMP-2、MMP-9蛋白相对表达量比较
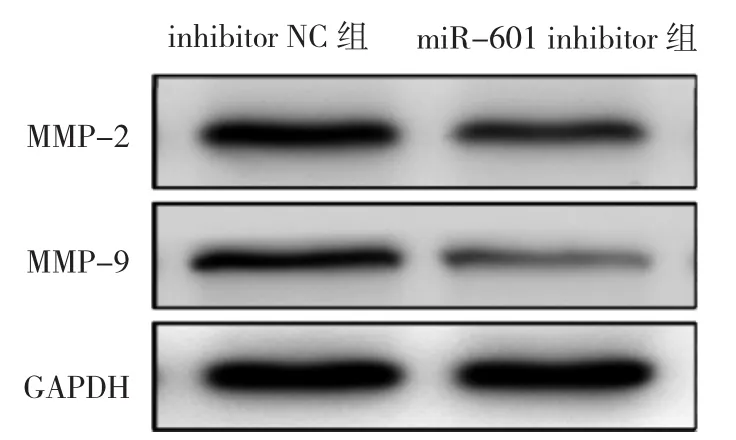
图5 两组细胞MMP-2、MMP-9蛋白表达电泳图(MMP为基质金属蛋白酶)
3 讨论
胃癌是人类消化系统的常见恶性肿瘤,其发病率和病死率逐年上升[1]。鉴定具有高灵敏度和特异度的肿瘤标志物对于早期胃癌的临床筛查非常重要。越来越多的研究证明,抑癌基因或癌基因异常表达都会介导胃癌的发生和发展[7]。因此,探索有潜力的抑癌基因对于胃癌研究进展具有重要的临床意义。
近年来,已在胃癌的肿瘤样本中广泛检测到miRNA的异常表达,并发现这些miRNA在胃癌进展过程中发挥重要作用。Qiu等[12]的研究结果表明miR-671-5p在胃癌中处于低表达水平,但miR-671-5p过表达后能够通过靶向细胞增殖上调因子抑制胃癌细胞增殖。还有研究发现在胃癌组织中miR-376a呈低表达,且miR-376a与胃癌患者的生存密切相关[13]。因此,探讨miRNA的临床和功能作用仍具有重要意义,可为胃癌提供有效的治疗方法。
miR-601是miRNA家族的重要成员,已在多种人类癌症中检测到miR-601的异常表达。但是miR-601作为癌基因或抑癌基因的作用随癌症类型而不同。例如,研究发现miR-601在在肝癌组织和细胞系中的表达显著下调,进一步的实验表明miR-601可能通过直接靶向结合磷脂酰肌醇3激酶调节亚基3和调节蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路来抑制肝癌的进展[9]。Cao等[10]也证明了miR-601在胰腺癌组织中表达明显下调,且发现miR-601可能抑制Sirtuin1的表达参与胰腺癌的进展。但Scheffer等[14]的研究结果发现miR-601在膀胱癌组织中的表达水平上调。最新的研究发现长链非编码RNA人类同源盒基因转录反义间RNA可通过介导miR-601靶向锌指转录因子促进乳腺癌的发展[15]。但miR-601是如何介导胃癌的发展目前尚不明确。本研究结果发现miR-601在胃癌组织中表达升高,且进一步发现相对于正常胃细胞GES-1,miR-601在胃癌细胞株AGS、HGC-27、MGC-803表达升高,这与Min等[11]的结果相一致。以上组织学及细胞学水平的检测结果均证实,miR-601在胃癌中表达升高,初步提示miR-601可能是胃癌的的促癌基因,抑制miR-601的表达可以抑制胃癌的发生、发展。
本文的实验结果表明,当AGS细胞转染miR-601 inhibitor后,AGS细胞中的miR-601的表达降低;同时发现抑制miR-601的表达后,AGS细胞的生长受到抑制,说明miR-601参与了胃癌细胞的生长。目前,有大量研究发现miRNAs与肿瘤侵袭、转移的密切相关。例如,miR-519d可通过靶向结合人表皮生长因子受体3抑制非小细胞肺癌细胞的增殖、迁移和侵袭[16]。miR-216B在人类皮肤鳞状细胞癌中表达降低,但miR-216B表达上调后能够通过下调Xklp2靶蛋白表达从而抑制皮肤鳞状癌细胞的增殖、侵袭和迁移[17]。本研究发现miR-601也可介导胃癌的侵袭和迁移。细胞划痕实验发现,当AGS细胞转染miR-601 inhibitor后,AGS细胞的迁移能力明显降低;同时,Transwell小室实验检测发现下调miR-601后,胃癌细胞AGS侵袭能力也明显下降。MMP-2和MMP-9是MMPs的成员,它们与肿瘤细胞转移关系最为紧密[18],进一步行Western blot结果发现,下调miR-601表达后,MMP-2和MMP-9的表达降低,说明了miR-601可通过降低MMP-2和MMP-9的表达介导胃癌的侵袭和迁移。
综上所述,本研究初步发现miR-601在胃癌组织和细胞中表达升高,且抑制miR-601表达后能够抑制胃癌细胞的生长、侵袭和迁移,但miR-601上下游的靶基因和细胞通路仍然不清楚,需要后续实验的进一步研究。

