芹菜素调控PTCH1/GLI1/Bcl-2轴对胰腺癌细胞增殖、凋亡的影响
潘岩 刘鲁明 花永强
胰腺癌是消化系统常见的恶性肿瘤之一,因其隐匿起病、高度恶性,且缺乏明显的临床表现,85%的患者在发病确诊时已属于癌症终末期,5年生存率低于7%[1]。Sonic Hedgehog信号通路在胰腺肿瘤的形成发展、浸润转移、肿瘤多药耐药等过程中发挥重大作用[2],靶向调控GLI1转录因子可改善患者临床预后[3]。芹菜素作为一种天然黄酮物质,普遍存在于食用蔬菜和水果中,研究证明其可通过调控肿瘤相关基因、诱导细胞凋亡、调节信号通路传导、阻断肿瘤血管形成、放化疗增敏及化学预防等多种途径发挥抗肿瘤作用[4-5]。有研究报道芹菜素对胰腺癌有明显的抑制作用[5-7],但其作用机制尚不明确。本研究以PTCH1/GLI1/Bcl-2轴为切入点,探索芹菜素对胰腺癌细胞增殖和细胞凋亡的影响及其潜在作用机制。
1 材料和方法
1.1 细胞株 人胰腺癌BxPC-3细胞、SW1990细胞均为复旦大学附属肿瘤医院中西医结合科刘鲁明教授惠赠。
1.2 主要试剂与仪器 RPMI1640购自美国Hyclon公司;FBS试剂购自美国Gibco公司;青、链霉素双抗购自德国Sigma公司;体外增殖检测试剂盒(CCK-8)购自日本本同仁化学研究所;细胞凋亡检测AnnexinV/PI试剂盒购自美国Invitrogen公司;逆转录试剂盒、PCR试剂盒均购自加拿大Fermentas公司;PTCH1、GLI1、Bcl-2和GAPDH引物均由上海生物工程技术有限公司合成;兔抗人PTCH1、GLI1、actin均购自美国 Cell Signalling Technology公司;山羊抗兔二抗购自美国Santa Cruz公司;BD FACalibur System流式细胞分析仪均购自美国BD公司;基因扩增仪购自德国Eppendorf公司。
1.3 方法
1.3.1 细胞培养 将人胰腺癌BxPC-3细胞、SW1990细胞接种于含10%FBS、1%青、链霉素的RPMI 1640培养基中[8],在37℃、5%CO2饱和湿度条件下培养,当细胞融合达75%左右时,1∶3传代。
1.3.2 细胞活力检测 采用CCK-8法。将制成单细胞悬液的胰腺癌BxPC-3、SW1990细胞以 1×103个/孔接种于96孔板(100 μl/孔)。将芹菜素用0.1%DMSO溶解,并制备成浓度梯度的芹菜素溶液(2、5、10、20、40、60、80 μmol/L)。上述细胞培养24 h后加入0.1%DMSO及浓度梯度的芹菜素进行干预24、48和72 h。检测细胞活力时每孔加入CCK-8溶液10 μl,培养1 h后用酶标仪在450 nm波长下测定光密度值,计算细胞活力。使用graphpad prism软件计算BxPC-3、SW1990细胞经芹菜素干预48 h后的半数抑制浓度(IC50)。
1.3.3 细胞凋亡率检测 采用流式细胞术。按照细胞凋亡检测试剂盒说明书,通过胰蛋白酶消化获取的胰腺癌BxPC-3、SW1990 细胞,用 PBS 洗涤,加入 195 μl Annexin V-FITC结合液,常温避光处理10 min后加入10 μl PI染色液,冰浴避光放置,随即用流式细胞仪进行检测。
1.3.4 细胞克隆形成率检测 采用平板克隆实验。将制成单细胞悬液的胰腺癌BxPC-3、SW1990细胞以5×102个/孔接种于6孔板(1 ml/孔),待细胞贴壁生长后分别加入 0.1%DMSO、10、20、50 μmol/L 的芹菜素干预 14 d。镜下观察5个视野,计数克隆形成数目并拍照,取平均值,计算克隆形成率。克隆形成率(%)=(克隆数/接种细胞数)×100%。
1.3.5 PTCH1、GLI1、Bcl-2 mRNA相对表达量检测 采用RT-PCR法。BxPC-3、SW1990细胞经0.1%DMSO、10、20、50 μmol/L 芹菜素干预 48 h。参考前期研究[9]提取细胞总RNA,采用RT-PCR试剂盒检测PTCH1、GLI1、Bcl-2 mRNA相对表达量。根据SYBR Green PCR Master Mix试剂盒说明反应体系20 μl,反应条件:94℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,共30个循环。PTCH1引物:上游:5′-CGGCGTTCTCAATGGGCTGGTTTT-3′,下游:5′-GTGGGGCTGCTGTTTCGGGTTCG-3′;GLI1 引物:上游:5′-AGGGAGTGCAGCCAATACAG-3′,下游:5′-ATTGGCCGGAGTTGATGTAG-3′;Bcl-2 引物:上游:5′-GAACTGGGGGAGGATTGTGG-3′,下游:5′-CCGG TTCAGGTACTCAGTCA-3′;GAPDH 引物:上游:5′-CA AGG TCATCCATGACAACTTTG-3′,下游:5′-GTCCACCA CCCTGTTGCTGTAG-3′。最终mRNA的相对表达量使用2-ΔΔCt法定量。
1.3.6 PTCH1、GLI1蛋白表达水平检测 采用Western blot法。参考前期研究描述的方法,用RIPA裂解液裂解细胞,进行蛋白提取,BCA法检测蛋白浓度[9]。取等量蛋白,进行SDS-PAGE凝胶电泳分离样品;将蛋白电转至PVDF膜,用5%脱脂奶粉封闭,与一抗4℃孵育过夜。缓冲液洗膜(15 min×3次)后将膜与二抗室温孵育2 h,化学发光法检测蛋白表达丰度。采用Bio-Rad Image Lab 5.2.1软件进行灰度分析。

2 结果
2.1 8组BxPC-3、SW1990细胞活力比较 与 0.1%DMSO 组比较,2、5、10、20、40、60、80 μmol/L 芹菜素组24、48、72 h时的IC50均明显降低,且呈剂量及时间依赖性,差异均有统计学意义(均P<0.01),见图1。

图1 8组BxPC-3、SW1990细胞活力比较(a:BxPC-3细胞;b:SW1990细胞)
2.2 4组BxPC-3、SW1990细胞凋亡率比较 与0.1%DMSO 组比较,10、20、50 μmol/L 芹菜素组 BxPC-3、SW1990细胞凋亡率均明显升高,且呈剂量依赖性,差异均有统计学意义(均P<0.01),见表1、图2。

图2 4组 BxPC-3、SW1990细胞凋亡率的流式细胞图(a:BxPC-3细胞;b:SW1990细胞)

表1 4组BxPC-3、SW1990细胞凋亡率比较(%)
2.3 4组BxPC-3、SW1990细胞克隆形成率比较 与0.1%DMSO 组比较,10、20、50 μmol/L 芹菜素组 BxPC-3、SW1990细胞克隆形成率均明显下降,且呈剂量依赖性,差异均有统计学意义(均P<0.01),见表2、图3(插页)。
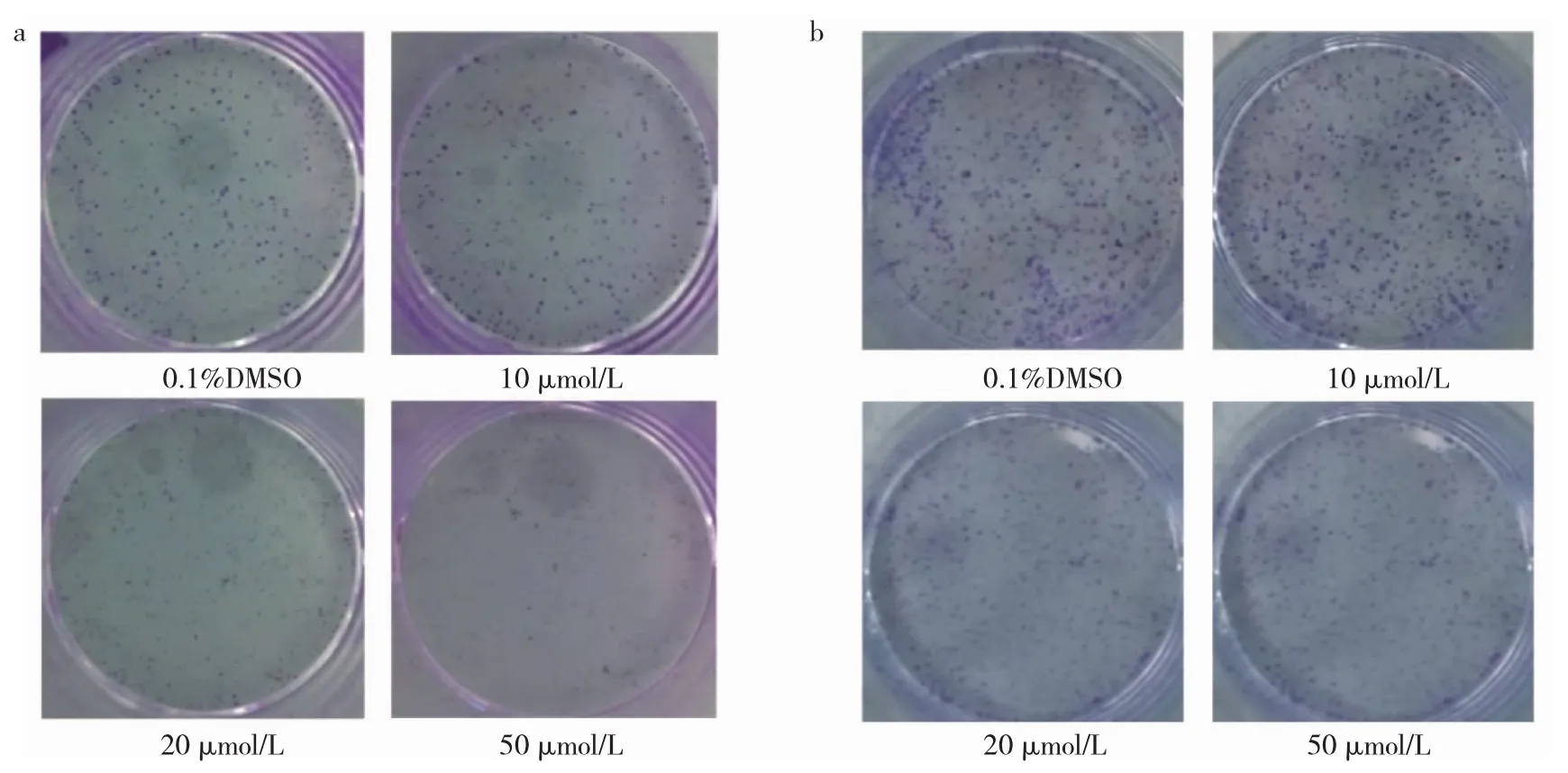
图3 4组BxPC-3、SW1990细胞克隆形成率比较(a:BxPC-3细胞;b:SW1990细胞)

表2 4组BxPC-3、SW1990细胞克隆形成率比较(%)
2.4 4 组 BxPC-3、SW1990 细胞 PTCH1、GLI1、Bcl-2 mRNA相对表达量比较 与0.1%DMSO组比较,10、20、50 μmol/L 芹菜素组 BxPC-3、SW1990 细胞 PTCH1、GLI1、Bcl-2 mRNA相对表达量均明显下调,差异均有统计学意义(均 P<0.01),见表 3~5。

表3 4组BxPC-3、SW1990细胞PTCH1 mRNA相对表达量比较

表4 4组BxPC-3、SW1990细胞GLI1 mRNA相对表达量比较

表5 4组BxPC-3、SW1990细胞Bcl-2 mRNA相对表达量比较
2.5 4组BxPC-3、SW1990细胞PTCH1、GLI1蛋白表达水平比较 与0.1%DMSO组比较,10、20、50 μmol/L芹菜素组BxPC-3、SW1990细胞 PTCH1、GLI1蛋白表达水平均明显下降,差异均有统计学意义(均P<0.01),见表 6~7、图 4。
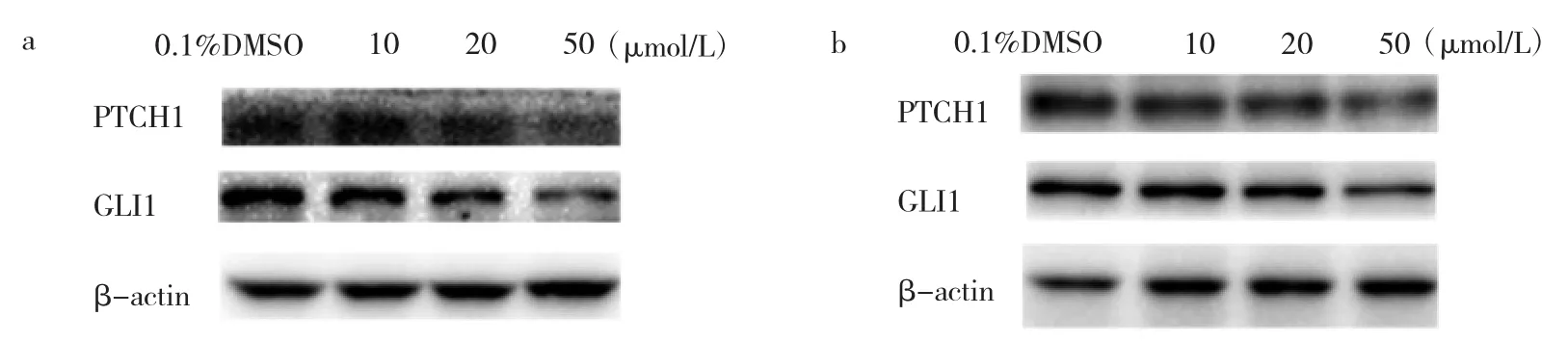
图4 4组 BxPC-3、SW1990细胞PTCH1、GLI1蛋白表达的电泳图(a:BxPC-3细胞;b:SW1990细胞)

表6 4组BxPC-3、SW1990细胞PTCH1蛋白表达水平比较

表7 4组BxPC-3、SW1990细胞GLI1蛋白表达水平比较
3 讨论
芹菜素是一种常见的黄酮类化合物,广泛存在于多种水果、蔬菜、豆类和茶叶中,在众多实体肿瘤中发挥抗肿瘤作用[5],这一作用主要通过抑制细胞增殖、诱导细胞凋亡和自噬来实现[10]。在前列腺癌中,Shukla等[11]发现芹菜素可以通过下调NF-κB激酶抑制剂和NF-κB信号通路来抑制肿瘤细胞增殖和诱导细胞凋亡。胆管癌HcCCA-1细胞经芹菜素干预24、48、72 h后,细胞生长受抑,细胞凋亡率显著增加,且这种作用呈剂量和时间相关性[12]。本文探索了芹菜素对胰腺癌细胞增殖、凋亡的影响,结果提示不同浓度芹菜素对胰腺癌细胞系BxPC-3和SW1990的细胞增殖有不同程度的抑制作用,对细胞凋亡有不同程度的强化作用,芹菜素干预剂量越大、干预时间越长,作用越明显。这一结果与前期报道的芹菜素干预胰腺癌细胞系AsPc-1、Panc-1和MiaPaCa-2的实验结果一致[6]。
Sonic Hedgehog信号通路异常活化与胰腺恶性肿瘤形成发展关系密切。PTCH1、GLI1在胰腺肿瘤组织中的表达显著高于正常胰腺组织[13]。GLI1转录因子表达与TNM分期、神经浸润、淋巴管转移有关,与分化程度和肿瘤大小无关。GLI1高表达预示着胰腺癌更差的生存预后[14]。因此,Sonic Hedgehog信号通路,尤其GLI1可能是胰腺癌的潜在治疗靶点。本研究采用RT-PCR和Western blot法证实了 20 μmol/L 和 50 μmol/L 浓度的芹菜素可以显著降低胰腺癌BxPC-3和SW1990细胞中PTCH1、GLI1在基因和蛋白水平的表达,且两者表达变化一致,变化趋势与肿瘤细胞增殖受抑正性相关,与细胞凋亡增加呈负相关。Slusarz等[15]在前列腺癌的研究中发表了相似的研究结果:芹菜素通过降低Hedgehog信号通路中的转录因子GLI1相对表达量来抑制前列腺癌细胞在体外和小鼠体内的生长。
Bcl-2基因是一种抗凋亡因子,参与细胞凋亡。有研究表明芹菜素可通过减少抗凋亡蛋白Bcl-2和促凋亡蛋白Bcl-2相关X蛋白的比值从而诱导脑胶质瘤SHG-44细胞凋亡,使更多的肿瘤细胞阻滞在G2/M期[16]。本研究进一步发现胰腺癌BxPC-3和SW1990细胞经10、20、50 μmol/L芹菜素干预后,肿瘤细胞凋亡比例呈剂量依赖性显著性增加,Bcl-2相对表达量逐渐下降,两者呈负相关。有趣的是,Bcl-2是GLI1基因的下游靶基因,当GLI1被激活后进入细胞核,诱导下游靶基因Bcl-2、PTHC1等的表达,最终致使胰腺肿瘤细胞增殖受抑、细胞凋亡增加。
综上所述,本研究结果提示,芹菜素对胰腺癌细胞增殖的抑制作用和凋亡的诱导作用与下调PTCH1/GLI1/Bcl-2轴有关。

