白细胞介素-23在急性肝损伤模型中调控Kupffer细胞M1型极化的作用机制
华男 方莹 张芳芳 桑建忠
肝脏是人体重要的代谢和消化器官,也是清除肠道源性细菌和内毒素的场所,肝脏的免疫调节功能主要是靠Kupffer细胞起作用的。Kupffer细胞是一种肝脏独有的巨噬细胞[1-2],经脂多糖(LPS)激活可以导致肝脏炎症和全身炎症反应。Kupffer细胞的激活常常受到肠道菌群、微生物代谢物、内毒素等的影响,同时也和肝脏中的肝细胞、星形细胞以及其他免疫细胞有关[3-4]。Kupffer细胞发挥了重要的炎症免疫调节作用,可以发生极化,而极化状态不同可使其起不同的作用,在肝损伤中M1型极化的巨噬细胞主要发挥促炎作用[5-6],且M1型细胞可以由LPS诱导产生,但是其极化的机制以及复杂的诱导因素尚未被完全揭示。
IL-23是一种致炎性的细胞因子,目前已经发现其在银屑病等疾病中表达增高,同时与疾病的发生、发展有关[7-8]。而IL-23在肝损伤中的表达以及作用机制尚未见报道,由于M1型细胞的激活和炎症因子及信号激活有关,因此本文旨在探究IL-23在急性肝损伤模型中调控Kupffer细胞M1型极化的作用机制。
1 材料和方法
1.1 主要试剂 Kupffer细胞购自武汉普诺赛生物技术有限公司;抗IL-23抗体购自美国Abcam公司;佛波酯(PMA)、LPS和重组人 IFN-γ均购自美国 Sigma公司;藻红带白(PE)标记的抗-F4/80抗体(PE-F4/80)、异硫氰酸荧光素(FITC)标记的 CD11c+抗体(FITC-CD11c+)均购自美国Invitrogen Bioscience公司;HE染色试剂盒购自北京索莱宝生物科技技术有限公司;免疫组织化学染色试剂盒购自上海生工有限公司;一氧化氮合酶(iNOS)、TNF-α、IL-6的 ELISA 试剂盒均购自南京建成生物工程研究所;JAK1、STAT1 以及 p-JAK1、p-STAT1 的单克隆抗体(一抗)和辣根过氧化物酶标记的IgG抗体(二抗)均购自美国Abcam公司;四氯化碳购自美国Merck公司;BCA试剂盒及 ECL试剂盒均购自上海碧云天生物技术公司。
1.2 实验用动物 40只雄性8周龄清洁级小鼠[C57BL/6,体质量为(24.54±3.11)g]购自浙江中医药大学动物实验中心,分笼饲养,5只/笼。饲养温度为20~25 ℃,湿度(70±5)%,自由活动、摄食。
1.3 方法
1.3.1 诱导Kupffer细胞分组及M1型极化 取对数生长期Kupffer细胞分为IL-23+anti-IL-23组、IL-23组和对照组,以106个/孔接种到6孔板中,加入200 ng/ml的PMA诱导刺激6 h,之后加入1 μg/ml的LPS和20 ng/ml的IFN-γ进行诱导;IL-23组加入20 ng/ml的IL-23,而IL-23+anti-IL-23组中除了加入20 ng/ml的IL-23外还同时加入20 ng/ml的anti-IL-23,培养24 h。
1.3.2 M1型细胞比例检测 采用流式细胞术。取上述培养细胞,用PBS洗2次,调整细胞浓度为107个/ml,将细胞悬液加入Eppendoff管中,并加入PE-F4/80和FITC-CD11c+标记Kupffer细胞,混匀后避光孵育30 min,PBS洗2次后加入200 μl的Binding缓冲液,上机检测。
1.3.3 Kupffer细胞 iNOS、TNF-α、IL-6水平检测 采用ELISA法。取上述培养细胞,3 000 r/min离心15 min后取上清液,参照试剂盒说明进行操作。
1.3.4 Kupffer细胞 JAK1、p-JAK1、STAT1 及 p-STAT1蛋白表达水平检测 采用Western blot法。取上述培养细胞,NP-40裂解液冰上裂解30 min,收集裂解液离心,采用BCA试剂盒进行蛋白质定量,调整蛋白质浓度后进行SDS-PAGE凝胶电泳,转膜后使用封闭液封闭,加入一抗4℃下孵育过夜,TBST洗2次后,二抗孵育,经过化学发光ECL试剂盒反应后显影,采用Image J软件进行灰度值分析。
1.3.5 急性肝损伤小鼠模型的构建及分组 40只小鼠采用掷骰子随机法分为anti-IL-23组、IL-23组、模型组及对照组。用四氯化碳诱导小鼠构建肝损伤模型[14]。建模后anti-IL-23组小鼠尾静脉先注射50 ng/ml的IL-23 溶液 100 μl,再注射 50 ng/ml的 anti-IL-23 溶液100 μl;IL-23 组小鼠尾静脉注射 50 ng/ml的 IL-23 溶液100 μl;模型组小鼠仅构建肝损伤模型;对照组小鼠不作任何处理。
1.3.6 小鼠肝脏组织中 iNOS、TNF-α、IL-6水平检测 上述处理完24 h后,二氧化碳窒息法法处死4组小鼠,取小鼠外周血,参照ELISA试剂盒说明书进行检测。
1.3.7 小鼠肝脏组织中CD11c+表达水平检测 采用免疫组织化学染色法。取小鼠肝脏组织使用4%的中性多聚甲醛固定,石蜡包埋后连续切片(4 μm),经过脱蜡、内源性过氧化物酶消除、热修复抗原、封闭、CDI68孵育、二氨基联苯胺显色后观察,以PBS代替第一抗体作为阴性对照。
1.3.8 小鼠肝脏组织病理变化检测 取小鼠肝脏组织使用4%的中性多聚甲醛固定,石蜡包埋后连续切片(4 μm),按照HE染色试剂盒操作。
1.3.9 小鼠肝脏组织中 JAK1、p-JAK1、STAT1及 p-STAT1蛋白表达水平检测 采用Western blot法。取小鼠肝脏组织,使用无菌剪剪碎后液氮下研磨至无颗粒状,加入PMSF的NP40细胞裂解液,冰上裂解30 min后,3 000 r/min离心30 min,取上清液,采用BCA试剂盒进行蛋白质定量,调整蛋白质浓度后进行SDS-PAGE凝胶电泳,PVDF转膜后使用封闭液封闭,加入单克隆抗体4℃下孵育过夜,TBST洗2次后,二抗孵育,经过化学发光ECL试剂盒反应后显影,采用Image J软件进行灰度值分析。

2 结果
2.1 3组Kupffer细胞M1型细胞比例比较 结果显示IL-23组中M1型细胞的比例为(12.05±1.32)%,而IL-23+anti-IL-23组中M1细胞的比例为(7.55±1.08)%,对照组中M1型细胞的比例为(8.32±1.32)%,IL-23组明显高于对照组,差异有统计学意义(P<0.05),见图1。
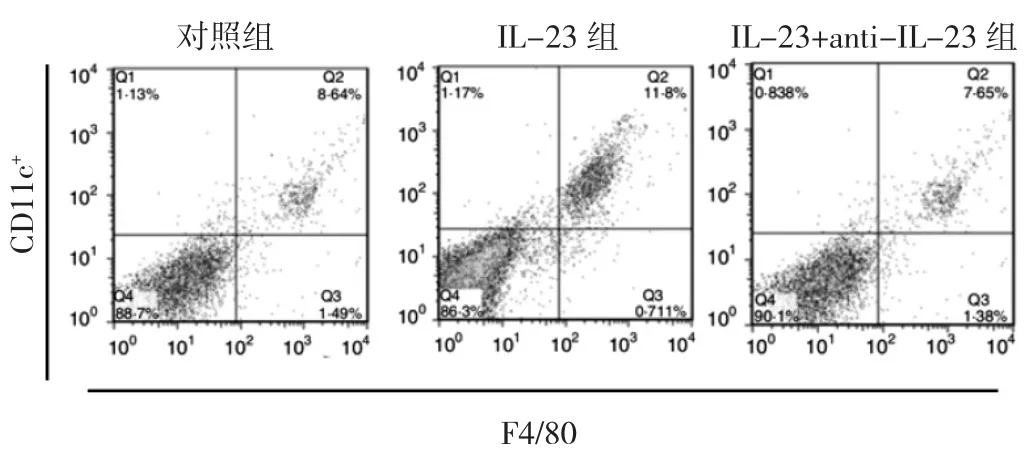
图1 3组Kupffer细胞M1型细胞的流式细胞图
2.2 3 组 Kupffer细胞 iNOS、TNF-α、IL-6 水平比较IL-23组的iNOS、TNF-α、IL-6水平均明显高于对照组,差异均有统计学意义(均P<0.05),而IL-23+anti-IL-23组的iNOS、TNF-α、IL-6水平均明显低于IL-23组,差异均有统计学意义(均P<0.05),见表1。

表1 3组 Kupffer细胞 iNOS、TNF-α、IL-6 水平比较(pg/ml)
2.3 3 组 Kupffer细胞 JAK1、p-JAK1、STAT1 以及 p-STAT1蛋白表达水平比较 IL-23组的JAK1、p-JAK1、STAT1以及p-STAT1蛋白表达水平均明显高于对照组,差异均有统计学意义(P<0.05);而IL-23+anti-IL-23组的JAK1、p-JAK1、STAT1以及p-STAT1蛋白表达水平均明显低于IL-23组,差异均有统计学意义(P<0.05)。见图 2、表 2。
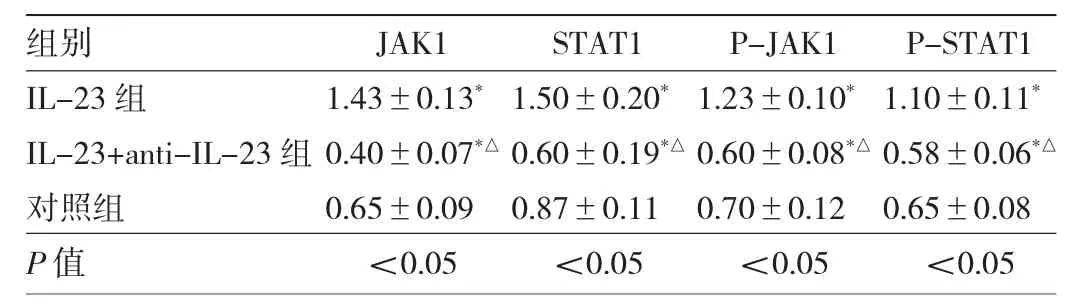
表2 3组Kupffer细胞JAK1、p-JAK1、STAT1以及p-STAT1蛋白表达水平比较
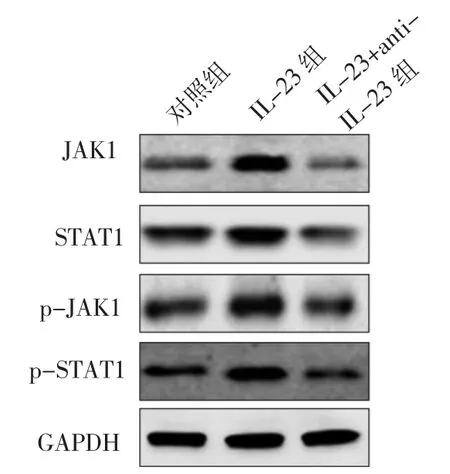
图2 3组 Kupffer细胞 JAK1、p-JAK1、STAT1以及 p-STAT1蛋白表达的电泳图
2.4 4组小鼠肝脏组织中iNOS、TNF-α、IL-6水平比较对照组iNOS、TNF-α、IL-6水平均较其余3组低,差异均有统计学意义(均P<0.05);而模型组iNOS、TNF-α、IL-6水平均较IL-23组、anti-IL-23组低,差异均有统计学意义(P<0.05)。见表3。

表3 4组小鼠肝脏组织中 iNOS、TNF-α、IL-6 水平比较(pg/ml)
2.5 4组小鼠肝脏组织中CD11c+表达情况及肝脏组织病理变化比较 对照组小鼠肝组织中未见CD11c+的表达,而模型组小鼠CD11c+表达明显,IL-23组小鼠CD11c+的表达较模型组更为明显,见图3(插页)。对照组小鼠肝组织无明显损伤,无细胞炎症反应,呈正常生理状态;而模型组小鼠肝组织出现明显的炎症反应和细胞损伤;IL-23组小鼠肝组织损伤较模型组明显;而anti-IL-23组小鼠肝组织损伤较IL-23组减轻,见图4。
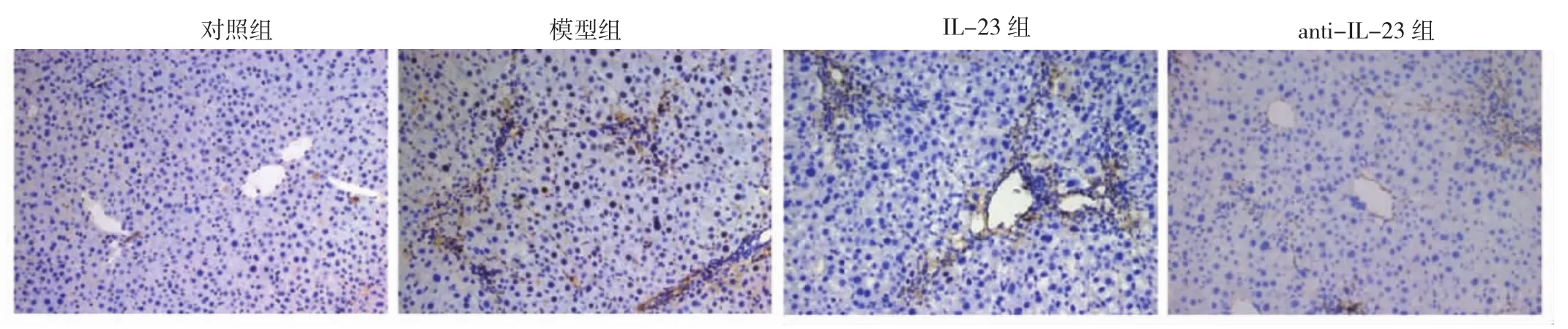
图3 4组小鼠肝组织免疫组织化学染色结果(×200)
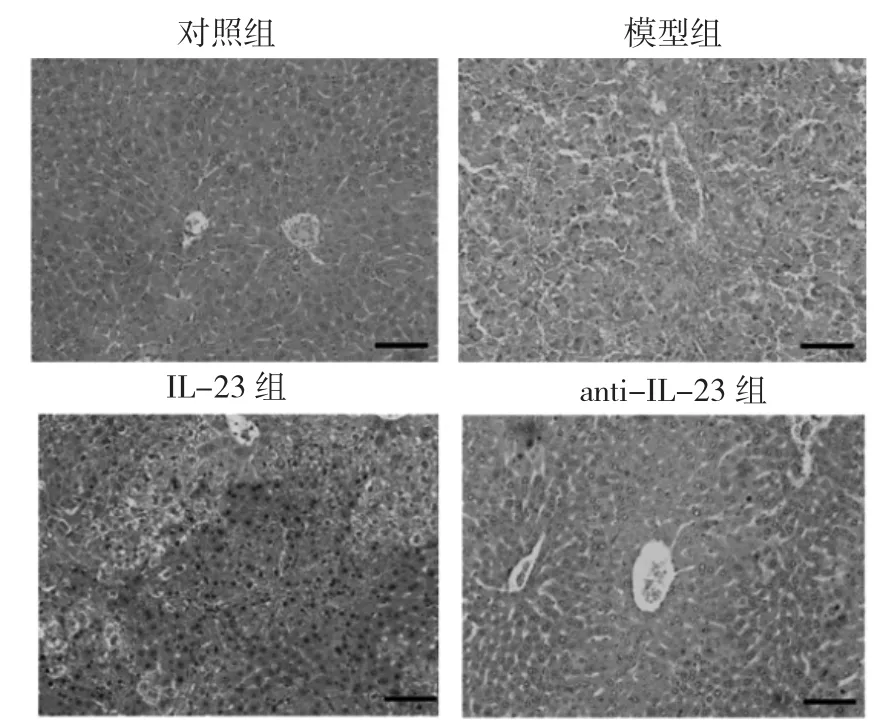
图4 4组小鼠肝组织HE染色结果(×200)
2.6 4组小鼠肝脏组织中JAK1、p-JAK1、STAT1及p-STAT1蛋白表达水平比较 与对照组比较,IL-23组、模型组JAK1、p-JAK1、STAT1及p-STAT1蛋白表达水平均明显升高,差异均有统计学意义(均P<0.05);anti-IL-23 组、IL-23 组 JAK1、p-JAK1、STAT1 及 p-STAT1蛋白表达水平与模型组比较差异均有统计学意义(均 P<0.05)。见图5、表4。
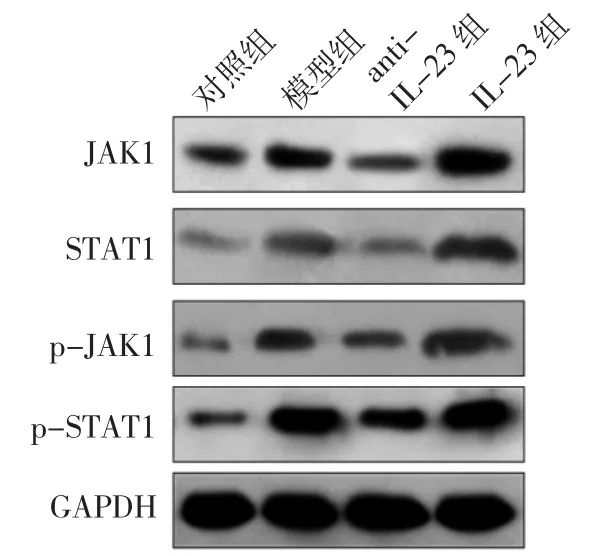
图5 4组小鼠肝脏组织中JAK1、p-JAK1、STAT1及p-STAT1蛋白表达的电泳图
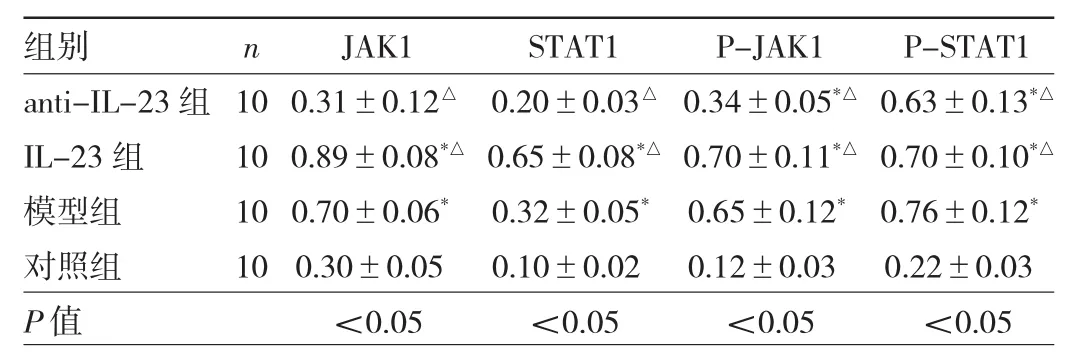
表4 4组小鼠肝脏组织中JAK1、p-JAK1、STAT1及p-STAT1蛋白表达水平比较
3 讨论
肝损伤是一种发病机制较为复杂的肝脏疾病。Kupffer细胞组成单核-巨噬细胞系统的一群特殊细胞,在肝脏免疫中发挥着重要的作用。肝脏微环境是由肝细胞、基质细胞以及免疫细胞组成的[9-10],Kupffer细胞主要来源于血液中的单核细胞,在不同细胞因子刺激下形成不同的亚型。M1型细胞是由IFN-γ、LPS刺激形成的,可以分泌IL-1、IL-6、IL-12等[11-12]。M1型具有较高的抗原提呈能力,可激活免疫反应,保护机体免受感染,所以M1型细胞也被称为是促炎的Kupffer细胞。目前也有研究发现M1型Kupffer细胞在多种肝脏炎症反应中发挥着重要的作用[13-14]。而M2型可以被IL-4、IL-10等刺激形成,其高表达CD163和CD206,具有抑制免疫应答、促进肿瘤血管生成、诱导组织重构等作用,同时可发挥抑制炎症反应的作用。
M1型细胞在肝损伤中起到重要的作用,而前期研究也发现IL-17A参与了M1型细胞的激活,在非酒精性脂肪性肝病中发挥着重要的作用[15]。IL-23也是一种重要的炎症因子,已有的研究发现在乙型肝炎患者中Th17细胞比例上调,同时IL-23和IL-6水平上调,且炎症因子和ALT、AST的表达呈正相关[16],说明IL-23与肝炎的进程有关,但其确切的机制未明。为了进一步明确其机制,本研究采用LPS+PMA+IFN-γ诱导Kupffer细胞M1极化,同时添加IL-23观察其对于M1细胞极化的影响,LPS+PMA+IFN-γ是经典的诱导巨噬细胞极化的方法,结果显示在此基础上添加IL-23可以协同刺激Kupffer细胞的极化,这种变化是明显的,而进一步添加anti-IL-23抗体后这种作用被抑制,说明IL-23确实促进了M1极化。JAK1-STAT1信号是M1极化的经典信号。本研究结果证明,IL-23刺激了JAK1和STAT1的磷酸化,进一步调控了信号的激活,同时可以提高M1型细胞标志物iNOS、TNF-α、IL-6的表达。为了明确其在组织中的作用,采用四氯化碳诱导小鼠急性肝损伤,在此基础上利用重组IL-23进行干预,结果证明IL-23可以进一步促进肝组织中M1型细胞的极化,同时增强了细胞组织的炎症反应,而添加anti-IL-23后可以抑制这种变化,其机制同样和JAK1-STAT1的激活有关。
综上所述,本研究结果证明,IL-23可以通过促进Kupffer细胞M1极化增强肝脏炎症性损伤。

