错配修复蛋白缺失相关子宫内膜癌的病理特征及其临床意义
邓茜 雷琼 李璐 高尤亮 俞文英 严俊龙 郭亚男 郑时玉 李海莉 蒙伶俐 卢立霞 李征 夏朝霞
Lynch综合征即遗传性非息肉性结直肠癌(hereditary non-polyposis colorec-tal cancer,HNPCC)属于常染色体显性遗传病。人体碱基错配修复(mismatch repair,MMR)基因胚系突变后可导致遗传不稳定性,引起广泛的肿瘤易感性。其中女性Lynch综合征患者最常发生的是卵巢癌和子宫内膜癌(endometrial cancer,EC)[1],一部分女性Lynch综合征患者以EC为首发肿瘤,因此在EC患者中筛查Lynch综合征是可行且必要的。Lynch综合征确诊需依靠费用昂贵的二代测序(next generation sequencing,NGS)检测MMR基因胚系突变,无法进行大规模普筛工作,而日常工作中使用的免疫组化检测MMR蛋白的方法经济快捷,是初步筛查Lynch综合征的有效手段[2]。目前国内有关MMR蛋白缺陷相关子宫内膜癌(MMR protein deletion-related endometrial carcinoma,dMMR-EC)的研究较少,因此本研究旨在探讨dMMR-EC患者的临床病理特征及其临床意义,以便指导临床工作中初步筛查Lynch综合征患者,进而指导下一步的治疗方法和疾病管理。
1 对象和方法
1.1 对象 选取2014年6月至2017年6月宁波市临床病理诊断中心诊断的EC患者294例,年龄28~86(56.4±9.4)岁。纳入的EC组织学类型有:子宫内膜样癌、浆液性癌、透明细胞癌、混合性腺癌、子宫癌肉瘤、未分化癌和去分化癌。组织学类型不包括中肾腺癌、中肾样腺癌、鳞状细胞癌、胃肠型黏液腺癌、转移性癌以及宫颈腺癌累及宫体等。本研究经本中心医学伦理委员会批准,所有患者均知情同意。
1.2 病理检查 复阅所有患者经HE染色后的组织切片,观察肿瘤组织形态学特征、组织学类型、肌层浸润情况、淋巴结转移情况、组织学分级分期[按国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)标准执行]等临床病理学特征。
1.3 免疫组化检测及其抗体信息 所有标本均经10%中性甲醛溶液固定、脱水、包埋、4 μm切片。免疫组化采用Ventana Benchmark XT自动免疫组化仪(美国Ventana公司)染色。一抗:鼠抗人单克隆抗体MLHl(克隆号:ES05)和兔抗人单克隆抗体MSH2(克隆号:RED2)均购自福州迈新生物技术开发有限公司,兔抗人单克隆抗体MSH6(克隆号:EP49)购自北京中杉金桥生物技术开发有限公司,兔抗人单克隆抗体PMS2(克隆号:EP51)购自河南赛诺特生物技术开发有限公司。以每张切片中淋巴细胞、纤维间质细胞或癌旁子宫内膜腺体的胞核阳性为阳性内对照,阴性内对照使用PBS代替一抗。
1.4 二代测序及其主要试剂盒、仪器 每例需进行二代测序的患者均挑取一个含癌组织的蜡块,切成蜡卷,采用QIAamp DNA FFPE Tissue提取试剂盒(德国QIAGEN公司)提取组织内DNA后使用二代测序仪(型号:Hiseq 4000,美国Illumina公司)进行MMR基因的二代测序检测,DNA capture probes购自南京世和基因生物技术有限公司。
1.5 结果判读 MMR蛋白(包括MLH1、PMS2、MSH2和MSH6)在任何肿瘤细胞核明确着色即判定为阳性(如图 1、2、4、5,插页)[3];所有肿瘤细胞核均不着色时即为阴性(如图3、6,插页)。间质淋巴细胞、纤维组织细胞及癌旁子宫内膜腺体均可作为阳性内对照,有助于分辨假阳性或假阴性。
图1 子宫内膜样癌病理切片所见(HE染色,×100)

图2 子宫内膜样癌中MLH1阳性表达(周围纤维间质细胞或淋巴细胞阳性表达,阳性内对照;免疫组化染色,×100)

图3 子宫内膜样癌中MSH6阴性表达(周围纤维间质细胞或淋巴细胞阳性表达,阳性内对照;免疫组化染色,×100)

图4 子宫内膜透明细胞癌病理切片所见(HE染色,×100)

图5 透明细胞癌中MSH2阳性表达(周围癌旁子宫内膜腺体阳性表达,阳性内对照;免疫组化染色,×100)

图6 透明细胞癌中PMS2阴性表达(周围癌旁子宫内膜腺体阳性表达,阳性内对照;免疫组化染色,×100)
1.6 统计学处理 采用SPSS 20.0统计软件。计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料 294例EC石蜡包埋标本中,诊断学刮宫(以下简称诊刮)标本22例,其余272例中有57例未清扫盆腔淋巴结,另外215例为EC根治标本。患者年龄<50岁者72例,≥50岁者222例。组织学类型如下:子宫内膜样癌242例,平均年龄54.7岁;Ⅱ型EC有43例,其中透明细胞癌12例(平均年龄70.7岁),浆液性癌23例(平均年龄64.7岁),癌肉瘤8例(平均年龄59.6岁);Ⅰ型和Ⅱ型混合性腺癌2例(平均年龄56.5岁);去分化癌5例(平均年龄57.4岁);未分化癌2例(平均年龄55.5岁)。242例子宫内膜样癌中不同FIGO分级占比分别为:Ⅰ级144例(59.5%),平均年龄52.5岁;Ⅱ级76例(31.4%),平均年龄57.1岁;Ⅲ级22例(9.1%),平均年龄61.0岁。FIGO分期:175例Ⅰ型子宫内膜样癌根治标本中Ⅰ期137例(78.3%),Ⅱ期25例(14.3%),Ⅲ期13例(7.4%),Ⅳ期0例(0.0%)。23例浆液性癌中18例为根治标本,FIGO分期分别为Ⅰ期10例,Ⅱ期2例,Ⅲ期6例,Ⅳ期0例。12例透明细胞癌中10例为根治标本,FIGO分期为Ⅰ期5例,Ⅱ期3例,Ⅲ期2例,Ⅳ期0例。8例癌肉瘤中6例为根治标本,FIGO分期Ⅰ期4例,Ⅱ期0例,Ⅲ期2例,Ⅳ期0例。5例去分化EC中,4例非诊刮标本FIGO分期Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期者分别各占1例。2例未分化癌均为根治标本,FIGO分期分别为Ⅰ期和Ⅱ期。混合型癌2例其中1例为根治标本,FIGO分期为Ⅰ期。
2.2 MMR蛋白表达情况 294例EC患者中,62例出现MMR蛋白的阴性表达,即为dMMR-EC患者,其余232例MMR蛋白阳性表达。多种组织学类型的EC均可出现MMR蛋白阴性表达(MMR阴性例数/总例数):子宫内膜样癌(53/242)、透明细胞癌(1/12)、浆液性癌(2/23)、混合性腺癌(1/2)、癌肉瘤(2/8)、未分化癌(1/2)及去分化癌(2/5)。62例MMR蛋白阴性表达的EC患者可以出现特定组合内的单个MMR蛋白阴性表达,也可以出现特定组合内的2个MMR蛋白共同阴性表达,但未出现两个特定组合内的蛋白均阴性表达或交叉阴性表达的现象。本组研究62例dMMR-EC(阴性率21.1%)中,MLH1和(或)PMS2阴性表达40例(阴性率13.6%),MSH2和(或)MSH6阴性表达22例(阴性率7.5%)。
2.3 MMR基因二代测序结果 由于经费限制,本研究从62例dMMR-EC患者中按分层随机的方法挑选出21例进行二代测序检测MMR基因表达频谱,进行免疫组化结果的验证,结果21例dMMR-EC患者中有18例肿瘤组织内检测出MMR基因突变,其中10例MSH2和(或)MSH6蛋白阴性组织均出现MMR基因突变,11例MLH1和(或)PMS2蛋白阴性组织中有6例出现MMR基因突变,如图7(插页)。
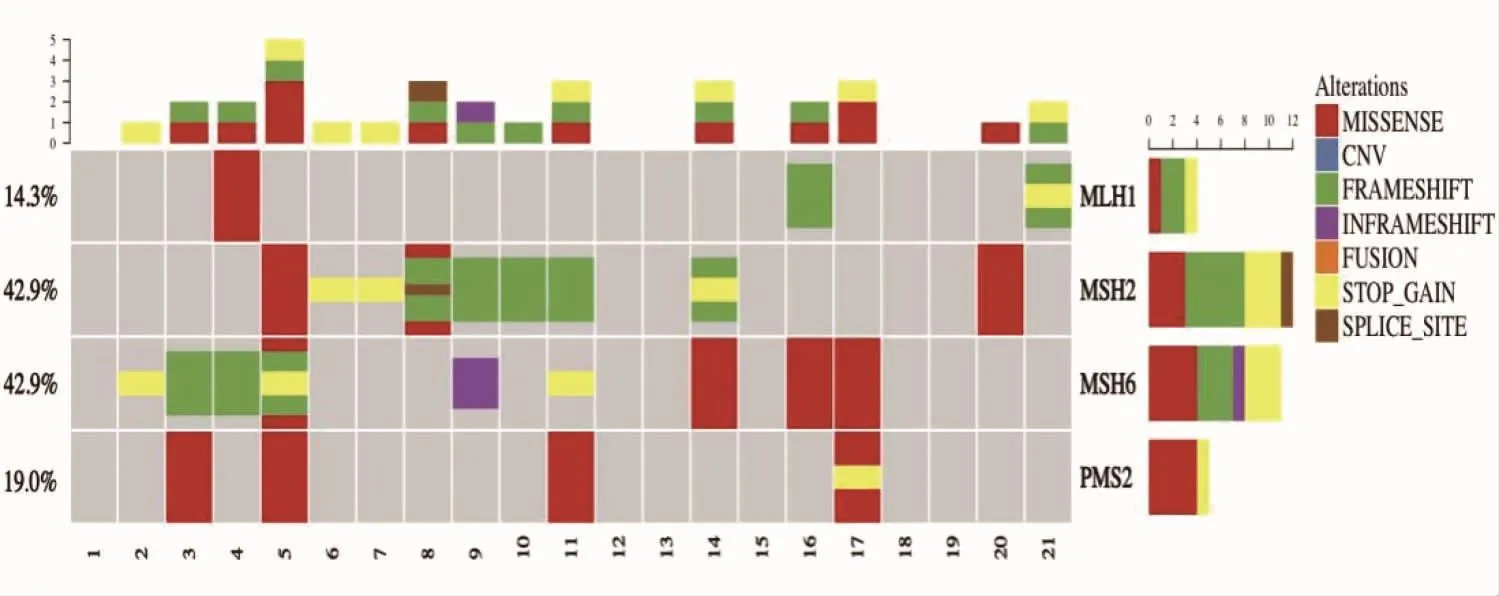
图7 21例dMMR-EC二代测序MMR基因表达频谱(dMMR-EC为错配修复蛋白缺失相关子宫内膜癌;MMR为错配修复)
2.4 MMR蛋白阴性率与患者临床病理特征的关系MMR蛋白阴性率与年龄、组织学类型、非诊刮标本肌层浸润深度、根治标本淋巴结转移情况、FIGO分级和分期均无相关性(均P>0.05)。而非Ⅱ型高级别EC患者MMR蛋白阴性率明显高于Ⅱ型高级别EC患者MMR蛋白阴性率,差异有统计学意义(P<0.05)。见表1。

表1 MMR蛋白阴性率与EC患者临床病理特征的关系[例(%)]
2.5 随访结果 62例dMMR-EC患者均进行电话随访,随访时间25~62个月,有效随访52例,其中无病生存49例,远处转移2例(随访时间分别为40和34个月),病死1例(随访时间为60个月);失访10例。
3 讨论
人类MMR基因可以识别和修复DNA复制和重组过程中发生的错误性碱基插入、缺失和一部分DNA损伤,保证DNA高保真复制,维持染色体的稳定性[4]。MMR基因缺陷细胞的碱基突变率是正常碱基10到1 000倍[5]。目前研究较多的MMR基因类型主要是MLH1、PMS2、MSH2 和 MSH6[6]。
MMR基因缺陷有两种情况,一种是可遗传的种系或胚系突变,常常导致Lynch综合征;另一种就是不可遗传的体细胞或肿瘤细胞突变。筛查dMMR-EC对识别高复发风险[7-8]或遗传性EC患者(如Lynch综合征)有帮助[8-9]。
Lynch综合征是MMR基因发生种系或胚系突变所致的一种常染色体显性遗传性疾病,表现为多系统多器官肿瘤易感性(多种组织癌变概率大大增加,如胃、女性生殖道、胆道、尿道、小肠、大脑和胰腺等)。女性Lynch征患者最常发生的肿瘤是卵巢癌和EC[1],一部分Lynch综合征患者以EC为首发肿瘤。因此,在EC患者中开展Lynch综合征筛查是可行而必要的,便于及时发现和预防患者Lynch综合征相关的其他肿瘤的发生。此外,Lynch综合征亲属也可以尽早进行遗传咨询及基因检测,预防发生Lynch综合征相关肿瘤。
免疫组化检测MMR蛋白的表达是筛查Lynch综合征相关肿瘤的有效方法,已经普遍应用于筛查Lynch综合征相关结直肠癌患者的工作流程[2],近年来Lynch综合征相关EC(Lynch syndrome-related endometrial cancer,Lynch-EC)备受关注,Scnter等和 Frolova 等[10-11]的研究显示与MMR基因检测结果比较,免疫组化法检测MMR蛋白的灵敏度、特异度分别为0.91、0.88,因此推荐将免疫组化检测MMR蛋白作为Lynch-EC的初筛手段。近年来,就Lynch-EC的具体筛查方案、临床病理学特征、治疗及预后等是研究热点[12-15]。因此,本研究通过免疫组化检测MMR蛋白的表达初步筛查Lynch-EC展开相关研究。
本组研究中294例EC患者的MMR蛋白阴性率为21.1%(62/294),其中 MLH1和(或)PMS2蛋白阴性率13.6%(40/294),MSH2和(或)MSH6蛋白阴性率 7.5%(22/294),MMR蛋白阴性率在大多数国内外研究报道的范围内,但略低于某些国外报道的45%[16],有可能是筛查种群及地域不一样所致。此外,本研究结果表明多种组织学类型的EC,包括子宫内膜样癌、透明细胞癌、浆液性癌、混合性腺癌、癌肉瘤、未分化癌及去分化癌等均可出现MMR蛋白阴性表达。除此以外,不论患者年龄是否<50岁、肿瘤浸润肌层是否>1/2、是否具有淋巴结转移以及FIGO分级分期程度,MMR蛋白阴性率均无统计学差异。此结果支持推荐所有初次确诊的EC均进行MMR蛋白检测以达到Lynch-EC初筛的目的。这一结论与国内外主流观点基本一致[17],但Ruiz等[18]的研究表明MMR蛋白阴性病例更常见于浸润深度<1/2肌层的病例,而Long等[19]的研究报道MMR蛋白阴性病例具有更深的肌层浸润,可能是研究对象地域不同所致,也可能数据量有限,这需要大数量级数据进一步研究。此外,Pina等[20]研究报道显示,组织学类型为去分化EC更容易出现出现MMR蛋白阴性,而本研究入组的去分化EC患者例数较少,难以进行统计学分析,因此,有待收集更多的病例进一步研究。
国内外多项研究均进行了低级别EC和高级别EC中MMR阴性率的比较,结果它们的阴性率比较差异均无统计学意义,本研究结果跟上述结果一致,但本研究进一步把高级别EC分成Ⅱ型癌和非Ⅱ型癌两组,统计学分析后发现非Ⅱ型高级别EC患者MMR蛋白阴性率(35.5%,11/31)高于Ⅱ型高级别EC患者的(11.6%,5/43),也就是说,组织学类型为非Ⅱ型高级别的EC时应作为Lynch-EC的重点筛查对象,应特别注意是否有MMR蛋白阴性,并进一步明确是否为Lynch-EC。
2013年,美国癌症基因组图谱提出将EC区分为DNA聚合酶ε(POLE)突变型、微卫星不稳定(microsatellite Instability,MSI)高突变型、高拷贝数型和低拷贝数型4种分子亚型[21]。2015年Talhouk等[22]使用免疫组化替代基因分型的方案,证明基于免疫组化检测MMR蛋白筛选MSI高突变型EC是可行的。2020年,EC的分子分型以及基于免疫组化的分子分型方案被正式写入第5版《WHO女性生殖肿瘤分类》中并且指出这4种分子分型中POLE突变型和MSI高突变型预后最好,其次为低拷贝数型,而高拷贝数型预后最差。本研究筛选的62例dMMR-EC基本可等同于MSI高突变型EC,预后相对较好,随访资料与此相符。对部分dMMR-EC(21例)进行的基因水平的验证,结果21例dMMR-EC中16例出现对应MMR基因突变(16/21,76.2%),其中10例MSH2和/或MSH6蛋白阴性的病例NGS结果均出现对应的基因突变(10/10,100.0%),11例 MLH1和/或 PMS2蛋白阴性的病例6例NGS结果出现对应的基因突变(6/11,54.5%),说明MSH2和/或MSH6的免疫组化与NGS基因检测结果的一致性优于MLH1和(或)PMS2的。
众多研究表明MMR缺失的多种肿瘤(包括dMMREC)受益于程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)单抗的治疗。2015 年,Le 等[23]的研 究 显示PD-1单抗pembrolizumab对MMR缺陷型肿瘤的治疗作用明显高于MMR正常表达的肿瘤。2017年,Le等[24]研究发现12种MMR缺陷型肿瘤的86例晚期患者使用pembrolizumab治疗后,57%的患者出现影像学层面的病情缓解,21%的患者获得完全缓解。2017年6月,美国临床肿瘤协会推荐PD-1单抗治疗EC尤其是dMMR-EC患者[25]。因此,临床工作中筛查出dMMR-EC患者对其进一步的治疗具有一定的指导意义,这一点在一些需要术后辅助治疗的高级别EC中显得尤其重要。这也是本研究的意义之一:把高级别EC里的dMMR-EC用免疫组化筛选出,可以个体化制定有效的治疗方案。
综上所述,本研究通过免疫组化检测EC中MMR蛋白的表达,分析EC组织中MMR蛋白阴性率与其临床病理特征的相关性,指出推荐所有初次确诊的EC患者进行免疫组化检测MMR蛋白的表达,进行Lynch-EC初筛,其中非Ⅱ型高级别EC是重点筛查对象。本研究进一步讨论了在实际临床工作中使用免疫组化检测EC组织中 MMR蛋白的表达意义:(1)有助于开展Lynch-EC的初筛工作,对预防Lynch-EC患者本人再次发生或家族其他成员发生Lynch综合征相关的肿瘤有一定意义;(2)有助于将预后不同的高级别EC进行分组,并指导相应的药物治疗(如可受益于PD-1单抗治疗),利于高级别EC的疾病管理。

