优化CD45免疫磁珠阴性筛选法提高循环肿瘤细胞富集效率的实验研究
蒋来 刘勇 杨立涛
结直肠癌(colorectal cancer,CRC)发病率位居世界恶性肿瘤的第三位,其中美国、欧洲和东亚地区人群发病率较高[1]。对于局部晚期和转移性CRC患者,虽然采取多学科综合治疗,但仍有近1/3的患者死于肿瘤转移和疾病进展[2]。随着转移性肿瘤细胞的检测技术和平台的开发,肿瘤细胞液体活检技术逐步用于临床,以提高转移病灶的检出率和治疗成功率[3]。在液体活检计数中,作为主要成分的循环肿瘤细胞(circulating tumor cell,CTC)可携带外周血液循环中活肿瘤细胞的生物信息,有助于转移病灶的临床治疗。由于肿瘤患者外周血中CTC含量极低,临床上如何提高CTC的富集效率仍具有较高的技术挑战性[4-5]。上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)、细胞角蛋白(cytokeratin,CK)广泛表达于多数上皮来源的恶性肿瘤,常作为富集CTC的主要标志物[6-7]。虽然肿瘤生物标志物在肿瘤细胞中具有较好的特异性,但由于富集过程中肿瘤细胞易丢失,导致CTC的富集效率较低。在CTC的阴性富集过程中,CD45+白细胞的去除是关键步骤,该步骤通过抗体结合和磁场分离电荷将白细胞从提取液中移除,留下带有肿瘤细胞的溶液[8]。根据笔者前期CTC富集结果和实验操作,发现部分CD45-的肿瘤细胞被磁场中白细胞团块包绕并锁定在试管壁上,同时与白细胞一起被移除,导致肿瘤细胞的富集效率低下。为提高富集效率,笔者在实验中将本该与白细胞一起移除的试管进行再次洗脱和磁场分选,从而将白细胞团块包绕的肿瘤细胞提取出来,以提高CTC的富集效率。为了验证假设,笔者将生长良好的SW620细胞按照不同的细胞数量加入健康献血者的血液以模拟CTC,采用设计的优化方案富集肿瘤细胞,并与常规方案进行比较,以评估优化方案的富集效率。
1 材料和方法
1.1 细胞与材料 SW620细胞为EpCAM+/CK+/CD45-人结肠癌细胞,购自ATCC细胞库。RBC裂解缓冲液(规格:10 ml,型号:Cat-20120)、CD45 混合物(规格:50 μl/ml,型号:Cat-18259)、免疫磁珠(规格:100 μl/ml,型号:Cat-18259)均购自加拿大Stem Cell公司;EpCAM抗体(规格:20 μl,型号:347199)及其同型对照(规格:20 μl,型号:347221)、PE 偶联的 CK 抗体(规格:20 μl,型号:347204)及其同型对照(规格:20 μl,型号:555574)均购自美国BD公司。
1.2 CTC模拟 将SW620细胞加入健康献血者的血液中,以模拟CTC和患者血液。首先采集健康献血者外周血约5 ml于肝素真空管中,室温下储存于恒温培养箱中。同时将稳定生长的SW620细胞打散后用血细胞计数仪计数,使每1 ml PBS中含有50、75、100、150个SW620细胞。然后将5 ml健康献血者血样缓慢加入20 ml 1×RBC裂解缓冲液中,再加入一定量的SW620细胞(50、75、100和150个细胞)。常规孵育和离心后,去除裂解的红细胞,收集细胞悬液(白细胞和肿瘤细胞),计数细胞后进一步去除CD45+白细胞。
1.3 富集方案 (1)常规方案:使用人CD45去除试剂盒(包括CD45混合物和免疫磁珠结合白细胞)[9]。将带有细胞悬液的试管放入磁铁中,CD45+白细胞在磁场作用下可贴于试管壁,细胞悬液中剩下CD45-肿瘤细胞;将含CD45-肿瘤细胞的上清液移入流式细胞管中,使用流式细胞仪进行肿瘤细胞分选和细胞计数。(2)优化方案:对含有贴壁CD45+白细胞的试管重新进行冲洗和磁场作用,以洗脱被白细胞包绕和贴壁的肿瘤细胞,对其重新进行富集,见图1。

图1 常规方案和优化方案(第2次免疫磁珠阴性富集)进行CTC富集图示(CTC为循环肿瘤细胞)
1.4 常规方案正常剂量与高剂量CD45混合物+免疫磁珠富集SW620细胞效率验证 去除白细胞时,分别加入正常剂量的 CD45混合物(50 μl/ml)+免疫磁珠(100 μl/ml)、高剂量的 CD45 混合物(62.5 μl/ml)+免疫磁珠(125 μl/ml),对 CD45+白细胞进行结合和分离,以验证CD45混合物和免疫磁珠是否可以通过结合更多的白细胞和包绕更多的CD45-肿瘤细胞来降低肿瘤细胞富集效率的假设。
1.5 SW620细胞富集效率检测 采用EpCAM和CK双抗体染色、流式细胞术进行分选和计数。去除CD45+白细胞后,使用EpCAM抗体及其同型对照进行表面细胞膜染色,然后使用PE偶联的CK抗体15 μl进行细胞内染色;取细胞悬液,采用流式细胞术进行分选和计数。SW620细胞富集效率=富集细胞个数/加入的SW620细胞数×100%。
2 结果
2.1 常规方案正常剂量与高剂量CD45混合物+免疫磁珠富集SW620细胞效率比较 在常规方案中,正常剂量CD45混合物+免疫磁珠富集SW620细胞的平均效率为65.5%,高于高剂量CD45混合物+免疫磁珠富集SW620细胞的平均效率58.3%,见表1。这证实CD45混合物和免疫磁珠可以通过结合更多的白细胞和包绕更多的CD45-肿瘤细胞来降低肿瘤细胞富集效率。
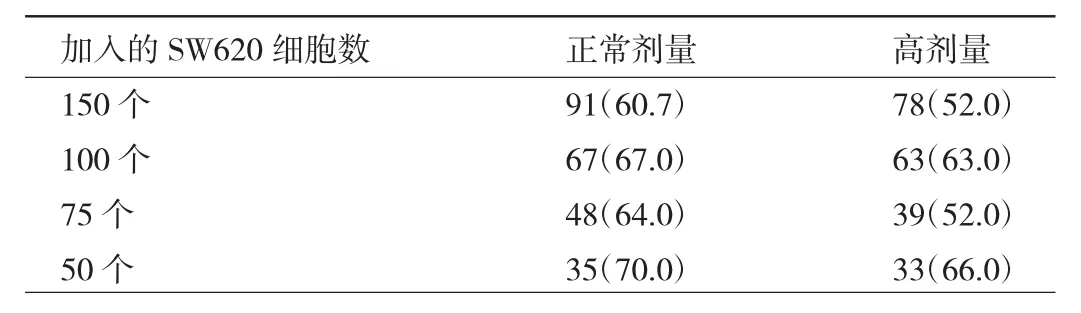
表1 正常剂量与高剂量CD45混合物+免疫磁珠富集SW620细胞效率比较[个(%)]
2.2 常规方案与优化方案富集SW620细胞效率比较 采用优化方案富集SW620细胞的平均效率为82.8%,高于常规方案富集SW620细胞的平均效率61.9%,见表2和图2(插页)。
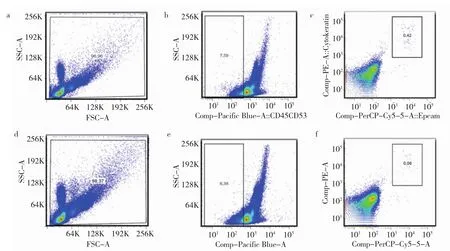
图2 常规方案与优化方案对150个SW620细胞富集效率的流式细胞术检测结果(a-c:采用常规方案,分别显示总细胞、CD45-细胞、CK+EpCAM+细胞数目为 287 535、21 815、91个;d-f:采用优化方案,分别显示总细胞、CD45-细胞、CK+EpCAM+细胞数目为 718 072、60 208、35个;CK为细胞角蛋白;EpCAM为上皮细胞黏附分子)
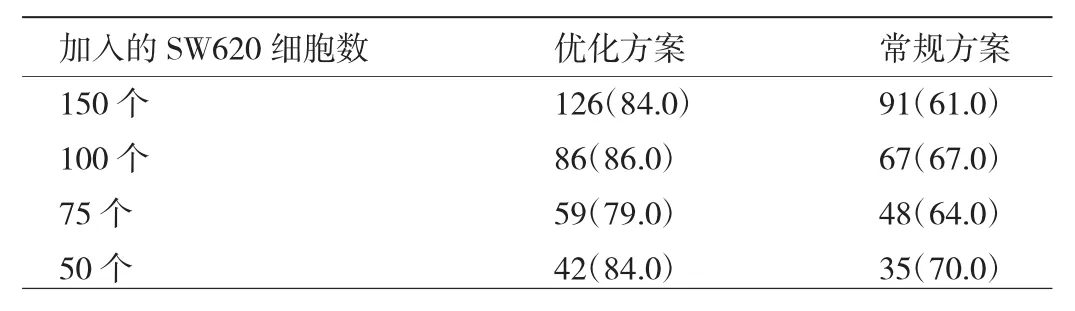
表2 常规方案与优化方案富集SW620细胞效率比较[个(%)]
3 讨论
CRC是一种常见的消化道恶性肿瘤,疾病相关死亡率与肿瘤转移密切相关。CTC是肿瘤转移的重要途经和步骤,但CTC的精准分选和有效富集是CTC检测的重要障碍,主要原因是缺乏特异性的CTC生物标志物以及CTC富集过程中肿瘤细胞的丢失[10]。CTC富集的典型过程包括红细胞溶解、白细胞去除(阴性筛选)和CTC捕获(阳性选择)[11]。为了更好地分离和鉴定CTC,需要用CD45去除白细胞,然后采用荧光抗体染色方法从血液样本中捕获CTC,上皮性肿瘤标志物(EpCAM、CK)因其在肿瘤细胞表达但在白细胞中表达缺失而被用于CTC的捕获[12]。EpCAM、CK在大多数肿瘤细胞中高表达,在白细胞中不表达,因此常用于CTC的富集和捕获[13]。CTC阳性富集容易丢失部分有价值但不表达上皮性肿瘤标志物的CTC,而CTC阴性富集可以通过去除CD45+白细胞而富集CD45-的CTC,将不表达上皮性肿瘤标志物的CTC加以富集,从而提高CTC的富集效率[14]。CTC阴性富集也有不足,即在去除CD45+白细胞的操作步骤中易丢失部分CTC,导致CTC富集效率不高。因此,本文从CTC阴性富集过程中的CTC丢失入手,通过优化CTC富集流程,以提高CTC富集效率。
在多个CTC富集步骤中,白细胞去除是可以优化的步骤,因为数百万个CD45+白细胞在磁场作用下贴附于试管壁,这同时也会将部分肿瘤细胞加以包绕和贴附,使这些肿瘤细胞与CD45+白细胞一起被移除,导致其无法进入下一步的细胞分选和计数过程[15]。因此,笔者认为对此步骤加以优化,可以有效提高CTC的富集效率。首先,本研究比较了正常剂量与高剂量CD45混合物+免疫磁珠富集SW620细胞的效率,两组按正常CTC富集方案进行CD45+白细胞的移除,然后对附在试管壁的白细胞和肿瘤细胞用PBS进行洗脱和第二轮CD45+白细胞移除,结果显示正常剂量CD45混合物+免疫磁珠富集SW620细胞的平均效率(65.5%)高于高剂量组(58.3%),提示高剂量CD45混合物和免疫磁珠在CD45+白细胞移除阶段可以包绕更多的肿瘤细胞,使CTC富集数量减少。这验证了笔者的假设:在CD45+白细胞移除步骤中,肿瘤细胞被贴壁的白细胞固定于试管壁,被当作阴性对照导致丢失,使得阴性筛选的富集效率不高。因此本研究优化富集方案,对贴壁细胞进行洗脱和重新富集,结果显示优化方案富集SW620细胞的平均效率(82.8%)高于常规方案(61.9%)。
综上所述,优化CD45免疫磁珠阴性筛选法(对含有贴壁CD45+白细胞的试管再次洗脱和磁场分选)能提高CTC富集效率,具有较好的临床应用价值。但今后仍需精准的、大样本的临床试验来验证,使富集CTC的实验方案更加完善。

