新疆昌吉地区某规模化猪场不同日龄猪源粪肠球菌耐药性及耐药基因分析
陈万昭,轩慧勇,宋超慧,王 东,徐琦琦,秦 蕾,夏利宁
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
肠球菌属是人、犬、禽、猪、马等动物胃肠道中常在菌群之一,也是条件致病菌,广泛分布于土壤、水和食物中[1]。肠球菌属有50余种,而粪肠球菌和屎肠球菌可占分离株的80.0%以上[2]。近年来,随着肠球菌对抗菌药物的耐药性增加,导致肠球菌感染治疗失败[3],而粪肠球菌亦成为全球范围流行的第三大院内感染病原菌[4]。
肠球菌耐药机制复杂,对克林霉素、头孢类抗菌药物具有固有耐药[5],此外它还具有显著的基因组可塑性,利用质粒、转座子和插入序列高效获取和转移可移动抗性元件[3],所以肠球菌可以作为肠道中其他致病菌耐药基因的“蓄水池”,促进耐药性的传播[6]。
规模化猪场由于耐药导致的治疗失败,不仅影响养殖场经济收益,还危害人类健康。此外,猪不同日龄的生理情况与饲养条件不同,使用抗菌药物的几率也不同,所以针对不同日龄合理使用抗菌药物,药效更佳,同时也有助于降低细菌的耐药性。因此,本研究通过对新疆昌吉地区某规模化猪场不同日龄粪肠球菌进行耐药性调查以及相关耐药基因检测,旨在了解该猪场不同日龄粪肠球菌耐药现状及耐药基因携带情况,为不同日龄粪肠球菌临床用药提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株 2019年11月11日-12日,在新疆昌吉地区某规模化猪场采集不同生长阶段猪肛拭子样品共计262份(其中育肥猪103份、妊娠猪65份、保育猪55份、后备猪39份)。标准质控粪肠球菌ATCC29212与金黄色葡萄球ATCC29213,杭州天和微生物试剂有限公司产品。
1.1.2 主要试剂和培养基 脑浸出液(BHI)肉汤培养基,北京奥博星生物技术有限公司产品;MH肉汤、肠球菌选择培养基(胆汁七叶苷叠氮钠琼脂),青岛海博生物技术有限公司产品;尿道菌群定位显色培养基,法国科玛嘉产品;1×TE缓冲液,生工生物工程(上海)股份有限公司产品;2×TaqPCR MasterMix,DL 2 000 DNA Maker,天根生化科技(北京)有限公司产品。
1.1.3 仪器设备 伯乐T100梯度PCR仪,伯乐生命医学产品(上海)有限公司产品;恒温培养箱,恒温培养摇床,上海一恒科学仪器有限公司产品;电泳仪,电泳槽,北京六一生物科技有限公司产品。
1.2 方法
1.2.1 细菌分离鉴定 用灭菌棉签沾取猪只肛门内新鲜粪便,放入装有1 mL MH肉汤的EP管中。吸取10 μL MH肉汤中的样品至1 mL 65 mg/mL氯化钠BHI肉汤中,过夜培养后将增菌液划线接种于肠球菌选择培养基平板上,37 ℃培养16 h~20 h后,挑取白色圆滑、凸起、大小适中且菌落周围显黑色的单一菌落,置于1 mL BHI肉汤,过夜培养后将增菌液划线接种于尿道菌群定位显色培养基平板上,37 ℃培养16 h~20 h后挑取大小合适的蓝绿色单菌落于1 mL BHI肉汤,42 ℃培养16 h~20 h,初步鉴定为肠球菌。通过PCR对粪肠球菌持家基因进行扩增[7],扩增产物经加核酸染料的10 g/L琼脂糖凝胶电泳检测后,将目的片段进行胶回收并送生工生物工程(上海)股份有限公司测序。测序结果用Blast进行序列比对,同源性>96.0%的结果判定为该菌株为粪肠球菌。
1.2.2 菌株保存 确定为粪肠球菌的菌株接种在BHI肉汤隔夜培养后,加入灭菌甘油,制成的200 mL/L甘油菌,置-20 ℃冰箱保存。
1.2.3 药物敏感性试验 根据美国临床和实验室标准协会(CLSI)推荐的动物源细菌抗菌药物敏感性试验琼脂稀释法执行标准进行试验操作[8],对分离的粪肠球菌进行11种抗菌药物的最小抑菌浓度测定,测试菌株的药敏试验结果以耐药(R)、中介(I)、敏感(S)来表示。
1.2.4 耐药基因的检测 据参考文献[9~16]已有序列合成引物(引物序列见表1),引物由生工生物工程(上海)股份有限公司合成。扩增产物经琼脂糖凝胶电泳验证后,将目的片段进行胶回收并送生工生物工程(上海)股份有限公司测序。测序结果经Blast进行序列比对后确定基因型。

表1 耐药基因引物序列
2 结果
2.1 粪肠球菌的分离鉴定结果
共采集昌吉地区某规模化养猪场肛拭子262份样品,经分离鉴定得到163株粪肠球菌,分离率为62.2%。各类样品的分离率如下:妊娠母猪源粪肠球菌57株,分离率87.7%(57/65);保育肥猪源粪肠球菌64株,分离率62.1%(64/103);育肥猪源粪肠球菌30株,分离率54.5%(30/55);后备猪源粪肠球菌12株,分离率30.8%(12/39)。
2.2 粪肠球菌耐药及多药耐药结果
猪源粪肠球菌对被检抗菌药物药敏试验结果显示,该猪场粪肠球菌对被检抗菌药物中的红霉素、四环素、多西环素和利福平的耐药率都超过60.0%以上,对万古霉素和氨苄西林高度敏感,无耐药菌株检出。不同日龄猪源粪肠球菌以保育猪耐药最严重,耐药谱最宽,对被检8种抗菌药物的耐药率超过40.0%,对氟苯尼考(60.0%)和利奈唑胺(26.6%)的耐药率高于其他猪源粪肠球菌;妊娠猪耐药率次之,对被检7种抗菌药物的耐药率超过50.0%,对恩诺沙星(68.4%)的耐药率高于其他猪源粪肠球菌;后备猪对被检6种抗菌药物的耐药率超过50.0%;育肥猪源粪肠球菌对被检的5种抗菌药物耐药率超过50.0%,仅检出2株菌对氟苯尼考耐药,检出24株菌对庆大霉素耐药,对万古霉素、利奈唑胺和氨苄西林无耐药菌株检出。不同日龄猪源粪肠球菌对11种抗菌药物耐药结果详见表2。

表2 不同日龄猪源粪肠球菌的耐药率
该猪场不同日龄猪源粪肠球菌的多药耐药率为100.0%。保育猪源粪肠球菌多药耐药分布最广,在5~9耐均有分布,以6~7耐为主,占60.0%,且在8耐(16.7%)和9耐(16.7%)中所占比例比其他日龄更高;妊娠猪源粪肠球菌多药耐药分布在4~9耐,在7耐中所占比例最高,达50.9%;后备猪源粪肠球菌多药耐药也分布在4~9耐,但在6耐中所占比例最高,达58.3%;育肥猪源粪肠球菌多药耐药分布在3~6耐,在5耐中所占比例最高,达57.8%。不同日龄猪源粪肠球菌的多药耐药结果详见表3。

表3 不同日龄猪源粪肠球菌的多药耐药结果
2.3 粪肠球菌耐药基因检出结果
耐药基因检出结果显示,猪源粪肠球菌除cfr和vanA基因未检出外,对被检的其他8种耐药基因均有检出,对tetM(100.0%)检出率最高,对aac(6′)-Ie-aph(2″)-Ia、aph(3′)-Ⅲ和ermB基因的检出率也高达95.0%以上。不同日龄猪源粪肠球菌耐药基因检出结果显示,保育猪源粪肠球菌耐药基因携带率最高,tetK(33.3%)、fexA(60.0%)和optrA(56.7%)基因携带率高于其他日龄猪源粪肠球菌,育肥猪源粪肠球菌对10种被检基因中的7种耐药基因有检出,且ermA基因(5.0%)只在育肥猪源粪肠菌株中检出。不同日龄猪源粪肠球菌耐药基因检测结果详见表4。
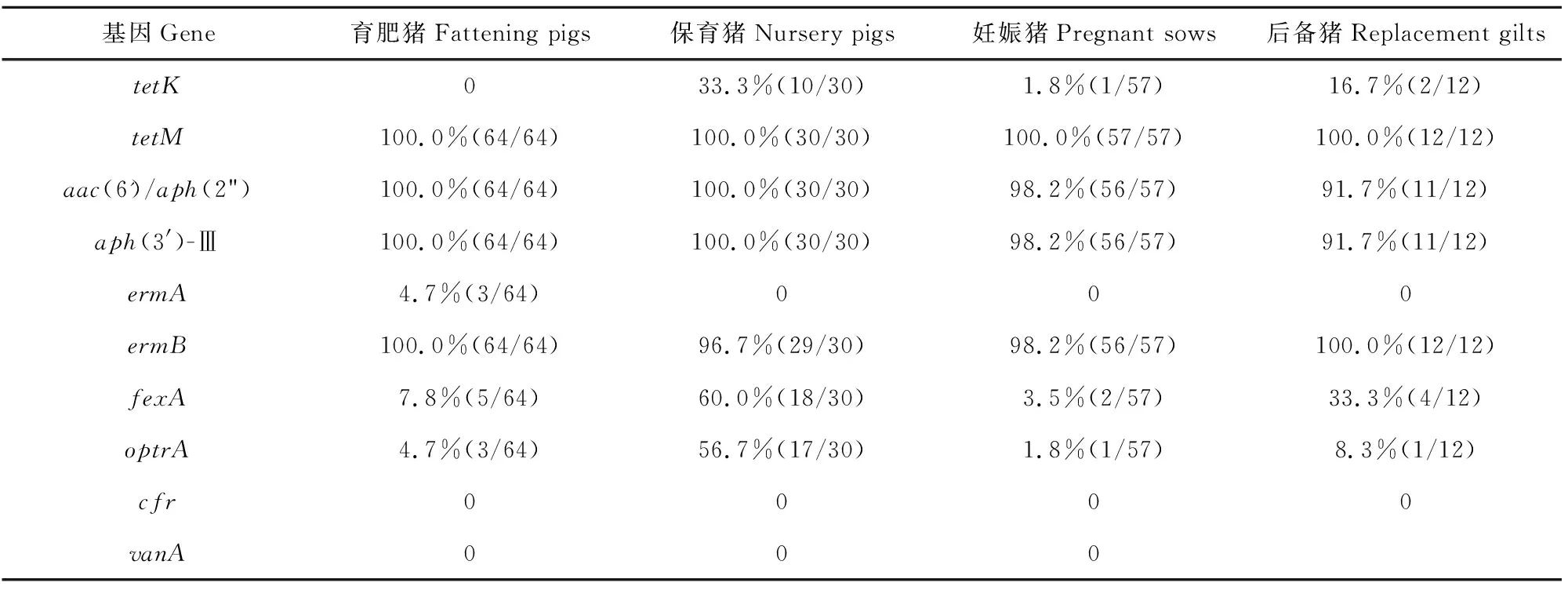
表4 不同日龄猪源粪肠球菌耐药基因检出结果
3 讨论
粪肠球菌作为肠球菌属中的重要种,很易被诱导产生耐药性,成为多种耐药基因的贮存库,并引起人和动物的多种感染。本研究以新疆某规模化猪场不同日龄猪源粪肠球菌为研究对象,分析在相同的养殖方式下,不同日龄猪源粪肠球菌的耐药特点及耐药基因携带情况,对于临床针对不同生长阶段猪只用药具有指导意义。粪肠球菌的整体分离率为62.2%,高于王舒丰等[17]所报道的菌株分离率,与幸文定[18]报道的猪源粪肠球菌的分离率较为相近,不同日龄猪只以妊娠母猪粪肠球菌分离率最高,达87.7%,高于姚晓慧等[19]报道的阿克苏地区妊娠猪粪肠球菌分离率,但育肥猪和保育猪的分离率基本一致,分离结果显示,粪肠球菌作为肠道共生菌在不同生长阶段猪只中具有较高分离率,且在不同生长阶段猪只体内的比例具有一定差异性。
药敏试验结果表明,不同日龄猪源粪肠球菌对四环素和红霉素的高耐药率与王蒙蒙等[20]报道的新疆北疆地区粪肠球菌的耐药结果基本一致,分析高耐药率产生的原因,是由于四环素类与大环内酯类的一些抗菌药物属于我国批准的饲料药物添加剂,从而导致菌株对其耐药严重;值得注意的是,除保育猪对氟苯尼考的耐药率达60.0%以外,其余日龄猪源粪肠球菌对氟苯尼考的耐药率仅在3.1%~8.3%之间,但整体对氟苯尼考的中介率却高达70.6%,为防止短时间内耐药菌株的大量出现,该养殖场应注意氟苯尼考的规范使用,通过联合用药或轮换用药减少氟苯尼考耐药菌株的出现。除育肥猪外,不同日龄猪源粪肠球菌对利奈唑胺均有耐药菌株检出,以保育猪的耐药率最高(为30.0%),后备猪与妊娠猪分别为8.3%与1.7%,远高于魏莲花等[21]的报道,虽然该场分离菌株对其敏感性良好,也应严格控制药物的使用,避免利奈唑胺耐药菌株的暴发。
该养殖场分离菌株的多药耐药集中在5~7耐,耐药谱型以ERY-TET-DOX-RFP-AMK-GEN为主。不同日龄粪肠球菌以保育猪的多药耐药分布最广,耐药率最高,耐药情况最为严重,妊娠猪与后备猪次之。分析其原因可能是,保育猪自身的生理功能尚未完全成熟,失去母源抗体的条件下,易被外来病原菌侵入而引发疾病[17],此外,该猪场用药调查显示,在保育阶段,使用抗菌药物几率更高,也是导致分离菌株耐药严重的原因之一。妊娠猪与后备猪由于养殖周期长,使用抗菌药物的几率高,从而导致高耐药率的产生。该猪场可结合不同日龄的药敏试验结果,在目前的用药模式上针对不同日龄合理选用具有较高敏感性的抗菌药物,在提高治疗效果降低经济成本的同时,也可缓解该养殖场细菌耐药严重的情况。
本研究耐药基因检测结果显示,该场猪源粪肠球菌耐药基因携带率与耐药表型基本一致。对酰胺醇类药物的耐药率为14.1%,对酰胺醇类fexA基因检出率为17.8%。四环素类药物的耐药率为100.0%,介导四环素类药物耐药的基因主要是tetM,该基因的检出率为100.0%,但tetK基因检出率未超过10.0%,与Molechan C等[22]报道的一致;对大环内酯类耐药的菌株大多携带ermB基因,对氨基糖苷类耐药基因aac(6′)-Ie-aph(2″)-Ia和aph(3′)-Ⅲ的检出率相同,为98.8%,对氨基糖苷类耐药率达到79.1%,中介率为20.9%,结果印证Osei Sekyere J等[23]报道的药敏试验中介的菌株也可能扩增出相应耐药基因的情况。保育猪源粪肠球菌耐药基因携带率高,对fexA、optrA和tetK基因的携带率明显高于其他日龄,尤其是对2015年新发现的恶唑烷酮类耐药基因optrA的检出率高达13.5%。该基因不仅介导对酰胺醇类抗菌药物和利奈唑胺的耐药,还可介导对2014年被美国FDA批准上市的新一代恶唑烷酮类药物——泰地唑利的耐药,该药被批准用于临床治疗耐甲氧西林的金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)和耐甲氧西林的凝固酶阴性的葡萄球菌(methicillin-resistant coagulase negativeStaphylococci,MRCoNS)等多重耐药菌引起的感染[12]。耐药基因的携带必然会影响相应抗菌药物的治疗效果,影响养殖业的发展,还严重危害人类的健康。如不加以控制,可能会造成“无药可用”的境地[24]。因此,应密切监测耐药粪肠球菌,预防耐药菌暴发,并通过更深入的研究和调查来探究粪肠球菌耐药机制产生的原因。
综上所述,通过检测发现新疆昌吉地区某规模化猪场不同日龄猪源粪肠球菌对四环素、红霉素、多西环素和利福平的耐药率高,应减少这四类药物的使用。此外,保育猪耐药率高,耐药谱宽,耐药基因携带率高,应严格控制抗菌药物在保育猪中的使用。在不同日龄猪源粪肠球菌中均检出恶唑烷酮类耐药基因optrA,提示应该在养殖场禁用恶唑烷酮类药物。该猪场可结合药敏试验结果合理使用抗菌药物,同时相关部门应加强抗菌药物的规范使用,降低细菌的耐药性。

