温度对红耳滑龟白细胞数量和杀菌能力的影响
吴海燕,冯文红,吴文欣,许洋溢,杨雨晴,刁迎珠,张志强
(安徽农业大学动物科技学院,安徽合肥 230036)
爬行动物的免疫系统与哺乳动物相似,也包含天然免疫、细胞介导的免疫和体液免疫三部分[1]。然而,因缺少模式动物和适用于监测爬行动物健康状态的免疫指标,与哺乳动物相比,爬行动物免疫生态学(Immunological ecology)研究起步较晚,进展较慢[1]。温度是爬行动物经常面临的环境胁迫因子之一,能影响免疫系统的不同部分[2-4]。其中,白细胞的类型和数量随季节[5-6]、日龄[7-8]等因素而变化,中性粒细胞与淋巴细胞的比值通常被认为与应激反应能力有关[9];血浆(或血清)杀菌能力可代表脊椎动物的天然免疫能力[1]。无论是血液中的各型白细胞占比情况,还是血浆(或血清)杀菌能力测定,都具有需血量少的特点,前者约需20 μL全血,后者约需10 μL血浆或血清[10]。因此,若能在不影响动物存活的情况下活体采集血液,必将促进爬行动物免疫生态学研究向纵深发展。
红耳滑龟(Trachemysscriptaelegans)是世界上危害最严重的入侵物种之一,已扩散至我国大部分地区,有野生种群存在[11]。对红耳滑龟及其多个亚种免疫功能的季节动态研究发现,其细胞介导的免疫能力、体液免疫能力和天然免疫能力变化趋势不同[5-6,12],其稚龟对植物血凝素的反应快于中华草龟(Chinemysreevesii)且数值较高[13]。本研究设置了20、24、28、32 ℃ 4个温度梯度组,采用活体背甲下静脉窦采血技术,比较了经6周温度驯化处理后,红耳滑龟在较适宜的温度范围内血液中各型白细胞的百分比和血浆杀菌能力的变化,旨在确定免疫系统不同组分响应温度波动的策略,为控制其扩散提供基础数据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 快速瑞氏-吉姆萨染液(D010),南京建成生物工程有限公司产品;大肠埃希氏菌(Escherichiacoli)冻干粉(ATCC#8739),广东省微生物菌种保藏中心产品;含L-谷氨酸盐的非CO2依赖的培养基(Invitrogen,Gibco media #18045),Sigma-Aldrich(上海)贸易有限公司产品;碘酊、肝素钠、胰蛋白酶大豆琼脂糖和无菌1 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS),合肥博美生物科技有限责任公司产品。
1.1.2 主要仪器设备 大塑料箱(规格为长×宽×高=60 cm×36 cm×36 cm)、加热棒,某网店产品;JA2003N电子天平,上海菁海仪器有限公司产品;SW-CJ-1D单人单面垂直净化工作台,苏州净化设备有限公司产品;BA-210生物显微镜,麦克奥迪实业集团有限公司产品;BXM-30R立式压力蒸气灭菌器,上海东亚压力容器制造有限公司产品;TG-16-WS台式高速离心机,湘仪集团产品;PWT-P-B电热恒温培养箱,合肥达斯卡特科学器材有限公司产品;BCD-539WT海尔冰箱,青岛海尔股份有限公司产品;TL-2000A智能血细胞分类计数器,江苏姜堰市天力医疗器械有限公司产品;移液器、载玻片、盖玻片、中性树胶、直尺、1.5 mL离心管、1 mL一次性无菌注射器、脱脂棉、不锈钢涂布棒和一次性培养皿等,江苏省海门市创慧实验器材厂产品。
1.2 方法
1.2.1 试验用动物饲养和分组 从合肥市裕丰花市花鸟鱼虫市场购买48只红耳滑龟,初始体重为81.1g±2.3 g,(52.8 g~119.9 g)。初始水温维持为20 ℃±1 ℃、水深约10 cm,随机分入4个大塑料箱饲养,每箱12只,箱底铺石块,形成部分陆地环境。以网购龟粮饲喂,每隔2 d换水1次,水为曝气24 h以上的自来水。
室内暂养15 d 后,测量体重、背甲长和背甲宽后,空调控制室温为23 ℃±1 ℃,加热棒维持大塑料箱水温至20 ℃±1 ℃、24 ℃±1 ℃、28 ℃±1 ℃和32 ℃±1 ℃,分别简称为20 ℃组、24 ℃组、28 ℃组和32 ℃组,自然光照。饲养6周后,再次测定体重、背甲长和背甲宽,通过1 mL无菌注射器在3 min内活体从红耳滑龟背甲下静脉窦处采集血液约0.3 mL,用预先经肝素钠处理过的1.5 mL离心管暂存血液,脱脂棉蘸碘酊消毒采血部位。
1.2.2 血涂片制作和各型白细胞百分比的测定 用移液器迅速从离心管中取20 μL血液,每只龟制作血涂片2张。参照刘溯源等[8]的描述,37 ℃烘片48 h后,按试剂盒说明书,用快速瑞氏-吉姆萨染液染色血涂片。血涂片中各型白细胞(中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞和淋巴细胞)的百分比的计算公式为:任一类型的白细胞百分比(%)= (1张血涂片中100个白细胞中某一类型的白细胞总数+另外1张血涂片中100个白细胞中同一类型的白细胞总数)/2。中性粒细胞与淋巴细胞的比值(ratio of neutrophils to lymphocytes,ratio of N/L,RU)= 中性粒细胞的百分比(%)/淋巴细胞的百分比(%)。
1.2.3 血浆杀菌能力测定 参照张志强等[7]对滑鼠蛇(Ptyasmucosus)的血清杀菌能力测定方法进行。简述如下:用1 mol/L PBS将大肠埃希氏菌冻干粉制成细菌液,37 ℃水浴激活后倍比稀释,制成细菌工作液;取制作血涂片后的剩余血液,在6 000 r/min离心10 min后取上清液,置-20 ℃冻存,室温融化血浆后,取10 μL与含有2.34 mg/L-谷氨酸盐的非CO2依赖的培养基200 μL混匀,之后加入20 μL细菌工作液,充分混匀后37 ℃水浴30 min,取胰蛋白酶大豆琼脂糖平板,每个平板加入50 μL孵育后的样品,均匀涂布做2个重复。以不加血浆样品、只加液体培养基的平板作为对照平板,重复3次。倒置平板,37 ℃孵育24 h后,计数每一平板的菌落数,阴性对照组的菌落范围数为52~234个/平板。血浆杀菌能力(%)=[1﹣(每一样品的菌落数/阴性对照组的平均菌落数)]×100。
1.2.4 统计分析 用统计分析软件SPSS软件包(SPSS 19.0 for windows)进行数据处理。用One sample Kologorov-Smirnov test检验数据的正态分布情况,对不符合正态分布的数据进行转换:初背甲宽、N/L的比值进行常用对数转换,单核细胞的百分比、血浆杀菌能力进行反正弦转换;单核细胞的百分比经转换后仍不符合正态分布,故用非参数检验中的多个独立样本的Kruskal-Wallis H法比较不同温度组的组间差异。用单因素方差分析(One-way ANOVA)比较不同温度组试验开始时和试验结束时体重、背甲长和背甲宽的组间差异,以及不同温度组试验结束时各型白细胞的百分比(单核细胞的百分比除外)、N/L的比值和血浆杀菌能力的组间差异。文中数值均以平均值±标准误(Mean±SE)表示,P<0.05为差异显著。
2 结果
2.1 温度对红耳滑龟体重、背甲长和背甲宽的影响
结果见表1。红耳滑龟试验开始时20 ℃组、24 ℃组、28 ℃组和32 ℃组的初体重(F3,44=0.518,P>0.05)、初背甲长(F3,44=0.554,P>0.05)和初背甲宽(F3,44=1.009,P>0.05),以及试验结束时的终体重(F3,44=0.593,P>0.05)、终背甲长(F3,44=0.818,P>0.05)和终背甲宽(F3,44=0.200,P>0.05)均无显著的组间差异。

表1 不同温度组红耳滑龟体重、背甲长和背甲宽的变化
2.2 温度对红耳滑龟各型白细胞的百分比、N/L的比值和血浆杀菌能力的影响
结果见表2。淋巴细胞的百分比24 ℃组显著高于20 ℃组(F3,44=3.777,P<0.05),嗜碱性粒细胞的百分比24 ℃组显著低于28 ℃组和20 ℃组(F3,44=5.019,P<0.05)。中性粒细胞的百分比20 ℃组和32 ℃组较高,24 ℃组和28 ℃组较低,但未见明显的组间差异(F3,44=0.748,P>0.05);嗜酸性粒细胞的百分比20 ℃组和32 ℃组较高,28 ℃组其次,24 ℃组最低,也无明显的组间差异(F3,44=1.745,P>0.05);单核细胞的百分比24 ℃组最高,其他温度组较低,但无明显的组间差异(F3,44=1.952,P>0.05)。N/L的比值变幅较大,20 ℃组和32 ℃组较高,24 ℃组和28 ℃组较低,但未见明显的组间差异(F3,44=0.671,P>0.05)。20 ℃组、24 ℃组、28 ℃组和32 ℃组的血浆杀菌能力24 ℃组和28 ℃组较高,20 ℃组和32 ℃组较低,但均无明显的组间差异(F3,44=2.752,P>0.05)。
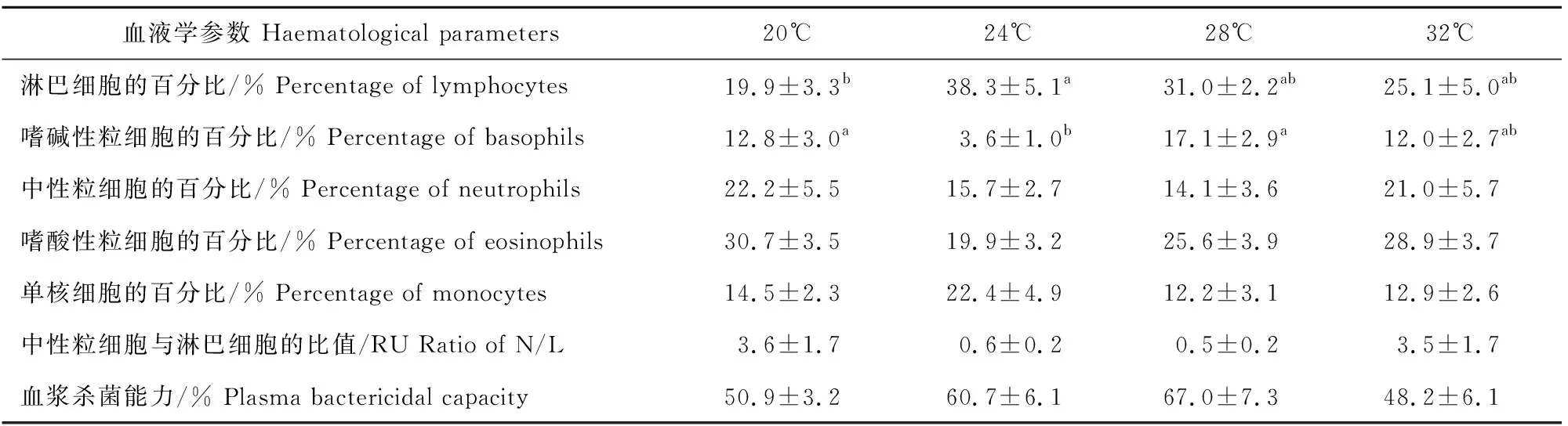
表2 红耳滑龟不同温度组各型白细胞的百分比、中性粒细胞与淋巴细胞的比值和血浆杀菌能力的变化
3 讨论
爬行动物血液中的血细胞是免疫防御的重要有形成分,各型白细胞的百分比与体液免疫、细胞免疫和天然免疫等多种组分有关,可执行不同的功能[7-9]。红耳滑龟血液中淋巴细胞的百分比24 ℃组高于20 ℃组,而嗜碱性粒细胞的百分比28 ℃和20 ℃组都高于24 ℃组,淋巴细胞可分为T细胞、B细胞和自然杀伤细胞三类,T细胞受抗原刺激激活后,参与细胞免疫,B细胞激活后与体液免疫有关,而嗜碱性粒细胞则与天然免疫有关[9],说明24 ℃水温能激活红耳滑龟的适应性免疫功能,但抑制天然免疫能力,两者间的权衡关系可能有利于维持各型白细胞的百分比处于动态平衡状态。研究表明,28.8 ℃能显著提升红耳滑龟B细胞产生抗体的能力,但对其吞噬功能无明显影响[2,14]。
N/L的比值和血浆皮质酮含量都可用于指示脊椎动物的应激状态,但两者随时间变化的反应模式不同,N/L的比值通常反应较慢,可能与免疫指标负相关,但也有不相关的试验证据[9]。红耳滑龟20 ℃组和32 ℃组N/L的比值较高,24 ℃组和28 ℃组较低,而反映天然免疫能力的血浆杀菌能力24 ℃组和28 ℃组较高,20 ℃组和32 ℃组较低,说明低温和高温均能影响其健康状态。北美拟鳄龟(Chelydraserpentina)和真鳄龟(Macroclemystemminckii)的血浆杀菌能力在25 ℃、30 ℃和35 ℃时最高,且无种间差异,但在10 ℃、20 ℃和40 ℃时前者显著高于后者,这可能与前者分布区广和易于耐受温度刺激有关[15]。从5月初至9月初,红耳滑龟栖息地的水温逐渐上升,血浆杀菌能力5月底、6月中旬和7月中旬都显著高于5月初、8月初和9月初[12],而沙漠地鼠龟的血浆杀菌能力与N/L的比值不相关,从冬季至春季呈持续下降趋势[16]。将普通麝香龟(Sternotherusodoratus)暴露于5 ℃或10 ℃ 48 h后,可通过增强的杀菌能力和吞噬能力来快速适应温度变化[4]。北美拟鳄龟中,在-80 ℃冷冻血浆样品6周,或者30 min解冻后再冷冻,除检出5%~6%的批间差外,血浆杀菌能力不受冻融条件的影响,重复性好[17]。红耳滑龟血浆杀菌能力的变化提示24 ℃和28 ℃的水温有助于其存活,20 ℃的低温和32 ℃的高温会损害其天然免疫能力。
在温和的温度波动范围内,红耳滑龟通过血液中淋巴细胞和嗜碱性粒细胞的百分比的变化来应对温度波动,这些改变有利于红耳滑龟快速适应变温环境,可能是其在野外易于扩散的生理学基础之一。然而,关于极端环境温度对红耳滑龟免疫功能的影响,尚需进一步深入研究。

