脑缺血再灌注损伤模型大鼠脑组织缺血半暗带病理进程研究
杨琼英,冯晋,宁珑,孟庆婷,何芳雁
(云南中医药大学中药学院,云南 昆明 650500)
《中国脑卒中防治报告(2018)》显示,脑卒中居我国死亡原因之首[1],并以每年8.7%的速率增长[2]。临床上根据脑卒中发生原因分为缺血性脑卒中(ischemic stroke,IS)和出血性脑卒中(intracerebral hemorrhage,ICH),其中IS是最常见的脑卒中类型,占全部脑卒中的60%~80%[3]。IS的病理改变是一个动态发展过程,其病理过程涉及复杂的时间和空间级联反应[4]。在IS发生后,缺血组织中心区神经元发生不可逆性坏死,并在缺血区周边形成可以被挽救的、以神经元凋亡为主的缺血半暗带(ischemia penumbra,IP)[5],随着IS病程的进展梗死中心区不断向IP区扩张,直至IP区完全消失。IP的概念最初于1977年由Abtrup 等[6]提出,定义为梗死中心区与正常脑区之间功能受损和电生理异常但结构上完整的缺血性脑组织[7]。IP区具有时空级联反应的特点,随着缺血时间的延长而逐渐消失,及时恢复IP血流或采用药物保护,则可能挽救该区域尚处于“半功能”状态的神经细胞[8]。超过一定时间恢复血流,会引起缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI),加重脑组织坏死转为不可逆损伤,梗死灶扩大[9]。抑制或减轻IS急性期IP细胞凋亡或死亡,避免其发展为不可逆的梗死区域,对于IS的治疗及预后具有重要意义[10]。然而文献报道,IP区域的界定方法不一,区域大小不定,并且动物与人体之间存在一定差异,严重影响了临床前抗IS研究结果的判断[11]。本文采用线栓法复制大鼠脑缺血/再灌注损伤(middle cerebral artery occlusion/reperfusion,MCAO/R)模型,采用免疫荧光法检测模型大鼠再灌注后不同时间点脑组织微管相关蛋白2(microtubule-associated protein-2,MAP-2)的阳性表达和分布以判断IP区的形成及持续时间,为研究保护IP药物研究的给药时间提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 成年健康雄性SD大鼠,体重250~300 g,SPF级,购自成都达硕实验动物有限公司,许可证号:SCXK(川)2015-030,批号:0042497。大鼠的饲养和使用均符合《实验动物管理条例》。
1.1.2 实验药物与试剂 水合氯醛(成都市科龙化工试剂厂,批号:2016020101);多聚甲醛(广东光华化学厂有限公司,批号:20100422);蔗糖(天津市风船化学试剂科技有限公司,批号:2013080628);异氟烷(瑞沃德生命科技有限公司,批号:2017180101);OCT包埋剂(日本Thermo公司,批号:381136);MAP-2 Polyclonal Antibody(美国Abcam公司,批号:GR288637-1);山羊血清(北京索莱宝科技有限公司,批号:4191052);DAPI(美国Abcam公司,批号:GR3182624-6)。
1.1.3 主要仪器 MCAO线栓(2636A4,北京西浓科技有限公司);激光多普勒血流监测仪(PF5001,瑞典Perimed公司);激光散斑血流成像仪(PeriCam PSI,瑞典Perimed公司);分析天平(Secura2250,德国Sartorius公司);冰冻切片机(Cryostar NX50,美国Thermo Fisher scientific公司);显微镜(Ci-L,日本Nikon公司);药品冷藏箱(YY-1200,沈阳市医疗设备厂);旋涡混合器(QL-861型,江苏海门市其林贝尔仪器制造有限公司)。
1.2 动物分组 动物分为假手术组和模型组,模型组将成功复制MCAO/R模型的大鼠依据手术时间长短随机分为6组(MCAO/R-0 h、MCAO/R-2 h、MCAO/R-6 h、MCAO/R-12 h、MCAO/R-24 h、MCAO/R-72 h),每组6只。
1.3 MCAO/R模型大鼠的复制 SD大鼠采用异氟烷吸入麻醉,麻醉后将大鼠俯卧固定,参照文献方法[12],制备大鼠MCAO/R模型:颈部剃毛并进行常规消毒,用手术剪沿颈正中偏右0.5 cm处切口约1.5 cm,钝性分离大鼠右侧颈总动脉(common carotid artery,CCA)和迷走神经至分叉处。结扎CCA近心端,静脉夹夹闭CCA远心端,在距CCA和迷走神经分叉 1 cm处剪一“V”形缺口,将栓线从 “V”形缺口插入。松开CCA上动脉夹,轻轻向右牵拉CCA近心端上的结扎线,调整进线角度使栓线成功到达大脑较细的前动脉,栓线插入深度为18~20 mm,微遇阻力时停止,完成右侧大脑中动脉阻塞。确认脑中动脉闭塞后,记录此时时间,于缺血后2 h拔出线栓实施再灌注,涂抹青霉素后缝合伤口。假手术组手术步骤同前,不插入线栓。在缺血及再灌注期间保持室温在25~30 ℃,大鼠苏醒后放入笼中饲养,并观察大鼠神经功能恢复情况。
1.4 检测指标与方法
1.4.1 生理指标检测 大鼠用10%水合氯醛(0.3 mL/100 g)麻醉后,术前记录大鼠体重、血糖、体温(肛温)等生理指标,记为正常数值,并于术后再次记录以上生理指标。
1.4.2 激光多普勒(laser doppler,LDF)监测脑血流量(cerebral blood flow,CBF) 大鼠于复制MCAO/R模型手术前麻醉后俯卧,沿矢状位剪开额顶部皮肤 2 cm,显露右侧颞肌的筋膜后,沿与颧弓水平走行的面神经颧眶支腹侧边缘切开筋膜,牵拉眶颧静脉及其背侧平行走行的伴行神经,平行切开筋膜下的肌肉,显露表面的颧骨。在该处用牙科钻打磨约2 mm×3 mm的骨窗,至脑中动脉清晰可见。固定LDF的探头于骨窗暴露出的脑中动脉分叉位置上,监测此时右侧大脑中动脉供血区域血流变化值,记录此血流值为100%,缺血后5 min再次监测血流值。
1.4.3 激光散斑(laser speckle imaging,LSI)监测CBF 大鼠于复制MCAO/R模型手术前麻醉后俯卧,沿矢状位剪开额顶部皮肤,暴露颅骨前囟后用棉签和生理盐水将颅骨表面清理干净。大鼠与固定器置于LSI下,使大鼠颅骨位于显微镜下,记录此时脑皮层血流动态图像和血流值,记为100%,缺血后5 min再次监测脑组织局部血流量变化。
1.4.4 神经学评分 术后采用Longa 5分法进行神经病学评分(见表1)。以缺血后LDF检测CBF在10%~20%之间,LSI检测42%~53%之间,再灌注后CBF恢复至50%以上;神经病学评分1~3 分的模型大鼠纳入后续实验研究。

表1 Longa 5分法神经学评分表
1.4.5 脑梗死体积测定 于术后24 h麻醉大鼠,断头取脑,去除嗅球,冷冻10 min 后取出做连续冠状切片,共5片(一片约为2 mm)。将脑切片置入0.2% 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)溶液中,37 ℃恒温避光染色。取出脑切片放入4%的多聚甲醛溶液中固定过夜,取出脑片,数码相机拍照,用Motic Images Plus 2.0 显微图像分析系统计算梗死面积。具体公式如下:
脑梗死灶体积(mm3)=总梗死面积×脑片厚度(2 mm)
水肿修正后的脑梗死灶体积(mm3)=梗死体积×对侧半球体积/同侧半球体积
梗死率(%)=水肿修正后的脑梗死灶体积/双侧大脑半球体积×100%
1.4.6 免疫荧光检测MCAO/R模型大鼠各时间点MAP-2的表达 将大鼠于各时间点麻醉后仰卧位固定,暴露其胸部,经右心室推入0.9%的生理盐水250 mL(以流出的液体澄清为准),再用4%多聚甲醛250 mL先快后慢进行心脏灌注后断头取脑(以四肢、尾巴头僵硬为准)。脑组织置于4%多聚甲醛溶液固定过夜,依次用20%、30%的蔗糖溶液脱水至组织沉底。脑组织采用OTC组织包埋剂将组织均匀包裹迅速放入-80 ℃冻存。制作冰冻切片,切片厚度为15 μm,自然晾干后用PBS冲洗,50%山羊血清封闭2 h,滴加一抗MAP-2(1∶200)4 ℃孵育过夜,PBS常规清洗后滴加二抗避光孵育40 min。常规洗涤后,DAPI 封片,采用荧光显微镜和数字成像系统获得荧光图像。
1.5 统计学方法 本实验所得数据用GraphPad prism软件进行统计分析,数据采用T检验,结果以均数±标准差(Mean±SD)表示,以P<0.05 为差异具有统计学意义。
2 实验结果
2.1 对大鼠血糖、肝温、体重的影响 与假手术组比较,模型组大鼠血糖、肛温无变化,术后24 h体重下降,差异无统计学意义,结果见表2。

表2 对模型大鼠血糖、肛温、体重的影响(Mean±SD,n=6)
2.2 对大鼠CBF的影响 LDF、LSI检测模型大鼠CBF降低,差异有统计学意义(**P<0.01),再灌注后脑血流可恢复至正常值50%以上(见表3)。LSI检测大鼠CBF显示,假手术组大鼠CBF随着0 h(H)、6 h(I)、12 h(J)、24 h(K)、72 h(L) 时间的延长与基础值比较(G),CBF处于平稳状态;与假手术组比较,模型组于再灌注0 h(B)、6 h(C)、12 h(D)、24 h(E)、72 h(F)各组大鼠CBF降低情况基本稳定,如图1所示,A、G图为动物术前基础值。

图1 LSI监测CBF

表3 对模型大鼠CBF的影响(Mean±SD,n=6)
2.3 对大鼠神经学评分和脑梗死体积的影响 模型大鼠神经病学评分升高,差异有统计学意义(P<0.01);脑梗死体积增加,差异有统计学意义(P<0.01),见表4、图2。

表4 对大鼠神经学评分和脑梗死的影响(Mean±SD,n=6)
2.4 MCAO/R模型大鼠不同时间点MAP-2的表达 结果显示,假手术组大鼠缺血侧脑皮层中MAP-2免疫荧光染色均匀,在20×镜下神经元排列整齐、形态完整,可见清晰的树突和包浆,突起较长且连续,见图3(A)所示;模型组在缺血2 h再灌注0、2、6、12、24、72 h不同时间点MAP-2免疫荧光染色随着再灌注时间点的延长,部分皮层部位绿色荧光逐渐变弱,见图3(B~G)所示。再灌注2 h神经元与假手术组无差异,能观察到大量MAP-2阳性表达,见图3(B~C)所示;再灌注6 h出现缺血中心区及IP,缺血中心区可见大片神经元荧光染色消失,视野下呈现黑色空洞,IP区神经元表达紊乱,见图3(D)所示;再灌注12 h可观察到缺血中心区神经元染色消失加重,神经元排列紊乱,突起断裂不连续或弯曲变形,见图3(E) 所示;再灌注24 h视野下的黑洞状区域变大,神经元稀疏,有的神经元呈球拍样,个别神经元消失,IP的荧光染色较弱,见图3(E) 所示。在全脑图下观察,可见随着缺血时间延长,缺血中心区进一步扩大,神经元损伤加重,IP可持续至再灌注后72 h消失,见图3(E~G)所示。
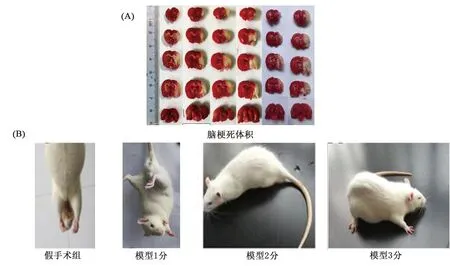
A.脑梗死体积;B.神经学评分图2 MCAO/R模型对大鼠脑组织梗死体积及神经病学评分的影响

A.假手术组;B.MCAO/R-0 h;C.MCAO/R-2 h;D.MCAO/R-6 h;E.MCAO/R-12 h;F.MCAO/R-24 h;G.MCAO/R-72 h图3 大鼠MCAO/R模型损伤侧不同时间点MAP-2表达 注:放大倍数为目镜10×,物镜20×
3 讨论
目前IS动物模型的治疗时间窗尚无统一标准,保护IP药物实验研究的给药时间多参照临床治疗时间窗进行。世界各国IS临床血管内治疗指南推荐时间窗为4.5 h[13],前循环大血管闭塞患者治疗的时间窗为6 h(Ⅰ类推荐,A类证据)[14-15],较窄的治疗时间仅有3.2%~6.4%的患者能够接受血管内治疗[16]。近年来有学者提出基于病理结构的标准,用影像学检查结合临床症状来评估患者是否存在足够的脑组织IP区作为给药依据的组织窗概念[17],这种把组织窗和时间窗相结合,对缺血中心区和IP进行识别的方法,使治疗时间窗延长至24 h甚至更长,让更多的IS患者从中受益[18]。所以探讨研究用实验动物IP的形成与持续时间对研究保护IP药物的给药时间极为重要。
可靠的研究用实验模型,是实验顺利进行,得到具有科学性和可重复性结果的重要保证。复制操作简单、稳定的IS病理动物模型对寻找有效治疗方法和药物具有重要的现实意义。IS模型受到缺血时间、阻塞部位、CBF、体重、血糖、肛温等因素的影响,其中CBF与脑损伤程度密切相关。目前对CBF的检测大多依靠LDF以及LSI进行,LDF可准确监测缺血侧MCA供血区脑表浅动脉血流某一部位的血流量,监测较为精准,可迅速反应CBF的变化;LSI是对整体的区域血流进行扫描监测成像,监测时需反应时间,可连续监测颅内血流分布变化,监测面积广泛[19]。神经学评分可反应动物神经功能损伤程度,对该模型的神经功能缺失程度进行量化;TTC是能与组织中脱氢酶反应的脂溶性光敏感复合物,可通过染色直观反应动物脑组织中缺血梗死灶大小,二者可作为评定模型稳定的终末指标。本研究采用线栓法复制大鼠MCAO/R模型以模拟IS损伤,结合实验过程中大鼠体重、体温(肛温)、血糖等生理指标的监测,以LDF、LSI监测CBF,以行为学变化(Longa 5分法)和脑梗死体积为主要观察指标,评价大鼠MCAO/R模型的稳定性。
在IS的病理发展过程中,溶栓药的使用、血栓脱落、血栓自溶以及缺血区侧支循环的建立与开放等,都会引起缺血区的血流重建,不可避免地造成 CIRI,并是导致IS进一步恶化的重要原因[20]。脑中动脉(middle cerebral artery,MCA)作为临床IS的好发区,线栓法可机械性阻断大脑MCA的血供来建立大脑中动脉缺血模型,在缺血后拔出线栓,恢复血流实现再灌注损伤[21],该模型具有手术操作简单、无须开颅、缺血时间可控、病灶位置和梗死体积较稳定等优点[22]。故本研究采用线栓法复制大鼠MCAO/R模型以模拟IS病理过程中CIRI损伤。大量的研究表明,脑缺血2 h是复制大鼠MCAO/R模型的最佳缺血时间,脑缺血少于1 h则神经功能缺失体征不明显,多余3 h又造成损伤过重,与永久性脑缺血模型的损伤无异,且药物干预效果差[23-24],故本研究设计时选择脑缺血2 h实施再灌注。
MAP-2是组成神经元细胞骨架的重要组成成分,存在于神经元的胞体、树突中,可作为神经元的标志物[25-26]。脑组织缺血损伤后梗死中心区神经元细胞出现不可逆损伤,神经元胞体、树突分解消失,致使MAP-2阳性表达消失,视野下呈现黑洞状区域;IP区域处于凋亡状态的神经元呈现为排列混乱,胞体固缩、树突变短甚至消失。为此MAP-2作为神经元胞浆及树突进行标记,采用免疫荧光检测MCAO/R模型大鼠CIRI后不同时间点脑组织MAP-2的阳性表达和分布,评价神经元的坏死和凋亡情况,以准确的判定模型大鼠脑组织梗死中心区和IP区出现及持续时间。结果表明,MCAO/R模型大鼠脑组织于缺血2 h再灌注后6 h前脑组织神经元均未见明显组织形态学改变,6 h后出现梗死中心区,随即形成IP区持续至再灌注后72 h消失。提示,临床前研究保护IP药物可选择再灌注6~72 h作为给药时间点,超过该时间给药则可能出现假阴性结果,导致漏筛具有保护IP潜力的候选受试物。

