多肽UNAM的生物合成及其在DC-CIK细胞培养中的应用
史北辰,冯茜,韩强,陈浩东,孙越,周国栋,金媛媛,张志斐,杨兆勇
·论著·
多肽UNAM的生物合成及其在DC-CIK细胞培养中的应用
史北辰*,冯茜*,韩强,陈浩东,孙越,周国栋,金媛媛,张志斐,杨兆勇
063210 唐山,华北理工大学药学院(史北辰、韩强、陈浩东、孙越、张志斐);255067 山东,淄博市第四人民医院内科(冯茜),肿瘤科(周国栋);100050 北京,中国医学科学院北京协和医学院医药生物技术研究所代谢工程室(金媛媛、杨兆勇)
制备尿苷二磷酸-N-乙酰胞壁酸(UNAM),并研究其提升 DC-CIK 细胞识别及杀伤肿瘤细胞的作用。通过设计体外酶促反应合成多肽 UNAM 的路线,构建体外酶促反应体系,按照UNAM 的路线图合成多肽产物,并采用制备液相纯化和收集最终产物。使用常规培养方法和添加 UNAM 的方法分别对 DC-CIK 细胞进行诱导培养,观察培养后的 DC-CIK 细胞对荷瘤小鼠的治疗效果。利用大肠杆菌异源表达系统,获得了 UNAM 生物合成途径中的 NahK、GlmU、MurA 和 MurB 4 个酶,并成功合成了分枝杆菌细胞壁肽聚糖生物合成中的中间产物 UNAM。在动物实验中,UNAM-DC-CIK 细胞对荷瘤小鼠的治疗效果比常规方法的 DC-CIK 细胞更好,其带瘤生存期更长(43 d),优于DC-CIK 治疗组(38 d)和对照组(25 d)。UNAM 可以提升 DC-CIK 细胞的增殖能力和对肿瘤的杀伤能力。
多肽 UNAM; 生物合成; DC-CIK 细胞; 抗肿瘤
随着环境污染等问题的加剧,恶性肿瘤对人们生命健康的影响日益严峻,其发病率也连年上升,甚至在中国逐渐成为健康的第一杀手[1]。如何治疗恶性肿瘤,改善肿瘤患者的生活状态已经成为科研热点。
肿瘤免疫疗法以免疫学基本原理为依据,以人为干预治疗的方式,通过使用免疫细胞、单克隆抗体、癌症疫苗等来提升人体内的肿瘤-免疫循环反应(一方面提升肿瘤细胞的免疫原性,另一方面也对人体的抗病能力、对肿瘤细胞的鉴别敏感性以及杀伤活性有一定的提高),增强了人体对肿瘤细胞的免疫应答作用,最终达到遏制肿瘤细胞繁殖、扩散,甚至消灭肿瘤的治疗方法[2-4]。其中,以免疫细胞为治疗手段的方式已经开展了很多研究。作为重点研究对象的免疫细胞种类包括细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)、树突状细胞(dendritic cells,DC)、自然杀伤细胞(natural killer cell,NK)等[5]。
CIK 细胞是指将提取得到的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)在体外进行培养,在加入包括 IL-1、IL-2、γ-干扰素(interferon-γ,IFN-γ)等一系列的细胞因子后,诱导生成的多种类的混合细胞群体[6-7]。在这个混合细胞群体中,CD3+CD56+细胞亚群与 CD3+CD8+细胞亚群所拥有的细胞数量及占比处于较高水平,正是这些免疫细胞对肿瘤细胞产生了强大的杀伤能力[8]。甚至,有研究发现 DC 细胞可以促进CIK 细胞的抗肿瘤作用[9-11]。然而,这些细胞体外制备的主要限制因素是诱导效果显著的细胞因子发掘,并用其提高免疫细胞的增殖效率和杀伤活性[12-15]。
尿苷二磷酸-N-乙酰胞壁酸(UDP-N- acetylmuramic acid,UDP-MurNAc/UNAM)是在合成肽聚糖过程中的一类重要化合物,其主要作用是参与细胞壁的合成与调控。在大多数的真菌细胞壁中肽聚糖的含量占据了较大比例,真菌细胞壁不但能使真菌保持正常的细胞形态,维持细胞内外的渗透压平衡,而且在真菌的生长、繁殖过程中能够发挥一定的作用。根据这一研究结果,我们通过查阅文献,最终通过体外生物合成的方法获取了多肽 UNAM,并选用 UNAM 作为诱导物,进行诱导培养 DC-CIK 细胞的研究,以期通过该多肽类化合物提升细胞活性,改善细胞识别以及杀伤肿瘤细胞的作用。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂 表达菌株BL21 (DE3) 和表达质粒 pET-28a(+) 均购自美国 Novagen 公司;Co2+-NTA 填料购自 Takara(中国)公司;30 K 超滤浓缩管购自美国 Millipore 公司;HiTrap Q HP 购自美国 GE Healthcare Life 公司;卡那霉素(Kan)、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购自上海生物工程有限公司;标准分子质量蛋白购自北京康润诚业生物科技有限公司;其余试剂均为国产分析纯。
1.1.2 实验动物与细胞 小鼠黑色素瘤细胞B16 细胞和六周龄的雄性清洁级近交系C57BL/6 小鼠[体重(20 ± 2)g]均由中国医学科学院基础医学研究所提供。
1.2 方法
1.2.1 表达质粒的构建 根据已有的分枝杆菌中细胞壁肽聚糖合成酶中 NahK、GlmU、MurA 和MurB 的碱基序列,通过引物设计,经 PCR 扩增和H I/d III 双酶切处理后,分别连入 pET-28a(+) 构建表达质粒。引物序列分别为GlmU-F:GGAATTCCATATGACGTTTCCTGGTGACACCGCGG,GlmU-R:CCGCTCGAGTCACGGT GTCTGATCAGCGTCGGGT;MurA-F:GGAATTC CATATGGTGGCCGAGCGTTTCGTCGTGACTG,MurA-R:CCGCTCGAGCTAACAGCATACCCGT TCGATCTCG;MurB-F:GGAATTCCATATGAAACGGAGCGGTGTCGGTTCGC,MurB-R:CCGCTCGAGCTACAACATGCAGCCGATCAGCACG;NahK-F:GGAATTCCATATGAACCGTACCCTGAC CCGCGAAC,NahK-R:CCGCTCGAGTCAGATAAAGCGCGCGGATACCGAG。
1.2.2 蛋白表达与纯化 将构建好的质粒转化至 BL21 (DE3) 表达菌株,接种于 3 L 含 50 μg/ml 卡那霉素、30 μg/ml 四环素和氯霉素的 LB 培养基中。37 ℃、200 r/min 培养至600= 0.8 ~ 1.0,加入 1 mol/L IPTG 至终浓度为 0.5 mmol/L,在18 ℃、200 r/min继续振荡培养 12 h。用缓冲液 lysis buffer(20 mmol/L 磷酸缓冲液,150 mmol/L NaCl,10 mmol/L 咪唑,pH 7.4)重悬菌体,利用高压均质机破碎,4 ℃、18 000 r/min 条件下离心40 min,收集上清后匀速缓慢地加入已平衡好的 Co2+-NTA 柱,再用 washing buffer(20 mmol/L 磷酸缓冲液,150 mmol/L NaCl,20 mmol/L 咪唑,pH 7.4)5 倍柱体积冲洗,最后用 elution buffer(20 mmol/L 磷酸缓冲液,500 mmol/L NaCl,500 mmol/L 咪唑,pH 7.4)洗脱目的蛋白。目的蛋白除盐后,上样于弱阴离子交换柱 HiTrapDEAE HP 进行层析纯化,利用洗脱液(20 mmol/L Tris,pH 8.0,2 mol/L NaCl)进行梯度洗脱,收集出峰样品。经 SDS-PAGE 检测后将目的蛋白用 30 K 超滤浓缩管进行脱盐浓缩后备用。
1.2.3 体外酶促反应体系的构建 配制反应体系中的缓冲液,10 ml 的缓冲溶液包含 50 mmol/L Tris-HCl(pH = 8.0),10 mmol/L MgCl2,0.1 mmol GlcNAc,0.12 mmol ATP,0.12 mol UTP,0.5 mmol PEP,0.1 mmol NADPH 和 2 mmol 葡萄糖,然后添加 5 mg NahK、5 mg GlmU、5 mg MurA、5 mg MurB,在室温 N2下反应 2 h,加入 5 ml 氯仿在 14 000 r/min 下离心 20 min,将上清液真空冷冻浓缩,得到白色粉末。将白色粉末用 1 ml 水溶解后用制备液相制备。液相过程需要使用 A 和 B 溶液,A 溶液为含有 40 mmol/L H3PO4的 2.5% MeOH(用 TEA 调整 pH 为6.5),B 溶液为含有 40 mmol/L H3PO4的 20% MeOH(用 TEA 调整 pH 为6.5),液相方法为:0 ~ 4 min 使用 100% A;4 ~ 35 min 使用 100% B;35 ~ 37 min 使用 100% A。
1.2.4 UNAM-DC-CIK 与 DC-CIK 细胞的培养 颈椎脱臼法处死小鼠,取鼠脾脏,去包膜后切剪成大小约 0.2 cm × 0.2 cm 的脾片,置于含RPMI 1640 培养液的平皿中碾磨。200 目网筛过滤获得细胞悬液,以 Ficoll-Hypaque 淋巴细胞分离液密度梯度离心获得单个核细胞。用RPMI 1640 培养基调整细胞浓度至 1 × 106/ml 并转至 T75 培养瓶中,置 37 ℃细胞培养箱培养。2 h 后,可以看到培养瓶中有两类生长方式不同的细胞:一类贴壁生长,为 DC 细胞;另一类悬浮生长,为 CIK 细胞。分离 DC 细胞和 CIK 细胞进行单独培养。①DC 细胞培养:第 1 天,向细胞培养瓶中补入 10%小鼠自体血浆、IL-4 400 UI/ml、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)800 UI/ml;第 3 天,观察细胞生长状态并补充一定量培养基;第 5 天,补入 500 U/ml TNF-a 从而诱导 DC 细胞的成熟。细胞培养到第7 ~ 8 天,当检测结果显示细胞数量达到1.0 × 109个,活性超过 90%时,开始收集 DC 细胞。②CIK 细胞培养:第 1 天,用细胞培养基,10%自体血浆将细胞充分混匀,置于细胞培养瓶中,并添加 IFN-γ 1000 U/ml,最终将培养瓶中的细胞浓度调整为 2.0 × 106个/ml,将其放入培养箱中进行培养;第 2 天向培养瓶中补充 IL-2 1000 U/ml、IL-lα 100 U/ml、抗人 CD3 单抗 50 ng/ml;之后每两天进行一次补液(包括 10%自体血浆),细胞培养至 14 d 左右,当检测结果显示数量达到 1.0 × 109个,细胞活性超过 90%时,说明 CIK 细胞培养成熟。③DC-CIK 细胞共培养:将最终收集到的 DC 与 CIK 培养瓶中的细胞按 1:10 的数量比进行混合共培养,根据细胞数量及细胞生长状况,及时补充含有 IL-2 1000 U/ml 的培养基。UNAM-DC-CIK 细胞培养组在常规 DC-CIK 培养的基础上,在 DC 与 CIK 细胞混合的同时加入终浓度为 50 μg/ml 的 UNAM。5 ~ 7 d 后,当细胞数量为 1.0 × 1010个,活性超过 90%时细胞培养成熟。
1.2.5 UNAM-DC-CIK 细胞与常规诱导的 DC-CIK 细胞的增殖特性 分别在细胞培养的第 3、5、7 天获取 2 × 浓缩的 UNAM-DC-CIK 细胞液和 2 × 浓缩的常规诱导的 DC-CIK 细胞液。将前者设为实验组,后者设为对照组。并采用 MTT 法检测其570值,每组进行 3 次检测。
1.2.6 UNAM-DC-CIK 与 DC-CIK 细胞对荷瘤小鼠的治疗效果 复苏小鼠黑色素瘤 B16 细胞株,在 C57 小鼠的腋下接种B16 细胞,每只注射约 2.5 × 106个,共 30 只,随机分为 3 组;从第 3 天起,每日腹腔注射诱导 7 d 的 UNAM-DC-CIK 细胞和 DC-CIK 细胞,共 5 次,每次每只注射 1 × 106个/0.5 ml,相应地,每次向空白对照组小鼠体内注射生理盐水 0.5 ml。
2 结果
2.1 体外生物合成多肽UNAM
通过大量文献的查阅,我们设计了图1 所示的体外酶促反应合成多肽 UNAM 的路线图。之后,根据分枝杆菌中细胞壁肽聚糖合成酶中 NahK、GlmU、MurA 和 MurB 4 个酶的碱基序列,将扩增后的 4 种目的基因分别与 pET28 载体相连接,从而完成表达载体的构建(图 2)。将质粒转入到BL21 内,经过菌株培养、分离、纯化,并用 SDS-PAGE 进行分析确定得到的蛋白为目的蛋白(图 3)。通过构建体外酶促反应体系,在配置反应溶液与目的酶混合后,按照 UNAM 的路线图最终合成多肽产物。多肽产物需要制备液相进行处理,液相结果如图 4 所示,UNAM 的检测波长是260 nm,出峰时间为 8.086 min,收集此出峰时间样品,将制备后的样品真空冷冻浓缩后所得到白色粉末即为 UNAM,并通过质谱进一步验证(图 5)。
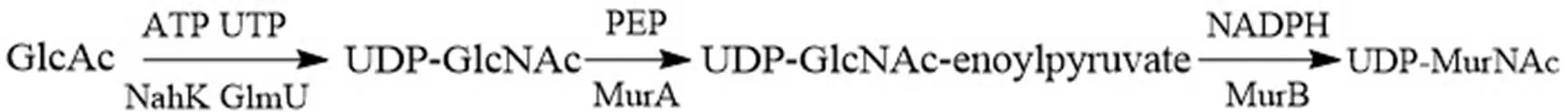
图1 UNAM 的合成路径
Figure 1 Synthesis path of UNAM
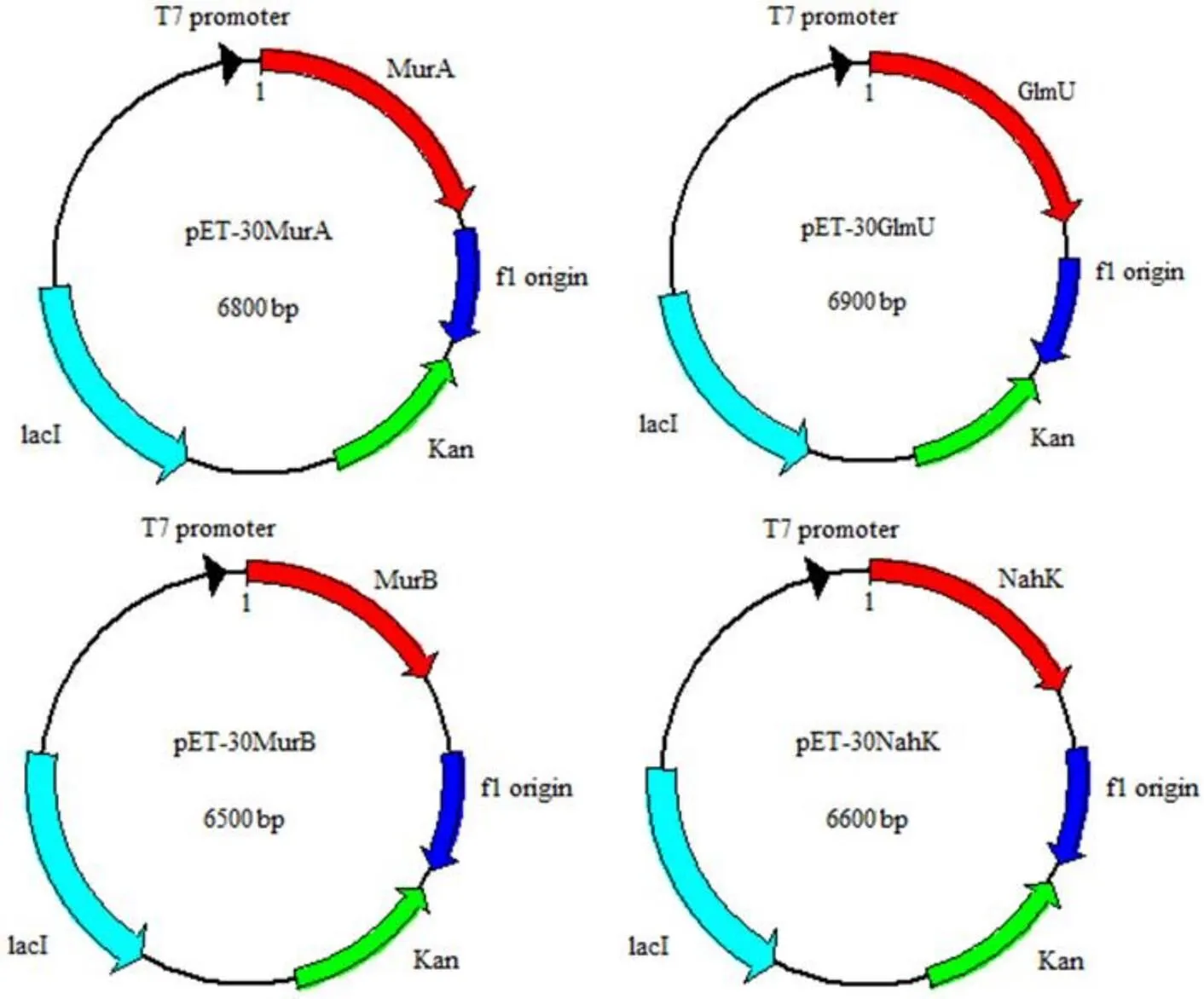
图2 4 种酶的重组构建表达质粒
Figure 2 Recombination of four enzymes to construct expression plasmids
2.2 UNAM-DC-CIK 与DC-CIK 细胞的增殖活性
通过研究培养天数对UNAM诱导的 CIK 细胞数量的影响,评价两种细胞的增殖活性,结果表明,培养第 3、5、7 天,UNAM-DC-CIK 的值分别为 0.40、0.71、2.12;DC-CIK 的值分别为 0.40、0.61、1.79(图 6)。说明经 UNAM 诱导的免疫细胞 UNAM-DC-CIK 相较于 DC-CIK 细胞具有更高的增殖能力,而且,随着培养时间的延长,UNAM-DC-CIK 的增殖速度相较于 DC-CIK 细胞的增殖速度增长更快。

1:NahK;2:GlmU;3:MurA;4:MurB
Figure 3 SDS-PAGE gel image ofhost expressing four enzymes
2.3 UNAM-DC-CIK 与DC-CIK 细胞对荷瘤小鼠的治疗效果
通过研究 UNAM-DC-CIK 与 DC-CIK 细胞治疗对荷瘤小鼠生存时间的影响,评价两种细胞的治疗效果。结果如图 7 所示,UNAM-DC-CIK 与 DC-CIK 均能够缓解肿瘤对小鼠的损害,延长小鼠的寿命。其中 UNAM-DC-CIK 治疗组的生存时间最长为 43 d,DC-CIK 治疗组的生存时间为 38 d,对照组的生存时间为 25 d。最终实验结果说明,UNAM-DC-CIK 相较于 DC-CIK,在治疗小鼠肿瘤、延长小鼠寿命上,效果更好。

图4 UNAM 制备样品液相图
Figure 4 Liquid phase diagram of UNAM preparation sample

图5 UNAM 质谱验证图
Figure 5 UNAM mass spectrum verification diagram

图6 UNAM-DC-CIK 细胞和DC-CIK 细胞的增殖活性(*P < 0.05,ns没有统计学意义)
Figure 6 The proliferation activity of UNAM-DC-CIK cells and DC-CIK cells (*< 0.05,nsno statistical significance)

图7 UNAM-DC-CIK 细胞和DC-CIK 细胞的对小鼠生存期的影响(*P < 0.05,***P < 0.001)
Figure 7 The effect of UNAM-DC-CIK cells and DC-CIK cells on the survival of mice (*< 0.05,***< 0.001)
3 讨论
当前利用自体 CAR-T、DC-CIK 治疗肿瘤患者的临床研究陆续进行,CAR-T 在培养过程中需要进行繁琐的基因编程,这限制了它的广泛应用。并且在应用 CAR-T 治疗的过程中极易出现治疗相关不良事件,如细胞因子风暴。与 CAR-T 相比,DC-CIK 培养方法简便,而且在治疗过程中患者几乎无不良事件。由于 DC-CIK 是通过非 MHC依赖的方式发挥免疫作用,在面对那些免疫原性较低的肿瘤时,可以发挥更好的治疗效果。此外有些化疗药物可以改变肿瘤微环境,增加肿瘤抗原暴露,或减少肿瘤对浸润性 T 细胞的接触,因此常用来与 DC-CIK 共同治疗肿瘤患者,以发挥更好的治疗作用。
UNAM 是合成肽聚糖过程中的一个重要中间产物,参与细胞壁的合成与调控。肽聚糖作为大多数真菌细胞壁的重要组成,是维持细菌细胞形态和渗透压平衡的重要基础。本文利用大肠杆菌异源表达系统,异源表达获得了 UNAM 生物合成途径中的 NahK、GlmU、MurA 和 MurB 4 个酶。采用体外酶促反应,成功合成了分枝杆菌细胞壁肽聚糖生物合成中的中间产物 UNAM。
使用 UNAM 和常规方法分别对 DC-CIK 细胞进行诱导培养,结果表明 UNAM-DC-CIK 细胞的增殖能力高于常规方法培养的细胞。在动物实验中,UNAM-DC-CIK 对荷瘤小鼠的治疗效果比常规方法培养的 DC-CIK 更好,其带瘤生存期更长。总之,本研究为 DC-CIK 细胞的培养提供了新的方案,并为更多高活性细胞因子的筛选提供了有益参考。
[1] Chen JX. The effect of angelica polysaccharide on the biological characteristics and killing activity of CIK cells and its related mechanism. Lanzhou: Gansu University of Chinese Medicine, 2015. (in Chinese)
陈吉祥. 当归多糖对CIK细胞生物学特性、杀伤活性的影响及其相关机制研究. 兰州: 甘肃中医药大学, 2015.
[2] Kirkwood JM, Butterfield LH, Tarhini AA, et al. Immunotherapy of cancer in 2012. CA Cancer J Clin, 2012, 62(5):309-335.
[3] Rosenberg SA, Dudley ME, Restifo NP. Cancer immunotherapy. N Engl J Med, 2008, 359(10):1072.
[4] Kingwell K. Cancer: live screening of immunotherapy targets. Nat Rev Drug Discov, 2014, 13(4):258.
[5] Chen JW. Study on the interaction between human umbilical cord-derived mesenchymal stem cells and cytokine-induced killer cells. Lanzhou: Gansu University of Chinese Medicine, 2018. (in Chinese)
陈佳文. 人脐带源间充质干细胞与细胞因子诱导的杀伤细胞相互作用的研究. 兰州: 甘肃中医药大学, 2018.
[6] Ma Y, Xu YC, Tang L, et al. Cytokine-induced killer (CIK) cell therapy for patients with hepatocellular carcinoma: efficacy and safety. Exp Hematol Oncol, 2012, 1(1):11.
[7] Wang ZH. CIK cell therapy for cancer: current status and prospects of international clinical trials. Chin J Cancer Biother, 2013, 20(2):129- 137. (in Chinese)
王志华. CIK细胞治疗癌症: 国际临床试验的现状及展望. 中国肿瘤生物治疗杂志, 2013, 20(2):129-137.
[8] Lee JH, Lee JH, Lim YS, et al. Adjuvant immunotherapy with autologous cytokine-induced killer cells for hepatocellular carcinoma. Gastroenterology, 2015, 148(7):1383-1391.
[9] Garofano F, Gonzalez-Carmona MA, Skowasch D, et al. Clinical trials with combination of cytokine-induced killer cells and dendritic cells for cancer therapy. Int J Mol Sci, 2019, 20(17):4307.
[10] Zhang X, Du M, Zhang Q, et al. In vivo anti-tumor effect of DC-CIK cells on human lymphoma cell line Raji. Pak J Pharm Sci, 2017, 30(3(Special)):1075-1079.
[11] Qu HQ, Zhou XS, Zhou XL, et al. Effect of DC-CIK cell on the proliferation, apoptosis and differentiation of leukemia cells. Asian Pac J Trop Med, 2014, 7(8):659-662.
[12] Meng Y, Yu Z, Wu Y, et al. Cell-based immunotherapy withcytokine-induced killer (CIK) cells: from preparation and testing to clinical application. Hum Vaccin Immunother, 2017, 13(6):1-9.
[13] Märten A, Greten T, Ziske C, et al. Generation of activated and antigen-specific T cells with cytotoxic activity after co-culture with dendritic cells. Cancer Immunol Immunother, 2002, 51(1):25-32.
[14] Fujii S, Shimizu K, Kronenberg M, et al. Prolonged IFN-gamma- producing NKT response induced with alpha-galactosylceramide- loaded DCs. Nat Immunol, 2002, 3(9):867-874.
[15] Liu C, Zheng Y, Tang J, et al. Stimulation of DC-CIK with PADI4 protein can significantly elevate the therapeutic efficiency in esophageal cancer. J Immunol Res, 2019, 2019:6587570.
Biosynthesis and application of polypeptide UNAM in DC-CIK cell culture
SHI Bei-chen, FENG Qian, HAN Qiang, CHEN Hao-dong, SUN Yue, ZHOU Guo-dong, JIN Yuan-yuan, ZHANG Zhi-fei,
YANG Zhao-yong
Author Affiliations: School of Pharmacy, North China University of Science and Technology, Tangshan 063210, China (SHI Bei-chen, HAN Qiang, CHEN Hao-dong, SUN Yue, ZHANG Zhi-fei); Department of Internal Medicine (FENG Qian), Department of Oncology (ZHOU Guo-dong), The Fourth People's Hospital of Zibo, Shandong 255067, China; Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (JIN Yuan-yuan, YANG Zhao-yong)
Study on the preparation of UDP-N-acetylmuramic acid (UNAM) and culture of DC-CIK cells using UNAM as an inducer, in order to enhance the activity and improve the recognition and killing effect of DC-CIK on tumor cells.Through the design ofenzymatic reaction route to synthesize peptide UNAM, theenzymatic reaction system was constructed, and the final product was purified and collected by preparative liquid chromatography. DC-CIK cells were induced by conventional culture method in the presence or absence of UNAM, and the therapeutic effect of the DC-CIK cells on tumor bearing mice was observed.Four enzymes, NahK、GlmU、MurA and MurB, involved in the biosynthetic pathway of UNAM were obtained byheterologous expression system. UNAM, an intermediate in the biosynthesis of peptidoglycan from mycobacterial cell wall, was successfully synthesized by the enzymatic reaction. In animal experiments, the therapeutic effect of UNAM-DC-CIK cells on tumor bearing mice was better than that of DC-CIK cells cultured by conventional methods, and the survival time is longer. The longest survival time in the UNAM-DC-CIK treatment group, DC-CIK treatment group and control group was 43 days, 38 days and 25 days, respectively.The proliferation and killing ability of UNAM-DC-CIK cells cultured with UNAM were higher than that of DC-CIK cells cultured by conventional methods.
polypeptide UNAM; biosynthesis; DC-CIK cells; anti-tumor
s: JIN Yuan-yuan, Email: jinyuanyuan@imb.pumc.edu.cn; ZHANG Zhi-fei, Email: zhangzhifeifei7208@ 163.com
10.3969/j.issn.1673-713X.2021.04.005
河北省自然科学基金(B2020209001);国家自然科学基金面上项目(81872782);国家自然科学基金国际(地区)合作与交流项目(81761128016)
金媛媛,Email:jinyuanyuan@imb.pumc.edu.cn;张志斐,Email:zhangzhifeifei7208@163.com
2021-02-20
*同为第一作者

