植物根际促生菌促进小麦生长及提高其抗旱性的研究进展
温宏伟 杨 斌 王东胜
(1有机旱作山西省重点实验室,山西 太原 030000;2山西农业大学小麦研究所,山西 临汾 041000;3山西师范大学,山西 临汾 041000)
小麦(Triticum aestivumL.)是我国主要粮食作物之一,其种植面积和总产量仅次于水稻和玉米,保障小麦产业稳定发展对我国粮食安全具有重要的战略意义[1]。干旱胁迫是影响小麦生长发育与产量形成最主要的非生物胁迫因子,在小麦各发育时期均会引起一系列异常的代谢反应。尽管新品种的选育被视为抵御干旱胁迫最经济、有效的手段,但育种周期长、遗传基础逐渐狭窄等问题导致新品种的产量与抗旱性在短期内难有突破性进展[2]。因此,探索能够快速提高小麦抗旱性且对生态环境友好的方法,在干旱胁迫环境下保障小麦正常生长发育以及产量稳定形成是旱作农业工作者追寻的目标。
植物根际促生菌( plant growth promoting rhizobacteria,PGPR)是生活于植物根际或定殖于根系表面的一类促进植物生长的有益菌株。PGPR 不仅可以协助小麦高效利用养分资源,促进产量的形成,还能够通过自身作用或产生多种代谢产物协助小麦抵御干旱等非生物胁迫[3-5],这对于保障干旱、半干旱地区小麦产量正常形成,促进产业可持续性发展具有重要的生态效益与经济效益[6]。鉴于此,本文概括总结了PGPR 促进小麦生长、提高其抗旱性的生理机制与分子机制,旨在为利用PGPR 协助小麦抗旱促生的应用研究奠定基础。
1 PGPR 促进生长的作用机理
根据与植物的相互作用关系,PGPR 可划分为自由活动的根际菌和共生的根际菌两类,前者直接与植物交换代谢产物,增加其吸收利用某些营养元素的能力;后者主要通过增加植物根系的表面积,间接促进养分吸收[7]。表1 总结了部分PGPR 促进小麦生长的作用机制与作用效果。

表1 部分PGPR 促进小麦生长的作用效果和机制Table 1 Effect and mechanism of partial PGPR on wheat growth
1.1 活化土壤养分并协助植物吸收养分
氮是植物合成氨基酸和蛋白质的必需元素,固氮螺菌(Azospirillum)、弗兰克氏菌(Frankia)可以与小麦、玉米等根系形成非专一性共生关系,将大气中的氮转化为铵态氮,为非豆科宿主提供可利用氮素[13,23-24],这种非专一性共生对作物产量的提高具有重要意义。磷是植物合成核酸和蛋白质的必需元素,虽然土壤中全磷含量较高,但能被植物直接吸收利用的较少。一些亲和性解磷微生物具有溶解磷酸盐的能力[8-9,24-25],可通过分泌有机酸等物质将土壤中一些难溶解的磷酸盐转化为H2PO4-和HPO42-,从而提高土壤有效磷含量[26-27];一些真菌通过与植物根系形成共生结构,作为根系额外的吸收器官扩大吸收范围,帮助植物吸收更多的磷[18,28-29]。钾元素是多种植物酶系统的调节剂,也是多种作物的品质元素。环状芽孢杆菌(Bacillus annulus)和胶质芽孢杆菌(Bacillus glia)可通过分泌草酸、柠檬酸等有机酸类物质将固定态的钾转换为络合的缓效钾,以提高植物对钾的吸收效率[12,30-32];同时,溶钾细菌可以提高土壤中蔗糖酶、脲酶以及磷酸酶活性[31,33],将土壤中的无效钾转换为速效钾。
此外,部分PGPR 可以产生低分子量的铁结合蛋白,螯合土壤中不易被植物吸收利用的Fe3+[15,22,34-35];一些芽孢杆菌和假单胞菌则可通过释放有机酸降低土壤pH 值来活化土壤中的锌[36],促进植物对铁、锌等微量元素的吸收[11]。
1.2 产植物激素
植物激素在植物体内含量极低,但其对植物生理、生化及形态发育有着重要影响。IAA 作为长距离信号物质直接或间接调控植物的多个发育进程。低浓度的IAA 可以刺激初生根的伸长,而高浓度的IAA 则抑制初生根伸长,并刺激根毛与侧根的形成。芽孢杆菌可利用植物根系分泌的色氨酸产生IAA,促进根长与根表面积增加,提高根系吸收养分的能力[8,37];假单胞菌P20[38]、变形杆菌[15]、链格孢霉属真菌[20]和天蓝色链霉菌[21]等可通过分泌IAA,促进植物不定根的形成,增加其根长和根干重,提高其吸收水分和养分的能力[38]。CTK 刺激植物的细胞分裂和维管分化,并诱导根毛的增殖。芽孢杆菌可产生CTK,促使幼苗的侧根更加发达,增加其吸收养分的能力[10];枯草芽孢杆菌(Bacillus subtilis)、蜡样芽孢杆菌(Bacillus cereus)可通过产生CTK 调节植物叶片气孔的开闭,提高植物在逆境下的光合效率[39-40]。GA 是调控细胞凋亡的关键因素,部分PGPR 具有产GA 的能力,如成团泛菌(Pantoea agglomerans)RK-92[41]、易变链霉菌[22]通过刺激植物幼苗合成GA、水杨酸(salicylic acid,SA)和IAA 来调控其生长。
一些PGPR 自身不产植物激素,但可以诱导宿主产生激素物质,促进其生长发育。如巴西固氮螺菌Sp245 的IPDC基因通过调控IPDC 酶参与IPyA 途径诱导植物产生IAA[42];荧光假单胞菌(Pseudomonas fluorescens)F113 产生的代谢产物2,4-二乙酰间苯三酚(2,4-diacetyl phloroglucinol,DAPG)可以诱导IPDC基因在植物中的表达,促进IAA 产量的增加[43]。
1.3 产胞外多糖与挥发性有机化合物等代谢产物
胞外多糖是某些PGPR 在代谢过程中分泌到细胞壁外的一类糖类化合物,不仅可以形成纤维状网络促进PGPR 在植物根际的定殖[44],还能促进土壤团聚体的形成,提高土壤的保水保肥能力[45]。此外,胞外多糖能够保持根系周围较高的水势,增加植物对养分的吸收[15,46-47];还可以改善土壤环境,增加土壤酶活性,促进植株生长[48]。
挥发性有机化合物(volatile organic compounds,VOCs)是一类具有高蒸气压的亲脂性液体,可以参与有机体之间的通信、细胞间的信号传递等过程[49]。假单胞菌可通过释放VOCs 调控γ-谷氨酰水解酶、二磷酸核酮糖羧化酶/加氧酶(bisphosphate carboxylase/oxygenase,Rubisco)大链蛋白的表达,促进植物根、茎的生长[50];枯草芽孢杆菌产生的VOCs 可通过调节与细胞壁结构相关基因的表达来调控植物生长[51-52];粪产碱杆菌(Alcaligenes faecalis)产生的己二酸和丁酸等VOCs 可介导植物IAA 和GA 的合成,促进植物根系的生长[53]。
1.4 提高植物抗病性
植物根系通过分泌粘液等物质吸引土壤微生物在其根际聚集[54],其中一些植物病原菌会与植物根系生态位进行结合,诱发植物病害。PGPR 主要通过3 种方式实现对植物病原菌的生物防治,提高植物的抗病性,间接促进植物生长。第一,通过竞争,PGPR 可成功地在植物根区定居,避免病原微生物与植物根系生态位的结合,有效降低植物发病率[55],如粘细菌(Myxobacteria)对植物根系分泌的麦芽糖和麦芽糖醇具有趋化作用,从接种部位向根系进行迁移,增强其在植物根区的定殖能力,同时粘细菌又以其他有害土壤微生物为食,抑制病原菌的生长[56];第二,部分PGPR产生几丁质酶和β-葡聚糖酶等水解酶破坏尖孢镰刀菌(Fusarium oxysporum)[57]、立枯丝核菌(Rhizoctonia solani)和疫霉菌(Phytophthora capsici)[58]等病原真菌的细胞壁,抑制其生长,最终提高植物抗病性,如变形杆菌[15]及易变链霉菌[22]接种小麦可以保护幼苗免受镰刀菌的侵染,炭疽菌属真菌接种小麦可降低纹枯病的发病率[19];第三,植物受到病原菌危害时,假单胞菌等PGPR 可以诱导植物产生茉莉酸(jasmonate acid,JA)和SA,激发植物防御系统[59],调控愈伤组织中酚类化合物和甲壳素的合成,进而提高植物的抗病性[60]。
2 PGPR 协助小麦抵御干旱胁迫的研究进展
一些有益的细菌、丛枝菌根真菌及部分放线菌不仅能促进小麦生长,还可以提高小麦对干旱胁迫等非生物胁迫的耐受性[61],在逆境下保障其正常的产量。表2 总结了部分PGPR 提高小麦抗旱性的作用机制。
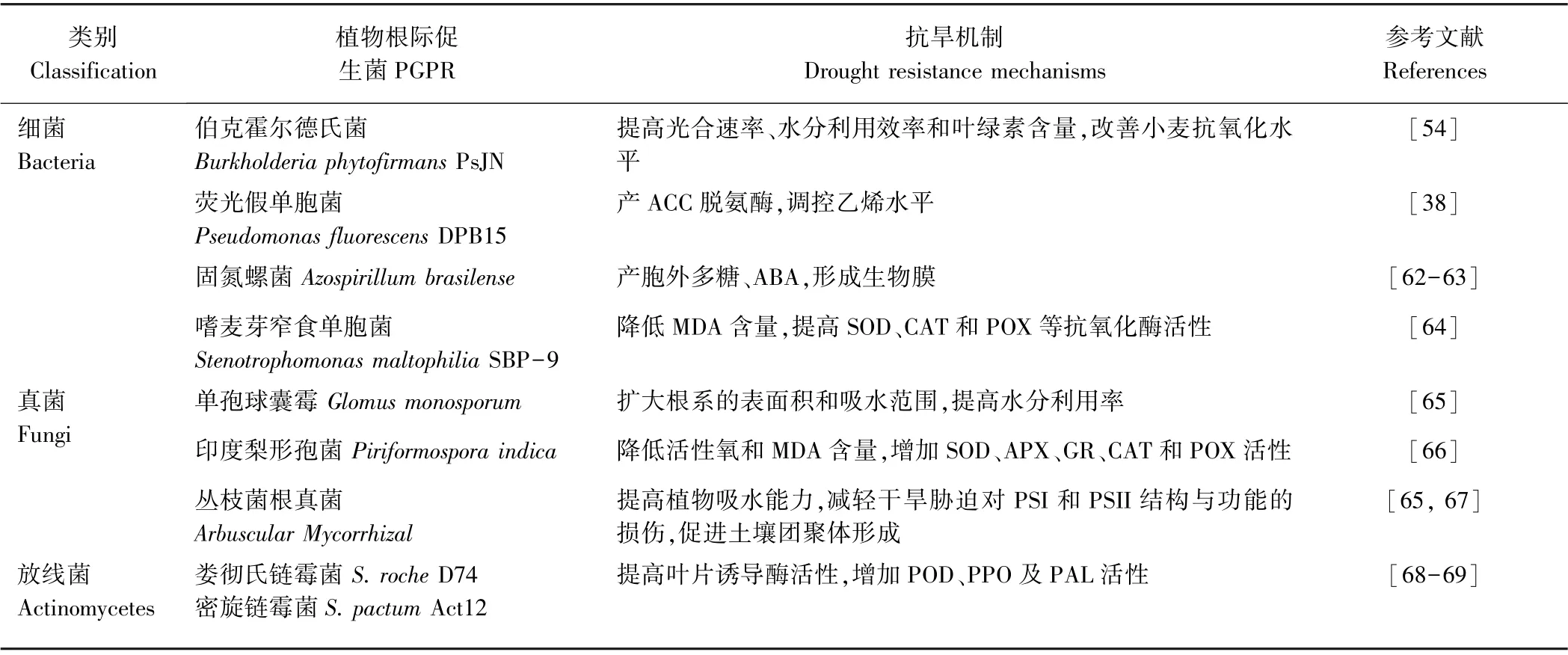
表2 部分PGPR 提高小麦抗旱性的作用效果和机制Table 2 Effect and mechanism of partial PGPR on improving drought resistance of wheat
2.1 PGPR 提高小麦抗旱性的生理效应
2.1.1 促进种子萌发,增强根部吸水 干旱胁迫下,一些PGPR 通过产胞外多糖和激素类代谢产物,促进小麦种子萌发,并通过改变根系形态等方式协助小麦获取水分,进而增强其对干旱胁迫的耐受性。固氮螺菌可以产生胞外多糖,释放脂多糖-蛋白质复合物和多糖-脂质复合物用于形成荚膜[62],保护细菌本身免受伤害,同时胞外多糖基质中含有97%的水合化合物[70],可直接为小麦种子萌发提供水分,缓解干旱胁迫[71];芽孢杆菌12D6 和肠杆菌(Enterobacter)16I 可以产生IAA 和GA,增加次生根的数量和根毛的长度,通过改变小麦根系形态帮助其获取更多的水分[72];此外,丛枝菌根真菌直径小于根毛直径,可以进入根系无法到达的土壤缝隙吸收水分,并将水分输送给根系,扩大小麦根系的吸水范围[16]。
2.1.2 调节气孔开闭,提高水分利用率 干旱胁迫会造成叶片含水量降低,影响叶片气孔导度、蒸腾速率以及CO2同化效率。一些PGPR 在干旱胁迫下可诱导小麦气孔关闭,增加叶片皮层蜡质含量,从而降低水分损耗,增强其抵御干旱胁迫的能力。伯克霍尔德氏菌PsJN 可以在干旱条件下,通过调节气孔起到改善叶片水分状况的作用,缓解干旱胁迫对小麦叶片相对含水量和CO2同化率的影响,从而提高小麦的光合速率和水分利用率[54]。干旱胁迫条件下,ABA、 SA 和JA 等激素类物质在植物与微生物互作中发挥重要作用[73]。ABA 作为调节根系导水率、根生长和气孔关闭的化学信使,在缺水条件下首先在叶片中积累,调节植物叶片气孔关闭,减少水分蒸发,后续在根和保卫细胞中出现以减轻干旱胁迫对植物的危害[74-75]。如巴西固氮螺菌可以促使小麦幼苗在干旱胁迫下产生ABA,诱导叶片气孔关闭,降低其在干旱胁迫下的气孔导度,减少水分蒸腾,增加小麦叶片的相对含水量[63]。绿脓杆菌(Pseudomonas aeruginosa)、苍白芽孢杆菌(Bacillus pallidus)通过诱导小麦释放ABA、SA 等植物激素调控其叶片气孔关闭,减少水分损失[76-78];巴西固氮螺菌和皮氏根瘤菌(Rhizobium pisi)则可促使小麦提高叶片皮层蜡质含量,降低水分蒸腾作用[14],增加小麦的抗旱能力。
2.1.3 维持细胞渗透压 干旱胁迫下,一些PGPR 通过代谢产生渗透调节物质,帮助小麦维持渗透调节能力,从而缓解干旱胁迫的影响[79-81]。链格孢菌LQ1230[20]、骆驼刺内生细菌(Pantoea alhagi)LTYR-11Z[82]和哈茨木霉菌(Trichoderma harzianum)[83]等在干旱胁迫条件下通过调节可溶性糖、脯氨酸等溶质含量,降低小麦细胞渗透压,增加其吸水能力;枯草芽孢杆菌和荧光假单胞菌在干旱胁迫下促进小麦中胆碱、甘氨酸和甜菜碱等渗透调节物质的合成与积累,调节渗透压,维持蛋白质等大分子物质的稳定性并延缓其降解[49,84-85]。
2.1.4 减轻活性氧造成的损伤 植物受到干旱胁迫时,超氧自由基、过氧化氢(H2O2)等活性氧物质会增加,使细胞膜受到较大的损伤,进而抑制植物的代谢反应。一些PGPR 可显著提高SOD、CAT、POX、APX、GR等抗氧化酶活性,构成较强的抗氧化防御系统,以减轻小麦遭受干旱胁迫引起的氧化损伤。嗜麦芽窄食单胞菌SBP-9[64]、丛枝菌根真菌[5]及印度梨形孢菌[66]接种小麦可以增加SOD、APX、GR、CAT 和POX 等抗氧化酶活性,形成有效的抗氧化防御系统,清除干旱胁迫下产生的过量活性氧自由基,延缓叶绿素和类囊体膜蛋白的降解,维持细胞器的完整性,提高小麦的抗旱性;芽孢杆菌则可在干旱胁迫下诱导小麦产生JA 和SA 等激素,并提高POX 等抗氧化酶的活性,以增强小麦对干旱胁迫的耐受性[86]。
2.1.5 延缓植株早衰,促进小麦生长 植物受到干旱胁迫时会产生过量乙烯,高浓度的乙烯会导致植物叶片脱落,根茎生长受到抑制。ACC 是植物合成乙烯的重要前体物质[87]。一些PGPR 可以产生ACC 脱氨酶,通过催化ACC 反应生成α-酮丁酸和铵[88],减少根际乙烯的合成[89],减轻根系受到的胁迫效应,有效地缓解干旱胁迫引起的早衰[38,90]。如家蚕肠杆菌(Enterobacter mori)、阿氏肠杆菌(Enterobacter asburiae)和路德维希肠杆菌(Enterobacter ludwigii)3 株产ACC 脱氨酶的PGPR接种小麦种子,在不同水分条件下均降低了小麦叶片中的ACC 含量,并在中度干旱条件下促进了小麦地上部和根系的生长[91];另外,枯草芽孢杆菌、荧光假单胞菌等PGPR 可通过产ACC 脱氨酶,催化ACC 反应生成铵,为小麦的生长提供部分氮源[90,92]。
2.2 PGPR 提高小麦抗旱性的分子生物学机制
干旱胁迫条件下,一些PGPR 会诱导植物体内抗旱相关基因的表达,从而调控胁迫蛋白做出应答,增强植物抵御干旱胁迫的能力。如丛枝菌根真菌可诱导植物中参与ABA 信号转导的D-肌醇-3-磷酸合成酶(D-myo-inositol-3-phosphate synthase,IPS)控制基因和TFT1-TFT12 基因(ABA 信号通路中的关键基因)的表达,激活水通道蛋白(GintAQPF1 和GintAQPF2),降低蒸腾速率,减轻干旱胁迫[93-94]。小麦受到干旱胁迫会抑制CTR1 蛋白(乙烯信号通路的调控成分)的表达,导致下游EIN2 蛋白的激活,调控乙烯反应基因表达,而原玻璃蝇节杆菌(Arthrobacter protophormiae)、碱湖迪茨氏菌(Dietzia natronolimnaea)和枯草芽孢杆菌可以增强小麦幼苗中TaCTR1 基因的表达,降低ACC 含量,进而提高小麦抗旱性[95]。淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)、巴西固氮螺菌可增强胁迫相关基因APX1、SAMS1 和HSP17.8 在小麦叶片中的表达,维持抗坏血酸-谷胱甘肽氧化还原循环的平衡,从而减轻干旱胁迫对小麦的危害[96]。
一些PGPR 可诱导植物代谢相关基因表达来调控IAA 的合成,促使植物在干旱条件下正常生长,进而增强其对干旱胁迫的耐受性。如芽孢杆菌5113 接种小麦后,其中一个与拟南芥生长素反应因子ARF19 高度同源的基因表达上调,诱导细胞分裂素-O-糖基转移酶上调[97],促进了小麦在干旱胁迫下的生长。固氮螺菌中吲哚-3-丙酮酸脱羧酶基因的上调促进了IAA 的合成,促使接种的小麦幼苗胚芽鞘木质部导管变宽,进而增强胚芽鞘的导水性[98]。
干旱胁迫下,一些PGPR 可以诱导植物抗逆基因的表达,调控渗透调节物质的含量以维持细胞渗透压,进而延缓干旱胁迫造成的损伤。如碱湖迪茨氏菌诱导小麦抗逆基因TaMYB33 和TaOPR1 上调,引起TaMYB和TaWRK表达,调控脯氨酸含量上升和MDA 含量下降,缓解胁迫危害[99]。恶臭假单胞菌(Pseudomonas putida)GAP-P45 在干旱胁迫下诱导小麦体内调控脯氨酸生物合成的基因,如鸟氨酸-Δ-氨基转移酶(OAT)、1-吡咯啉-5-羧酸合成酶1(P5CS1)、Δ1-吡咯啉-5-羧酸还原酶(P5CR)以及脯氨酸分解代谢酶(P5CDH)的表达持续上调[100],帮助维持细胞渗透压平衡,保护膜和蛋白质的完整性[101]。
2.3 改善土壤生态环境
干旱胁迫会加剧土壤板结,引起土壤湿度下降,造成土壤孔隙连通性降低。一些PGPR 可通过促进土壤团聚体的形成,提高土壤保水性,增强植物的抗旱能力。如丛枝菌根真菌菌丝可分泌球囊霉素,影响其周围土壤的理化性状[18,65,102],促进土壤团聚体的形成与稳定,提高土壤的持水性和小麦吸收水分的能力[103],进而增加小麦的抗旱能力;巴西固氮螺菌[62]、菜豆根瘤菌(Rhizobium phaseol)[104]等细菌则通过释放胞外多糖等黏液物质,结合土壤中的黏土与周围的矿物质颗粒,形成大的土壤团聚体,提高土壤的保水能力[105]。
农药化肥的过量使用,导致土壤退化及重金属污染等情况愈加严重,加剧了干旱胁迫对植物的危害。一些PGPR 通过溶解金属矿物,减少金属污染,改善土壤环境,间接提高植物的抗胁迫能力[106]。如枯草芽孢杆菌通过将小麦地上部和根系中的Cr6+转化为Cr3+以减轻铬毒害,同时起到了修复污染土壤的作用[107]。
3 总结与展望
PGPR 与小麦互作的研究进展表明,在干旱胁迫条件下,PGPR 可以改善土壤质地、活化土壤养分,促进小麦根系对养分与水分的吸收;通过产生的植物激素与胞外多糖等代谢产物调控小麦激素平衡,提高水分利用率,保障其正常生长发育;通过与植物病原菌竞争根系生态位并抑制植物病原菌生长,减少病害的发生,间接促进小麦生长;通过累积渗透调节物质,维持干旱胁迫条件下小麦细胞渗透压的平衡;通过产ACC脱氨酶与多种抗氧化酶减轻干旱胁迫引起的小麦衰老与活性氧损伤,并维持其细胞结构的完整性,保障其在干旱胁迫条件下的正常发育与形态建成。
由于PGPR 在大田中的实际应用效果受土壤环境(干旱、土壤pH 值)以及土壤微生物区系组成等诸多因素的影响[73],导致PGPR 制剂实际应用效果很难稳定。但现有研究多侧重于PGPR 与小麦之间的互作机理,缺乏对PGPR-小麦-土壤-土壤微生物组之间互作机理的系统性研究,滞后性的理论研究基础无法对PGPR 实际应用进行科学指导,是制约PGPR 应用于小麦生产的瓶颈。因此,未来关于PGPR 协助小麦抗旱促生的相关研究应重点围绕以下几点,从基础理论研究和实际应用两个方面开展工作。第一,在理论层面上需要借助现代分子生物学技术对PGPR-小麦-土壤-土壤微生物组之间的互作进行系统性研究,明确其作用机理,以便于科学指导PGPR 制剂在生产中的使用。第二,PGPR 菌株的分离筛选是影响其应用效果的关键环节,应尽量从北方旱地小麦根际分离筛选兼具多种促生功能的PGPR,这样所筛选到的菌株自身对干旱胁迫等不良环境具有一定程度的耐受性,可以提高其在北方旱地麦田土壤环境中的定殖率,利于其与土著微生物竞争小麦根系生态位,有助于其抗旱促生效应的稳定发挥;对于那些自身不能抵御干旱胁迫,但具有多种促生功能的PGPR,可以借助CRISPR/Cas9 基因编辑技术对其进行修饰,从而提高其自身抗逆能力。第三,结合刘玉涛等[108]前期研究经验,筛选所得的PGPR 应接种于多个小麦品种进行验证,以确保该PGPR 与不同小麦品种均具有亲和性。第四,在大田生产试验中,接种PGPR 后产量应至少较对照提高5%以上,且PGPR 制剂生产与使用成本不宜过高,否则不易大面积推广应用,结合刘玉涛等[108]前期工作基础,推荐以PGPR 菌剂包衣小麦种子为宜。随着人们对可持续农业和粮食安全的日益重视,利用PGPR 协助小麦抗旱促生将会是小麦产业可持续发展的有效策略。

