鞣花酸对心肌细胞脂毒性损伤的保护作用及其机制研究*
李梦杰,鲍翠玉,李 晶,刘 涛
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室;3.湖州师范学院;4.湖北科技学院附属第二医院)
脂毒性损伤已经成为一个公共健康问题[1-2],多项研究表明,如果游离脂肪酸水平较正常值显著升高,心脏组织的脂质沉积会增加[3-4],导致心肌细胞内活性氧(reactive oxygen species,ROS)的增加[5],这种过量的ROS可能会诱发心肌细胞凋亡和相关的心脏并发症。因此,抑制心肌细胞内ROS的升高将是保护心肌免受脂毒性损伤的可行方法。之前的一项关于游离脂肪酸诱导心肌损伤的研究表明,游离脂肪酸能够通过减弱氧化应激有效抑制心肌细胞内ROS的增加,从而防止心肌细胞出现凋亡[6]。考虑到这一点,我们拟使用某些抗氧化剂通过减轻氧化应激来抑制细胞内ROS的增加,避免脂毒性心肌损伤。基于此,本研究中我们使用棕榈酸(palmitic acid,PA)建立心肌细胞脂毒性损伤模型,检测鞣花酸(ellagic acid)对心肌细胞脂毒性损伤的影响及其机制。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
H9C2心肌细胞购自上海通派生物有限公司。DMEM培养基、胎牛血清和胶原酶均购自Gibco;丙二醛(malondialdehyde,MDA)检测试剂盒及超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自Dojindo Molecular Technologies,Inc。ROS测定试剂盒由Applygen Technologies,Inc.提供。磷酸化AMPK(p-AMPK)、总AMPK、p-哺乳动物雷帕霉素复合靶点-1(p-mTORC1)、总mTORC1、p-p70核糖体蛋白S6激酶(p-p70S6K)、总p70S6K和β-actin多克隆抗体购自Cell Signaling Technology公司。MTT检测试剂盒购自Sigma-Aldrich公司。PA、鞣花酸及其他试剂均购自Sigma-Aldrich公司。
1.2 方法
1.2.1 MTT检测细胞增殖
用2.25g/L葡萄糖、10%胎牛血清、100U/mL青霉素和100mg/mL链霉素的DMEM,在37℃、5%CO2的培养箱中培养H9C2心肌细胞。将H9C2细胞以1×105细胞/孔的密度接种于96孔板,孵育24h后,细胞分组给药,37℃下进行孵育,孵育结束后每个孔加入MTT,在37℃下孵育4h后丢弃培养基。每个孔加入150μL的DMSO,震荡混匀后,用分光光度计测量570nm处的吸光度。实验重复3次。
1.2.2 ROS水平检测
我们用Dihydroethidium(DHE)(ex=535nm,em=610nm)检测细胞内超氧化物阴离子。H9C2细胞接种于6孔板(2×104个细胞/孔)中,培养24h,细胞贴壁后,分组给药,即分别在37℃暴露于PA(0.2mmol/L)或PA(0.2mmol/L)+鞣花酸(1、20、100μmol/L)中孵育24h。然后用冷PBS洗涤细胞,在37℃下,细胞加入DAPI孵育20min,进行细胞核染色,荧光显微镜用于观察荧光信号的强度。实验重复3次。
1.2.3 主要生化指标的测定
MDA属于细胞内氧化应激水平的评价指标,SOD属于细胞内氧化应激衰减程度的评价指标。为了检测两个指标的变化,将H9C2细胞分为不同给药组孵育24h,即PA(0.2mmol/L)或PA(0.2mmol/L)+鞣花酸(1、20、100μmol/L)。孵育结束后,细胞用RIPA裂解缓冲液裂解,4℃离心收集上清,检测蛋白含量。取100μL的上清,加入200μL的MDA测试溶液,混合后煮沸15min,冷却至室温,在4℃,12 000g离心10min。在96孔板上加入200μL上清液,使用酶标仪测定532nm处的吸光度。实验重复3次。
另一组实验中,为了检测SOD,将分组给药的细胞均质化,并将所得匀浆在4℃离心收集上清,检测蛋白含量。向离心管中添加20μL上清液和160μL NBT/酶工作液,并在4℃下孵育5min。然后将混合物加入20μL的反应起始工作液中,在37℃下孵育30min。使用上述相同的酶标仪检测560nm处吸光度。实验重复3次。
1.2.4 免疫印迹法检测蛋白表达
将培养24h的H9C2细胞分为不同给药组,即PA(0.2mmol/L)或PA(0.2mmol/L)+鞣花酸(1、20、100μmol/L),然后用RIPA裂解缓冲液裂解30min,在4℃离心收集上清,检测蛋白含量。用SDS-PAGE(8%~12%)进行蛋白的电泳分离,并转移到PVDF膜上。在室温下用5%脱脂牛奶封闭1h后,加入以下抗体进行孵育(均以1∶1 000稀释):p-AMPK(#2535),AMPK(#5831),p-mTORC1(#5536),mTORC1(#2972),p-p70S6K(#9209),p70S6K(#9202)和β-actin(#4970)。一抗孵育过夜,然后用辣根过氧化物酶连接的兔抗鼠IgG(ab6728;1∶2 000,Abcam)室温下孵育2h。最后,用ECL化学发光系统对蛋白进行显影,并用图像分析软件(GeneTools;SynGene)进行定量分析。实验重复3次。
1.3 统计学方法
GraphPad Prism v5软件中单向方差分析和Tukey检验用于统计学分析,P<0.05被认为是有统计学差异。
2 结 果
2.1 鞣花酸对PA诱发的H9C2细胞增殖损伤的影响
将不同浓度的PA与H9C2细胞孵育,通过测量细胞增殖来观察PA诱导的细胞脂毒性损伤,结果如图1A和B所示。当PA浓度>0.1mmol/L时,或当PA刺激时间>24h时,细胞增殖能力均开始急剧下降。这些数据表明,当PA浓度或刺激时间超过一定阈值时,PA会导致心肌细胞出现损伤。基于这些结果,我们认为将PA浓度设为0.2mmol/L,刺激时间设为24h,可以成功建立PA诱导的心肌细胞损伤模型,以供后续实验使用。图1C说明,鞣花酸能够有效地抵抗PA诱导的细胞损伤,与PA组相比,PA+鞣花酸组细胞增殖率出现随鞣花酸浓度依赖性上升趋势,尤其在鞣花酸浓度为20μmol/L以上时开始差异显著(P<0.01)。可见,鞣花酸可以有效阻断PA诱发的心肌细胞增殖能力的损伤。
2.2 鞣花酸对PA诱发的细胞ROS水平、MDA含量和SOD活性的影响
使用DHE作为荧光探针检测PA诱导的ROS水平,如图2(封二)所示,与对照组相比,PA给药组细胞显示更强的红色荧光,这意味着PA可以诱发细胞内ROS水平显著的升高。另一方面,与PA组相比,PA+鞣花酸组细胞内红色荧光出现明显的降低,表明鞣花酸可以阻止细胞内ROS的产生,如图3A所示,表明鞣花酸可以显著抑制PA诱发的ROS水平升高(P<0.05)。图3B、3C表明,PA诱发细胞内MDA的大量增加,同时导致SOD活性显著降低(P<0.05),并且这种变化与细胞内氧化应激水平的升高密切相关。与这些观察结果相反,20μmol/L鞣花酸可以显著抑制MDA的增加,调节SOD活性,使这两个典型指标恢复到正常细胞水平。
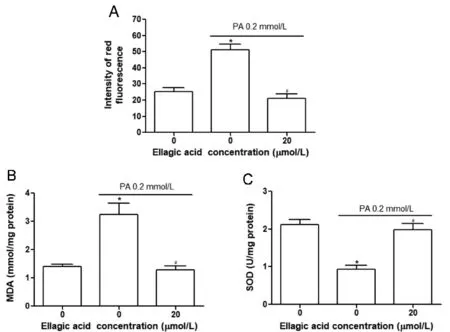
与control组比较,*P<0.05;与PA组比较,#P<0.05(n=3)
2.3 鞣花酸保护心肌细胞免受PA脂毒性损伤的可能机制
AMPK通路在调节细胞存活、氧化应激和凋亡中起着重要作用。我们用免疫印迹法分别检测了细胞中AMPK和p-AMPK以及关键下游蛋白(p-mTORC1和p-p70S6K)的表达水平。如图4A所示,与对照组相比,PA组p-AMPK明显降低,p-mTORC1和p-p70S6K明显增加,而三个蛋白的总蛋白表达无显著改变;另一方面,PA+鞣花酸组p-AMPK、p-mTORC1和p-p70S6K均恢复到对照组水平。图4B数据表明,鞣花酸能够抵消PA所致p-AMPK、p-mTORC1和p-p70S6K水平的异常变化。以上结果提示,鞣花酸可通过AMPK途径保护心肌细胞免受脂毒性损伤。
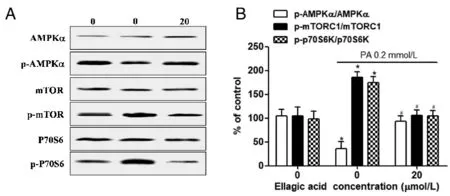
与control组比较,*P<0.05;与PA组比较,#P<0.05(n=3)
3 讨 论
心肌梗死是一种急性的致命性的心脏病[7],高脂血症通过促进心脏过度氧化应激的诱发,参与了高脂致心脏损伤的发病过程,进而导致心肌细胞出现凋亡。高脂血症与ROS的过度生成和抗氧化防御系统的受损密切相关[6],ROS生成和ROS清除系统之间平衡的破坏将使细胞内的超氧离子过度积累,导致细胞出现功能障碍和损伤。鉴于此,目前各种类型的抗氧化剂在治疗高脂血症方面被广泛研究[8]。鞣花酸属于一种天然的抗氧化保护剂[9],它可以消除过量的ROS,增强抗氧化防御能力[10-11]。在本研究中,PA可以明显增加心肌细胞内的氧化应激产物ROS及MDA的水平,并明显降低心肌细胞内抗氧化应激超氧化物歧化酶SOD的水平,而鞣花酸能显著阻断PA所致心肌细胞内ROS、MDA及SOD的变化。另一组数据证实,PA明显降低心肌细胞增殖率,预处理鞣花酸明显改善PA所致心肌细胞增殖下降。以上数据说明,鞣花酸可以明显抑制PA所致心肌细胞氧化应激损伤。
高脂血症的发生与多种因素有关[12],这些因素包括NADPH氧化酶产生超氧物、氧化磷酸化、蛋白激酶C水平异常、多元醇激活和己糖胺途径。研究表明[6],AMPK通路在调节高脂血症并发症的发生发展中起着关键作用。众所周知,AMPK是一种关键的细胞内蛋白激酶[13-15],它不仅可以调节涉及脂肪酸和葡萄糖的细胞代谢,还可以调节抗凋亡过程。激活AMPK可以防止PA诱发内皮细胞线粒体断裂和功能障碍。基于这些研究结果,本研究旨在探讨AMPK通路与心肌细胞脂毒性损伤的关系,并探讨鞣花酸是否也能通过激活AMPK保护心肌细胞免受脂毒性损伤。本研究中,PA可以明显降低心肌细胞内p-AMPK,增加p-mTORC1和p-p70S6K水平,而预处理鞣花酸组,p-AMPK、p-mTORC1和p-p70S6K均可以恢复到对照组水平。这个数据说明,鞣花酸能够通过激活p-AMPK升高到正常水平来抑制p-mTORC1和p-p70S6K,从而保护心肌细胞免受PA的脂毒性损伤。
综上所述,鞣花酸能够抑制PA诱导的心肌细胞氧化应激损伤,同时通过激活p-AMPK,降低p-mTORC1和p-p70S6K的表达,参与心肌细胞抗脂毒性损伤的作用过程,从而证实了鞣花酸具有预防心肌脂质毒性损伤的潜力。本研究主要集中在体外实验的各种检测,在下一步研究中,我们将用体内实验进一步证明鞣花酸对心肌的保护作用。
- 湖北科技学院学报(医学版)的其它文章
- 橄榄苦苷对人前列腺癌PC-3细胞增殖、迁移侵袭及凋亡的影响*

