血清TLR4、HMGB1、IL-6与非酒精性脂肪性肝病患者动脉粥样硬化的相关性
王 娟 娜 丽 张迎军 张川江
1.内蒙古医科大学附属医院内分泌科 (内蒙古自治区 呼和浩特,010050) 2.内蒙古医科大学附属医院感染性疾病科 3.内蒙古医科大学附属医院心血管内科 4.内蒙古自治区第三医院焦虑抑郁治疗中心
近年来,非酒精性脂肪肝病(NAFLD)发病率不断提高,其发病机制并不明确,但NAFLD患者常存在代谢异常,与血糖、肥胖、血脂、胰岛素抵抗、慢性炎症等均有关,且都参与动脉粥样硬化(AS)过程[1]。Toll样受体4(TLR4)属于TLR家族成员,参与机体的炎症反应,与炎性因子的表达有关[2]。高迁移率族蛋白1(HMGB1)是一种炎性因子,参与机体的炎症反应[3]。白细胞介素-6(IL-6)是一种重要的炎性因子,可加重炎性反应,损伤细胞[4]。因此,推测这3个指标与NAFLD患者发生AS有关。为了探讨血清TLR4、HMGB1、IL-6与NAFLD患者AS的相关性,本文对我院收治的116例NAFLD患者进行研究,现报告如下。
1 材料与方法
1.1 一般资料 研究对象为2017年5月至2019年1月我院收治的116例NAFLD患者。纳入标准:均经过彩超、肝功能生化检查确诊;均符合中华医学会肝脏病学分会2010年修订的NAFLD诊疗指南[5];患者知情同意;医院伦理委员会批准。排除标准:有饮酒史;病毒性肝炎、自身免疫性肝病等引起的脂肪肝;单纯性脂肪性肝病以及非酒精性脂肪性肝炎;严重肾脏疾病;急慢性感染;近期服用过影响肝功能指标的药物;恶性肿瘤;妊娠及哺乳期妇女。根据患者是否合并AS,分为两组,AS组61例,男36例,女25例;年龄38~70岁,平均(56.13±4.61)岁。NAS组55例,男34例,女21例;年龄37~71岁,平均(56.79±4.38)岁。
1.2 研究方法 ①基本资料:记录内容包括年龄、性别、病程、吸烟史、体质量指数(BMI),收缩压(SBP)、舒张压(DBP)。抽取所有患者空腹静脉血6.0 ml,经离心获得血清,检测指标包括:总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、空腹血糖(FPG),检测设备为日立7600-020型全自动生化仪及配套试剂盒。②AS检测:AS用颈动脉内膜中层厚度(cIMT)指标来评估,检测设备为德国西门子S2000彩色多普勒超声诊断仪,cIMT为管腔内膜交接面与外膜之间的垂直距离。患者仰卧位,颈部仰伸,探头频率10 MHz,测量3个心动周期,取平均值。阳性斑块定义为cIMT≥0.13 cm或突入管腔、表面不光滑的回声结构。③血清TLR4、HMGB1、IL-6检测:均采用酶联免疫吸附法(ELISA)检测,试剂盒均来自北京热景生物技术有限公司,检测设备为瑞士TECAN SPECTRA-Ⅲ酶标仪。

2 结果
2.1 两组患者基本资料的比较 两组患者性别、年龄、吸烟史、BMI、DBP、FPG、HDL-C均差异无统计学意义(P>0.05)。AS组患者病程、SBP、TC、TG、LDL-C、cIMT均显著高于NAS组(P<0.05)。见表1。
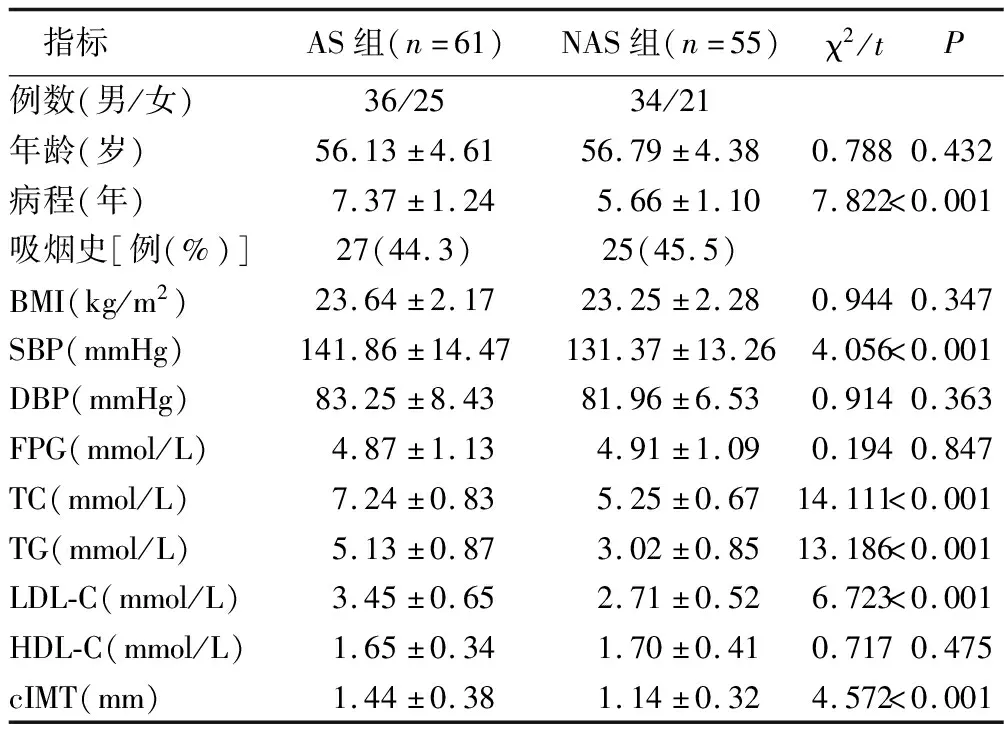
表1 两组患者基本资料比较
2.2 两组患者血清TLR4、HMGB1、IL-6水平的比较 AS组患者血清TLR4、HMGB1、IL-6水平显著高于NAS组(P<0.05)。见表2。
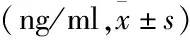
表2 两组血清TLR4、HMGB1、IL-6水平的比较
2.3 AS组患者cIMT与TLR4、HMGB1、IL-6的相关性分析 经过Pearson相关性分析,发现SBP、TC、TG、LDL-C、TLR4、HMGB1、IL-6与AS组患者cIMT均呈正相关(P<0.05)。见表3。
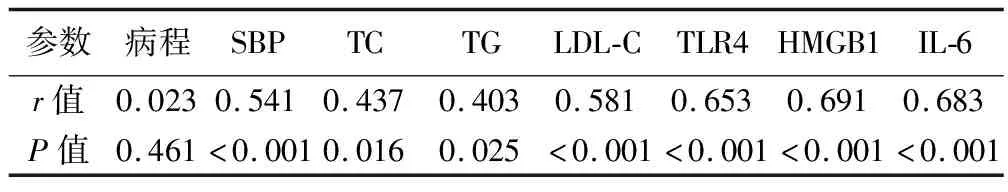
表3 AS组患者cIMT与TLR4、HMGB1、IL-6的相关性分析
2.4 AS组患者cIMT的Logistic回归分析 以cIMT为自变量,SBP、TC、TG、LDL-C、TLR4、HMGB1、IL-6为因变量,经Logistic回归分析,发现SBP、LDL-C、TLR4、HMGB1、IL-6是AS组患者cIMT的危险因素。见表4。
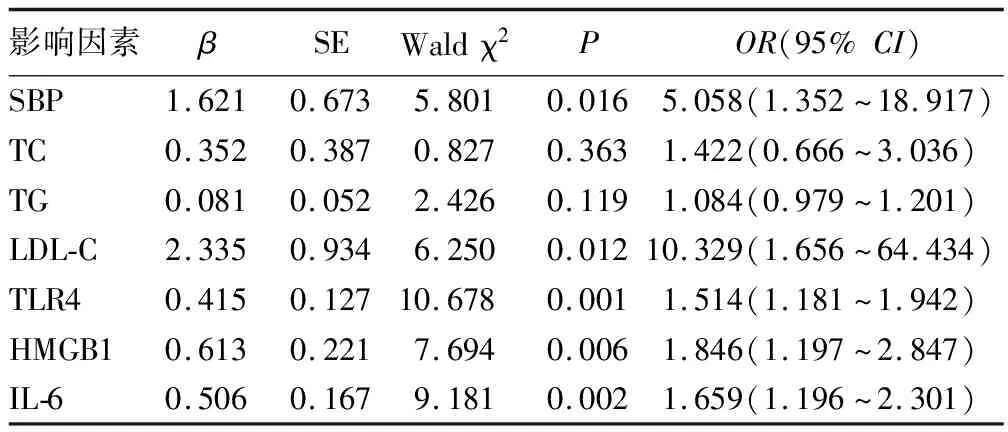
表4 AS组患者cIMT的Logistic回归分析
3 讨论
NAFLD属于一种代谢综合征,目前尚无特效治疗方法[6]。有研究表明,NAFLD患者合并的心血管疾病对其自身肝病有较大影响,因此,NAFLD与心血管疾病之间有密切关系[7]。AS是由动脉血管壁内堆积大量脂质形成的粥样硬化斑块,导致血管壁的纤维化增厚及管腔狭窄[8]。AS的危险因素包括高血脂、高血糖、高血压、吸烟、慢性炎症等,当NAFLD患者存在多个代谢异常时,病情会表现得更严重。本研究结果显示,AS组患者病程、SBP、TC、TG、LDL-C、cIMT均显著高于NAS组(P<0.05)。提示NAFLD合并AS组患者相比NAS组明显存在高血压、血脂异常等基础病变。
TLR4可以表达于多种免疫和非免疫细胞,可诱发天然免疫。有研究表明,NAFLD小鼠模型中TLR4表达明显升高,活化的TLR4可激活下游的NF-kB,导致一系列的炎症因子释放,加剧炎症反应,因此推测TLR4炎症信号与NAFLD有关[9,10]。另外,TLR4诱导分泌的多种炎症因子可引起血管炎症反应,进而促进AS斑块的形成,并导致斑块不稳定和破裂,因此对AS的发生、发展也有重要作用[11]。
HMGB1主要存在于细胞内,当机体免疫细胞被激活或组织细胞受损时,HMGB1会大量进入血液循环,产生促炎作用,还可作用于其他炎症因子,加重炎性反应,参与组织损伤[12]。有研究表明,不同类型脂肪肝患者血清HMGB1水平升高,脂肪肝的发展过程中始终伴有氧化应激和炎症反应,HMGB1作为一种促炎因子,可能通过炎症反应和氧化应激参与脂肪肝的发生、进展[13]。
IL-6主要由单核巨噬细胞和T淋巴细胞产生,具有免疫调节效应。研究表明,血清IL-6与NAFLD患者的胰岛素抵抗密切相关,且是NAFLD的独立危险因素[14]。白云等[15]研究表明,血清IL-6在AS患者中明显升高,且与AS斑块稳定性有密切关系。
本研究结果表明,AS组患者血清TLR4、HMGB1、IL-6显著高于NAS组(P<0.05)。因为TLR4、HMGB1、IL-6三者与NAFLD及AS均相关。经过Pearson相关性分析,发现SBP、TC、TG、LDL-C、TLR4、HMGB1、IL-6与AS组患者cIMT均呈正相关(P<0.05)。经Logistic回归分析,SBP、LDL-C、TLR4、HMGB1、IL-6是AS组患者cIMT的危险因素。提示SBP、LDL-C、TLR4、HMGB1、IL-6与NAFLD患者发生AS有关。分析其可能原因是NAFLD患者本身存高血压、脂质代谢异常,可引起机体慢性炎症反应,导致TLR4、HMGB1、IL-6水平升高,进一步引起血管炎症反应,促进AS斑块的形成,并导致斑块不稳定。因此,NAFLD患者很容易发生AS,对于NAFLD患者应注意监测血压、血糖、血脂及炎症因子等,以便及时发现问题,进行干预,防止不良心血管疾病的发生。
综上,TLR4、HMGB1、IL-6与NAFLD患者发生AS有关,因此应重视对NAFLD患者血压、血脂及相关炎性因子的监测和干预。

