小麦TaARF20基因克隆及表达分析
郭晓凤,王超杰,张莉莉,景豆豆,李政,都晶晶,马守才


摘要:【目的】克隆TaARF20基因,并分析其表達特性,为解析小麦生长素响应因子(ARF)基因家族成员的调控机制提供理论依据。【方法】以普通小麦为材料,利用同源克隆技术获得TaARF20基因的cDNA全长序列,利用生物信息学软件分析其序列特征,并通过亚细胞定位试验明确TaARF20蛋白的作用部位。将TaARF20基因与表达载体Pcold-TF连接,转化大肠杆菌中进行原核表达。采用实时荧光定量PCR检测TaARF20基因在普通小麦不同组织及普通小麦和多子房小麦不同发育时期幼穗中的表达模式。【结果】TaARF20基因包含1个内含子和2个外显子,编码区(CDS)长度为1116 bp,编码371个氨基酸残基,蛋白分子量约40.38 kD,理论等电点(pI)为4.96,脂溶性系数为19.80,疏水性系数为0.985,不稳定系数为50.51,属于不稳定蛋白,定位在细胞核中,含有ARF家族蛋白的保守结构域和B3 DNA结合域,主要由α-螺旋(18.06%)、无规则卷曲(59.57%)和延伸连(22.10%)组成。启动子区含有激素响应、光响应和低温响应等多个顺式作用元件。TaARF20蛋白与二粒小麦ARF20的氨基酸序列相似性最高,亲缘关系也最近。TaARF20融合蛋白在原核系统中成功表达。TaARF20基因在小麦的根、叶、幼穗和籽粒中均有表达,但在幼穗中的相对表达量最高。对于长度为3和4 cm的幼穗来说,普通小麦TaARF20基因的相对表达量低于多子房小麦,但对于长度为5、6、8和9 cm的幼穗,普通小麦TaARF20基因的相对表达量高于多子房小麦。【结论】TaARF20基因在小麦穗生长发育中发挥重要调控作用,推测其是调控穗型、穗大小或穗粒数的关键基因。
关键词: 小麦;TaARF20;基因克隆;亚细胞定位;原核表达;实时荧光定量PCR
中图分类号: S512.103.53 文献标志码: A 文章编号:2095-1191(2021)09-2350-08
Cloning and expression analysis of TaARF20 gene in
wheat(Triticum aestivum L.)
GUO Xiao-feng1, WANG Chao-jie2, ZHANG Li-li1, JING Dou-dou1,
LI Zheng3, DU Jing-jing1, MA Shou-cai1*
(1College of Agronomy,Northwest A & F University/National Yangling Agricultural Biotechnology & Breeding Center/ Yangling Branch of State Wheat Improvement Center/Wheat Breeding Engineering Research Center,Ministry of Education/Key laboratory of Crop Hetersis of Shaanxi Province,Yangling, Shaanxi 712100, China; 2Institute of Crop Science, Chinese Academy of Agricultural Sciences/Centre for Crop Genetics and Breeding/Wheat Mutation Breeding Centre, Beijing 100081, China; 3College of Life Science,Henan University/State Key Laboratory of Crop
Adversity Adaptation and Improvement,Kaifeng, Henan 475001, China)
Abstract:【Objective】To provide theoretical basis for analyzing the regulation mechanism of Auxin response factor(ARF) genes family in wheat by cloing and analyzing expression characteristic of TaARF20 gene. 【Method】The full-length cDNA sequence of TaARF20 gene was obtained from common wheat by homologous cloning technique, and its sequence characteristics were analyzed by bioinformatics. The active site of TaARF20 protein was determined by subcellular localization experiment. The TaARF20 gene was ligated with the expression vector Pcold-TF and transformed into Escherichia coli for prokaryotic expression. The expression patterns of TaARF20 gene in different tissues of common wheat and immature spike of common wheat and multi-ovary wheat at different development stages were analyzed by real-time fluorescence quantitative PCR. 【Result】Sequence analysis indicated that TaARF20 gene contained one intron and two exons, the coding region(CDS) was 1116 bp and encoded 371 amino acid residues. The molecular weight of TaARF20 protein was about 40.38 kD, theoretical isoelectric point (pI) was 4.96, fat solubility coefficient was 19.80, hydrophobicity coefficient was 0.985, and instability coefficient was 50.51 which indicated TaARF20 was an unstable protein. TaARF20 was located in the nucleus and contained ARF family domain and B3 DNA binding domain. Secondary structure analysis showed that the protein was mainly composed of alpha helix(18.06%), extended strand(59.57%), random coil(22.10%). The analysis of the promoter region revealed multiple cis-regulatory element responses, including hormonal responses, light and temperature responses. Alignment analysis of amino acid sequences and phylogenetic tree analysis showed that TaARF20 protein of common wheat had the highest amino acid sequence similarity and closest homology with Triticum dicoccoides ARF20. The result of SDS-PAGE showed that TaARF20 fusion protein was successfully expressed in prokar-yotic cells in vitro. Real-time fluorescence quantitative PCR analysis showed that TaARF20 gene was expressed differently in root, leaf, immature spike and seed of wheat, and the expression in immature spike was significantly higher than that in other tissues. The relative expression level of TaARF20 gene in common wheat was lower than that in multi-ovary wheat for immature spike of 3 and 4 cm, but higher than that in multi-ovary wheat for immature spike of 5, 6, 8 and 9 cm in length. 【Conclusion】TaARF20 gene plays an important regulatory role in immature spike of wheat, which is speculated that it may be a key gene regulating spike shape, spike size and grain number per spike.
Key words: wheat; TaARF20;gene cloning;subcellular localization;prokaryotic expression;real-time fluorescence quantitative PCR
Foundation item:Project of Seven Crops Breeding of National Key Research and Development Project(2018 YFD0100904); Shaanxi Key Research and Development Plan Project(2020NY-048);Post Subsidy Project of Shaanxi Provincial Key Laboratory(2018SZS-22)
0 引言
【研究意义】小麦(Triticum aestivum L.)是重要的粮食作物。由于近年来频繁出现的气候异常、土壤干旱和病虫害等不利于小麦的正常生长发育,严重威胁我国粮食安全(陈文烨等,2020)。生长素响应因子(Auxin response factor,ARF)基因家族成员在植物根系形成、种子发育及适应逆境胁迫中起关键的调控作用(Kepinski and Leyser,2005;Sima and Zheng,2015;苏丽艳,2019)。因此,克隆小麦TaARF20基因,并分析其表达特性,对深入解析ARF对小麦生长发育的调控作用机制具有重要意义。【前人研究进展】目前,对拟南芥ARF基因家族成员的研究较详细,研究表明AtARFs基因参与植株生长发育活动的多个阶段,且每个基因具有多种调控作用。如AtARF2、AtARF4和AtARF5基因在调节雌、雄配子体发育方面均发挥着重要作用,其下调表达或沉默会导致协同核缺陷和协同细胞活力的丧失(Liu et al.,2018),其中,AtARF2基因还调控种子发育,其突变后拟南芥种子粒大且重(Schruff et al.,2006),与油菜BnaARF18基因功能类似(Liu et al.,2015);AtARF10、AtARF16和AtARF17基因调控种子的休眠和萌发,其过表达能显著延长种子休眠时间(Liu et al.,2013;唐桂英等,2020),其中AtARF17基因在初生外壁形成和花粉壁形成中也具有关键作用(Yang et al.,2013)。水稻ARF基因家族成員的相关研究也证明其参与调控植株生长发育和逆境抵御,如OsARF19基因过表达株系出现矮杆、窄叶和叶倾角增大等多个表型特点(张胜忠等,2017);OsARF12和OsARF16基因参与铁和磷酸盐的缺乏反应,维持磷酸盐的体内稳态(Qi et al.,2011;Shen et al.,2013;Wang et al.,2014;Yu et al.,2015)。此外,番茄SlARF4基因过表达株系表现出对盐胁迫和渗透胁迫较高的耐受性(Bouzroud et al.,2020)。【本研究切入点】目前有关小麦TaARF20基因克隆及其组织表达特性的研究鲜见报道。【拟解决的关键问题】利用基因同源克隆技术克隆小麦TaARF20基因序列,利用生物信息学软件分析其序列和结构特征,并通过亚细胞定位试验明确其在细胞中的作用部位,同时采用实时荧光定量PCR检测TaARF20基因在小麦不同组织中的表达模式,为解析该基因在小麦生长发育中的调控机制提供理论参考。
1 材料与方法
1. 1 试验材料
供试材料为普通小麦和多子房小麦,种植于西北农林科技大学杨凌试验站。主要试剂:HiPure HP Plant RNA Mini Kit购自美基(上海)生物科技有限公司;HiScript 1st Strand cDNA Synthesis Kit反转录试剂盒购自诺唯赞(南京)生物科技有限公司;KOD-Plus-Neo试剂购自东洋纺(日本)生物科技有限公司;SGExcel FastSYBR Mixture(with ROX)试剂盒购自生工生物(西安)股份有限公司。主要设备仪器:ABI Life荧光定量PCR仪Q3(Thermo Fisher,美国)、T100TMThermal Cycler基因扩增仪(Bio-Rad,美国)、5810R高速冷冻离心机(Eppendorf,德国)、激光扫描共聚焦显微镜IX83-FV1200(Olympus,日本)、凝胶电泳仪(Bio-Rad,美国)等。
1. 2 试验方法
1. 2. 1 总RNA提取及反转录合成cDNA 利用HiPure HP Plant RNA Mini Kit提取普通小麦叶片、幼穗、籽粒和根的总RNA及多子房小麦幼穗的总RNA,然后参照HiScript 1st Strand cDNA Synthesis Kit反转录合成第一链cDNA,存于-20 ℃保存备用。
1. 2. 2 基因克隆及序列分析 参考Ensemble Plants数据库(https://plants.ensembl.org/index.html)中的中国春小麦的TaARF20基因序列(TraesCS7A02G4757 00.1),利用Oligo 7.0设计克隆引物TaARF20-F/TaARF20-R(表1)。以普通小麦cDNA为模板,利用KOD-Plus-Neo试剂进行PCR扩增。反应体系50.0 ?L:10×KOD Neo Buffer 5.0 ?L,25 mmoL MgSO4 3.0 ?L,2 mmoL dNTPs 2.0 ?L,10 ?moL/L正、反向引物各1.5 ?L,100 ng/?L cDNA 2.0 ?L,1.0 U/?L KOD-Plus-Neo 1.0 ?L,ddH2O补足至50.0 ?L。扩增程序:94 ℃预变性5 min;98 ℃ 30 s,64 ℃ 30 s,68 ℃ 1 min,共进行35个循环;68 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测并回收纯化目的条带,连接至T载体(Topsmart PBM16A),从而获得重组质粒T-PBM16A-TaARF20,转化大肠杆菌DH5α感受态细胞中并涂板培养。挑取单菌落,利用通用引物M13-F/M13-R进行菌液PCR鉴定后,将阳性克隆送生工生物(西安)股份有限公司测序。
利用DNAMAN 6.0将测序结果与参考基因序列进行比对分析,并用IBS(http://ibs.biocuckoo.org/)绘制基因结构。通过NCBI的CDD在線网站(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析该基因的保守结构域(Aron et al.,2017)。
1. 2. 3 生物信息学分析 利用ExPASy ProtParam(http://web.expasy.org/protparam/)分析TaARF20蛋白的理化性质(Gasteiger et al.,2005);采用NPS@ server(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)分析TaARF20蛋白的二级结构(Combet et al.,2000),以SubLocv 1.0(http://www.bioinfo.tsinghua.edu.cu/SobLoc/)预测TaARF20蛋白的亚细胞定位,利用PlantCare在线网站分析启动子区的顺式作用元件及生理功能。从Ensemble Plants数据库中查找下载TaARF20蛋白的不同物种同源序列,并利用MEGA 7.0构建系统发育进化树。
1. 2. 4 亚细胞定位 以测序正确的T-PBM16A-TaARF20质粒为模板,使用引物35S::TaARF20-EGFP-F/35S::TaARF20-EGFP-R(表1)扩增TaARF20基因。反应体系20.0 ?L:10×KOD Neo Buffer 5.0 ?L,2 mmoL/L dNTPs 2.0 ?L,25 mmoL/L MgSO4 3.0 ?L,10 ?moL/L上、下游引物各1.5 ?L,100 ng/?L DNA模板2.0 ?L,1.0 U/?L KOD-Plus-Neo 1.0 ?L,ddH2O补足至20.0 ?L。扩增程序:94 ℃预变性5 min;98 ℃ 30 s,64 ℃ 30 s,68 ℃ 1 min,进行35个循环;68 ℃延伸10 min。PCR产物经1%的琼脂糖凝胶检测并切胶回收目的片段,与1302EGFP载体连接,以构建35S::TaARF20-EGFP亚细胞定位载体,送至生工生物(西安)股份有限公司测序。将测序正确的载体转化农杆菌GV3101,挑取单克隆于10 mL的液体LB培养基中摇菌,然后收集5 mL农杆菌菌液,用注射缓冲液(10 mmol/L MES pH 5.6,10 mmol/L MgCl2,100 μmol/L AS)稀释至OD600=0.6~0.8,以不携带目的基因的1302EGFP空载体为对照。注射后的烟草避光培养1 d,正常条件培养1 d,最后使用激光共聚焦扫描显微镜采集叶片细胞中的荧光信号。
1. 2. 5 原核表达载体构建及诱导表达 利用引物Pcold-TF-TaARF20-F/Pcold-TF-TaARF20-R PCR扩增TaARF20基因,回收纯化目的片段,将其连接表达载体Pcold-TF上获得重组质粒Pcold-TF-TaARF20。将空载体Pcold-TF和重组质粒Pcold-TF-TaARF20分别转化大肠杆菌BL21(DE3)感受态细胞,接种于含有氨苄青霉素的液体LB培养基中,37 ℃下过夜培养。次日将菌液按1∶50扩大培养至OD600=0.6~0.8,取1 mL菌液作为对照,其余菌液中加入IPTG诱导表达16 h,通过SDS-PAGE凝胶电泳检测蛋白表达情况。
1. 2. 6 实时荧光定量PCR检测 采用SGExcel FastSYBR Mixture(with ROX)试剂盒,利用实时荧光定量PCR检测TaARF20基因在小麦不同组织及幼穗不同发育时期的表达情况,所用引物见表1。反应体系20.0 μL:2×SGExcel FastSYBR Mixture(with ROX)10.0 μL,10 μmoL/L正、反向引物各0.4 μL,100 ng/μL cDNA 2.0 μL,ddH2O补足至20.0 μL。扩增程序:95 ℃预变性3 min,95 ℃ 5 s,60 ℃ 20 s,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 1 s,共进行40个循环。溶解曲线为仪器默认设置。设3个生物学重复。按照2-ΔΔCt法计算目的基因在小麦不同组织及幼穗不同发育时期的相对表达量。
1. 3 统计分析
利用Excel 2017统计分析TaARF20基因的相对表达量,利用SPSS 22.0进行显著性分析(One-way ANOVA)。
2 结果与分析
2. 1 TaARF20基因克隆及序列分析结果
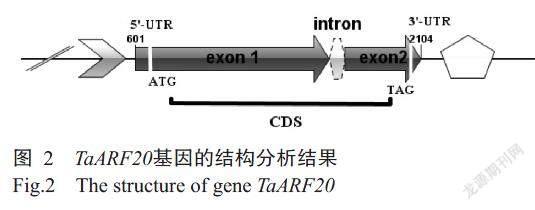
利用引物TaARF20-20F/TaARF20-20R对幼穗cDNA模板进行PCR扩增,结果(图1-A)显示,扩增条带大小约1200 bp,与预期结果相符。菌液PCR检测结果(图1-B)显示,重组质粒T-PBM16A-TaARF20已转化大肠杆菌DH5α。由图2可知,TaARF20基因包括1个内含子和2个外显子,编码区(CDS)长度为1116 bp,编码371个氨基酸残基。
2. 2 生物信息学分析结果
利用ExPASy ProtParam预测TaARF20蛋白的理化性质,结果显示该蛋白的分子量为40.38 kD,理论等电点(pI)为4.96,脂溶性系数为19.80,疏水性系数为0.985,不稳定系数为50.51,属于不稳定蛋白。NCBI的CDD分析结果显示,TaARF20蛋白含有ARF家族蛋白的保守结构域和B3 DNA结合结构域。二级结构预测结果显示,该蛋白主要由α-螺旋(18.06%)、无规则卷曲(59.57%)和延伸链(22.10%),其余为模糊状态(0.27%)。亚细胞定位预测结果显示,该蛋白定位在细胞核。
利用PlantCare分析TaARF20基因的启动子序列,结果(表2)显示,启动子区含有许多不同类型的顺式作用元件,主要涉及到激素响应、光响应和低温响应等,其中激素响应元件包括脱落酸响应元件C-ABRE(ACGTG)、ABRE3a(TACGTG)和ABRE4(CACGTA)、茉莉酸甲酯响应元件CGTCA-motif(CGTCA)和TGACG-motif(TGACG)及赤霉素响应元件P-box(CCTTTTG)等;光响应元件有H-box(TACGTG)、GATA-motif(GATAGGG)和TCCC-motif(TCTCCCT);低温响应元件有LTR(CCGAAA)。上述结果表明,TaARF20基因除了响应生长素外,还参与多种分子调控途径从而影响植物的生长发育,主要包括激素代谢、胁迫应答和光温反应等。
从Ensemble Plants数据库中查找下载TaARF20蛋白的同源序列,与拟南芥、油菜等其他物种同源序列进行氨基酸序列比对(图3),并构建系统发育进化树(图4),结果发现普通小麦TaARF20蛋白与二粒小麦ARF20蛋白的氨基酸序列相似性最高,与玉米、高粱、黍的相似性较低,表明普通小麦与二粒小麦亲缘关系最近。
2. 3 TaARF20蛋白的亚细胞定位结果
利用农杆菌介导法将35S::TaARF20-EGFP载体注射入烟草叶片表皮细胞,在激光共聚焦显微镜下观察绿色荧光信号在细胞中位置,结果显示,TaARF20蛋白定位于细胞核(图5),与上述预测结果一致,符合转录因子的基本特性。
2. 4 TaARF20基因的原核表达结果
将测序正确的重组质粒Pcold-TF-TaARF20转化大肠杆菌BL21(DE3)感受态细胞,加入IPTG进行诱导表达,并用12% SDS-PAGE进行检测,结果(图6)发现,表达产物约60 kD,除去标签蛋白后,目的蛋白TaARF20的分子量为40.38 kD,与预期结果相符。
2. 5 TaARF20基因的表达模式分析结果
采用实时荧光定量PCR检测TaARF20基因在普通小麦幼穗、叶片、籽粒和根中的表达情况,结果(图7)显示,该基因在4种组织中均有表达,但在幼穗中的相对表达量最高,其次是叶片,籽粒中的相对表达量最低,表明TaARF20基因具有明显的组织特异性。
为进一步探究TaARF20基因在普通小麦和多子房小麦幼穗中的表达差异,采集两者不同发育时期的幼穗(幼穗长度为3、4、5、6、8和9 cm),采用实时荧光定量PCR检测其TaARF20基因的表达情况,结果(图8)显示,对于3和4 cm的幼穗来说,普通小麦TaARF20基因的相对表达量低于多子房小麦,说明TaARF20基因可能在普通小麦幼穗发育早期发挥重要的调控作用;但对于5、6、8和9 cm的幼穗,普通小麦TaARF20基因的相对表达量高于多子房小麦,说明TaARF20基因可能在多子房小麦幼穗发育晚期发挥重要的调控作用。
3 讨论
前人研究结果显示,不同物种中的ARF20蛋白质氨基酸序列中均含有高度保守的ARF家族保守结构域和B3 DNA结合结构域(Ulmasov et al.,1999;Guilfoyle and Hagen,2007;Zhou et al.,2018)。本研究从普通小麦中克隆获得TaARF20基因,其含有1个内含子和2个外显子,CDS长度为1116 bp,编码的蛋白分子量为40.38 kD,含有ARF家族保守结构域和B3 DNA结合结构域,与前人研究结果一致。转录因子主要在细胞核行使其功能,但目前缺乏ARF20分布于细胞核中的证据。本研究通过亚细胞定位试验发现,TaARF20蛋白定位于细胞核。系统发育进化树分析结果显示,TaARF20蛋白与二粒小麦ARF蛋白的亲缘关系最近,表明二者可能来源于同一个祖先进化而来,且TaARF20蛋白与大麦、白菜型油菜和拟南芥等物种ARF蛋白具有较高的氨基酸相似性,暗示ARF20在植物中具有相同的生理功能。目前已有研究证实,ARF蛋白通过在生长素和其他激素之间进行信号传递,从而调控植物的生长发育(Bishopp et al.,2011;Liu et al.,2011)。本研究对TaARF20基因启动子区顺式元件的分析结果表明,TaARF20基因不僅涉及到生长素响应,还可能参与脱落酸、赤霉素和茉莉酸甲酯信号途径,因此,推测TaARF20蛋白通过脱落酸、赤霉素和茉莉酸甲酯间的信号传递从而调控小麦组织生长发育。但目前未见有关ARF20基因启动子区含有响应光照、温度的响应元件或其表达受光照、温度诱导的相关报道,但本研究发现小麦TaARF20启动子含有光照和温度响应的顺式作用元件,推测TaARF20基因对小麦生长发育的调控方式与其他物种存在差异。
多数ARFs基因表达模式具有一定的组织特异性(倪君,2011),如谷子中SiARF10基因在穗中的表达量显著高于根、茎和叶(赵艳等,2016)。本研究发现,TaARF20基因具有明显的组织特异性,其在小麦幼穗中的表达量明显高于根、叶片和种子,表明TaARF20基因在小麦穗生长发育过程中发挥重要调控作用。但TaARF20基因的调控作用机制还有待进一步研究,特别是其是否调控穗型、穗大小或穗粒数。因此,今后应通过揭示不同品种中TaARF20基因单倍型与穗发育的关系,并深入研究小麦幼穗发育基因的转录水平,以期解析TaARF20基因在小麦穗型、穗大小或穗粒数形成和发育中的调控机制。
4 结论
TaARF20基因在小麦穗生长发育中发挥重要调控作用,推测其是调控穗型、穗大小或穗粒数的关键基因。
参考文献:
陈文烨,杨帆,刘永伟,董福双,赵和,柴建芳,吕孟雨,周硕. 2020. 小麦TaNAC-B072基因的克隆和表达分析[J]. 江西农业学报,32(8):1-7. [Chen W Y,Yang F,Liu Y W,Dong F S,Zhao H,Chai J F,Lü M Y,Zhou S. 2020. Cloning and expression analysis of TaNAC-B072 in wheat[J]. Acta Agriculturae Jiangxi,32(8):1-7.] doi:10.19386/j.cnki.jxnyxb.2020.08.01.
倪君. 2011. OsIAA23介導的生长素信号胚后维持水稻根静止中心[D]. 杭州:浙江大学. [Ni J. 2011. OsIAA23-media-ted auxin signaling defines postembryonic maintenance of QC in primary roots in rice[D]. Hangzhou:Zhejiang University.]
苏丽艳. 2019. 草莓FvARF5基因的克隆、生物信息学及表达分析[J]. 华北农学报,34(3):16-22. [Su L Y. 2019. Clo-ning,bioinformatics and expression analysis of FvARF5 gene in strawberry[J]. Acata Agriculturae Boreali-Sinica,34(3):16-22.] doi:10.7668/hbnxb.201751324.
唐桂英,彭振英,徐平丽,李鹏祥,朱洁琼,单雷,万书波. 2020. 花生AhARF基因家族鉴定与表达分析[J]. 中国油料作物学报,184(6):178-188. [Tang G Y,Peng Z Y,Xu P L,Li P Y,Zhu J Q,Shan L,Wan S B. 2020. Genome-wide identification and expression analysis of auxin response factor gene family in Arachis hypogaea L.[J]. Chinese Journal of Oil Crop Sciences,184(6):178-188.] doi:10.19802/j.issn.1007-9084.2020213.
张胜忠. 2017. 水稻花器官发育基因OsARF19和粒型基因DSS的分子鉴定和功能分析[D]. 南京:南京农业大学. [Zhang S Z. 2017. Identification and functional analysis of OsARF19 gene for floral organ development and DSS gene for grain sizein rice(Oryza sativa L.)[D]. Nanjing:Nanjing Agricultural University.]
赵艳,瓮巧云,马海莲,宋晋辉,袁进成,王凌云,董志平,刘颖慧. 2016. 谷子ARF基因家族的鉴定与生物信息学分析[J]. 植物遗传资源学报,17(3):547-554. [Zhao Y,Weng Q Y,Ma H L,Song J H,Yuan J C,Wang L Y,Dong Z P,Liu Y H. 2016. Genome-wide identification and bioinformatics analysis of ARF gene family in Setaria italica[J]. Journal of Plant Genetic Resources,17(3):547-554.] doi:10.13430/j.cnki.jpgr.2016.03.022.
Aron M B,Yu B,Han L Y,Jane H,Christopher J L,Lu S N,Farideh C,Myra K D,Renata C G,Noreen R G,Marc G,David I H,Lu F,Gabriele H M,James M S,Narmada T,Wang Z X,Roxanne A Y,Zhang D C,Zheng C J,Lewis Y G,Stephen H B. 2017. CDD/SPARCLE:Functional classification of proteins via subfamily domain architectures[J]. Nucleic Acids Research,45(1):200-203. doi:10.1093/nar/gkw1129.
Bishopp A,Help H,El-Showk S,Weijers D,Scheres B,Friml J,Benková E,M?h?nen A P,Helariutta Y. 2011. A mutua-lly inhibitory interaction between auxin and cytokinin specifies vascular pattern in roots[J]. Current Biology,21(11):917-926. doi:10.1016/j.cub.2011.04.017.
Bouzroud S,Gasparini K,Hu G,Barbosa M A M,Rosa B L,Fahr M,Bendaou N,Bouzayen M,Zs?g?n A,Smouni A,Zouine M. 2020. Down regulation and loss of Auxin Response Factor 4 function using CRISPR/Cas9 alters plant growth,stomatal function and improves tomato tolerance to salinity and osmotic stress[J]. Gene,11(3):272. doi:10.3390/genes11030272.
Combet C,Blanchet C,Geourjon C,Deléage G. 2000. NPS@:Network protein sequence analysis[J]. 25(3):147-150.
Gasteiger E,Hoogland C,Gattiker A,Duvaud S,Wilkins M,Appel R,Bairoch A. 2005. Protein identification and analysis tools on the ExPASy server[J]. The Proteomics Protocols Handbook,571-607.
Guilfoyle T J,Hagen G. 2007. Auxin response factors[J]. Current Opinion in Plant Biology,10(5):453-460. doi:10.1016/ j.pbi.2007.08.014.
Kepinski S,Leyser O. 2005. The Arabidopsis F-box protein TIR1 is an auxin receptor[J]. Nature,435(7041):446-451. doi:10.1038/nature03542.
Liu J,Hua W,Hu Z Y,Yang H L,Zhang L,Li R J,Deng L B,Sun X C,Wang X F,Wang H Z. 2015. Natural variation in ARF18 gene simultaneously affects seed weight and silique length in polyploid rapeseed[J]. Proceedings of the National Academy of Sciences of the United States of America,112(37):5123-5132. doi:10.1073/pnas. 1502160112.
Liu X D, Zhan H, Zhao Y, Feng Z,Li Q,Yang H Q,Luan S,Li J,He Z H. 2013. Auxin controls seed dormancy through stimulation of abscisic acid signaling by indu-cing ARF-mediated ABI3 activation in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,110(38):15485-15490. doi:10. 1073/pnas.1304651110.
Liu Z H,Yu Y C,Xiang F N. 2011. Auxin response factors and plant growth and development[J]. Hereditas,33(12):1335-1346. doi:10.3724/SP.J.1005.2011.01335.
Liu Z,Miao L,Huo R,Johnson C,Kong L,Sundaresan V,Yu X. 2018. ARF2-ARF4 and ARF5 are essential for female and male gametophyte development in Arabidopsis[J].Plant & Cell Physiology,59(1):179-189.
Qi Y H,Wang S K,Shen C J,Zhang S N,Chen Y,Xu Y X,Liu Y,Wu Y R,Jiang D. 2011. OsARF12,a transcription activator on auxin response gene,regulates root elongation and affects iron accumulation in rice(Oryza sativa L.)[J]. New Phytologist,193(1):109-120. doi:10.1111/J.1469-8137.2011.03910.X.
Schruff M C,Spielman M,Tiwari S,Adams S,Fenby N,Scott R J. 2006. The AUXIN RESPONSE FACTOR 2 gene of Arabidopsis links auxin signalling,cell division,and the size of seeds and other organs[J]. Development,133(2):251-261.
Shen C,Wang S,Zhang S,Xu Y X,Qian Q,QI Y H,Jiang D. 2013. OsARF16,a transcription factor,is required for auxin and phosphate starvation response in rice(Oryza sativa L.)[J]. Plant Cell & Environment,36(3):607-620. doi:10.1111/pce.12001.
Sima X J,Zheng B. 2015. Advances in primary auxin-responsive Aux/IAA gene family:A review[J]. Journal of Zhejiang A & F University,32(2):313-318.
Ulmasov T,Hagen G,Guilfoyle T J. 1999. Dimerization and DNA binding of auxin response factors[J]. Plant Journal,19(3):309-319. doi:10.1046/j.1365-313X.1999.00538.x.
Wang S K,Zhang S,Sun C D,Xu Y X,Chen Y,Yu C L,Qian Q,Jiang D,Qi Y H. 2014. Auxin response factor (OsARF12),a novel regulator for phosphate homeostasis in rice(Oryza sativa L.)[J].The New Phytologist,201(1):91-103. doi:10.1111/NPH.12499.
Yang J,Lei T,Sun M X,Huang X Y,Zhu J,Guan Y F,Yang J Z N. 2013. AUXIN RESPONSE FACTOR 17 is essential for Pollen Wall Pattern Formation in Arabidopsis[J]. Plant Physiology,162:720-731.
Yu C L,Sun C D,Shen C,Wang S,Liu F,Liu Y,Chen Y L,Li C,Qian Q,Aryal B. 2015. The auxin transporter,OsAUX1,is involved in primary root and root hair elongation and in Cd stress responses in rice(Oryza sativa L.)[J]. The Plant Journal,83(5):818-830. doi:10.1111/tpj.12929.
Zhou X J,Wu X Z,Li T J,Jia M L,Liu X S,Zou Y L,Liu Z X,Feng W. 2018. Identification,characterization,and expression analysis of auxin response factor(ARF) gene family in Brachypodium distachyon[J]. Functional and Integrative Genomics,18(6):709-724. doi:10.1007/s10142-018-0622-z.
(責任编辑 陈 燕)

