FSHR基因复合杂合新变异导致高促性腺激素闭经而不孕
陈小琴,雷彩霞,奚燕萍,肖 敏
(复旦大学附属妇产科医院上海集爱遗传与不育诊疗中心,上海 200011)
卵泡刺激素(follicle-stimulating hormone,FSH)是垂体前叶腺体细胞分泌的一种糖蛋白激素,是人类生殖功能的核心激素之一,其生理功能的发挥必须通过与其特异性受体(FSH receptor,FSHR)的结合来完成。FSHR(MIM:136435;GenBank:NM_000145.4)可在颗粒细胞中严密地调控着卵泡成熟的各个阶段,以应对FSH周期性的变化。FSHR蛋白是G蛋白偶联受体(G protein-coupled receptors,GPCRs)超家族的成员之一,并具有该蛋白家族典型的七次跨膜结构域[1]。
FSHR基因致病性变异可能与高促性腺激素闭经(hypergonadotropic amenorrhea)相关[2-6],呈常染色体隐性遗传。该病患者主要表现为女性40岁前出现持续性闭经、血促性腺激素升高、雌激素降低,可分为卵巢早衰(premature ovarian failure,POF)[7]和卵巢抵抗综合征(resistant ovarian syndrome,ROS)[8-9]。POF患者的卵巢内窦状卵泡少,无卵泡或偶见少数始基卵泡;而ROS患者的卵巢内有正常数目的始基卵泡及窦状卵泡,且抗缪勒管激素(antimullerian hormone,AMH)值与年龄相符[10]。高促性腺激素闭经,一方面由于雌激素低下,患者表现出神经、代谢、心脑血管和骨质疏松等一系列机体的严重失调;另一方面,患者无排卵,表现为不孕症。FSHR基因对男性的影响相对女性而言较小。存在FSHR纯合变异的男性可能会存在不同程度的生精障碍,但并不会表现为无精或绝对的不育[6,11]。迄今为止,中国人群的FSHR基因相关变异报道较少。本研究对临床表现为高促性腺激素闭经及不孕的患者及其家系进行全外显子组测序及Sanger测序检测,探讨其遗传性致病因素,期望对其家庭生育进行指导。
1 材料与方法
1.1 对象
患者,女,1992年出生,结婚2年,性生活规律,未避孕,未孕。17岁初潮后闭经,断续人工周期治疗,正常女性核型46,XX。2020年8月20日末次月经(last menstrual period,LMP),后未规范用药,9月4日至5日有少量不规则出血2 d。2020年7月16日,激素检测FSH为15.63 mIU/mL,黄体生成激素(luteinizing hormone,LH)为8.75 mIU/mL,雌二醇(estradiol,E2)为11 pg/mL。2020年7月28日,经阴道B超提示:子宫为35 mm×34 mm×29 mm,内膜为7 mm;左卵巢为20 mm×15 mm×11 mm,卵泡直径为4 mm;右卵巢为22 mm×15 mm×10 mm,卵泡直径为5 mm。2020年9月23日,B超提示子宫位置后位,形态规则,肌层回声尚均匀,大小为39 mm×36 mm×32 mm,内膜厚度为1 mm;左卵巢为17 mm×15 mm×9 mm,有2~3个直径小于10 mm的卵泡;右卵巢为20 mm×17 mm×12 mm,有7~8个直径小于10 mm的卵泡;右卵巢旁见一无回声区,直径约6 mm,边界清,提示右卵巢旁囊肿,双侧卵巢未见明显异常,不支持卵巢早衰(图1)。2020年5月8日,AMH为2.43 ng/mL,属于正常范围。患者有一姐姐无月经来潮,未避孕,未孕多年;患者弟弟已婚,妻子孕6月,未见明显异常;患者父母非近亲,无家族性遗传性疾病史。患者及家人临床症状详情见图2及表1。本研究通过上海集爱遗传与不育诊疗中心伦理委员会批准,与患者及家属签署了相关知情同意书。
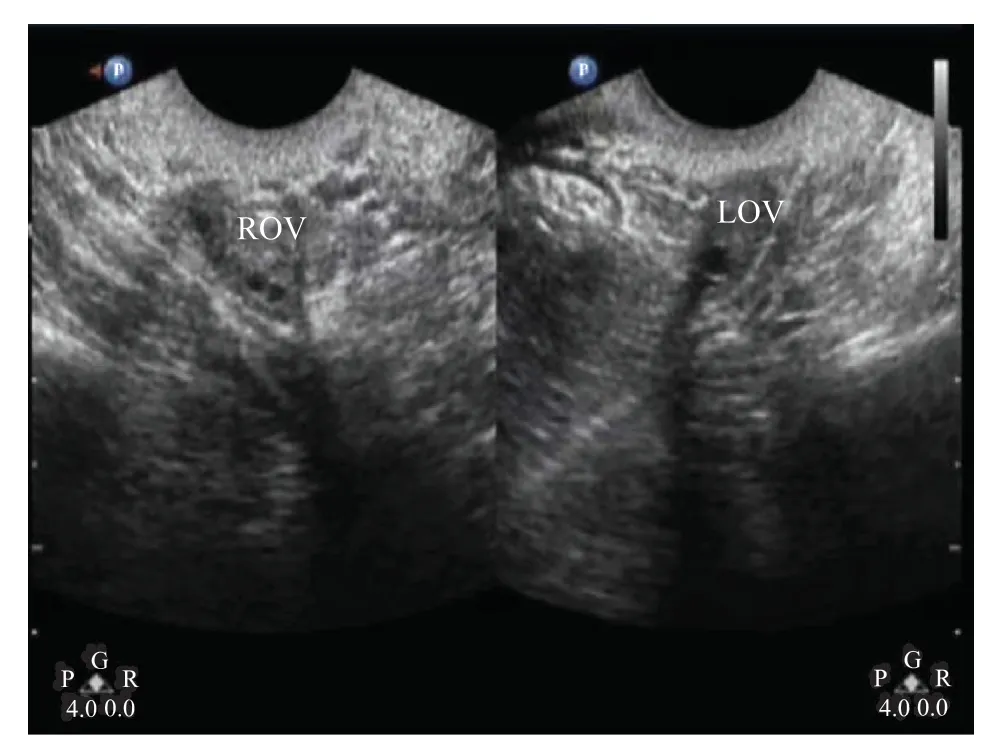
图1 患者双侧卵巢切面图Fig. 1 Cross-sectional view of bilateral ovary of the patientROV:右侧卵巢;LOV:左侧卵巢。ROV: Right ovary; LOV: Left ovary.
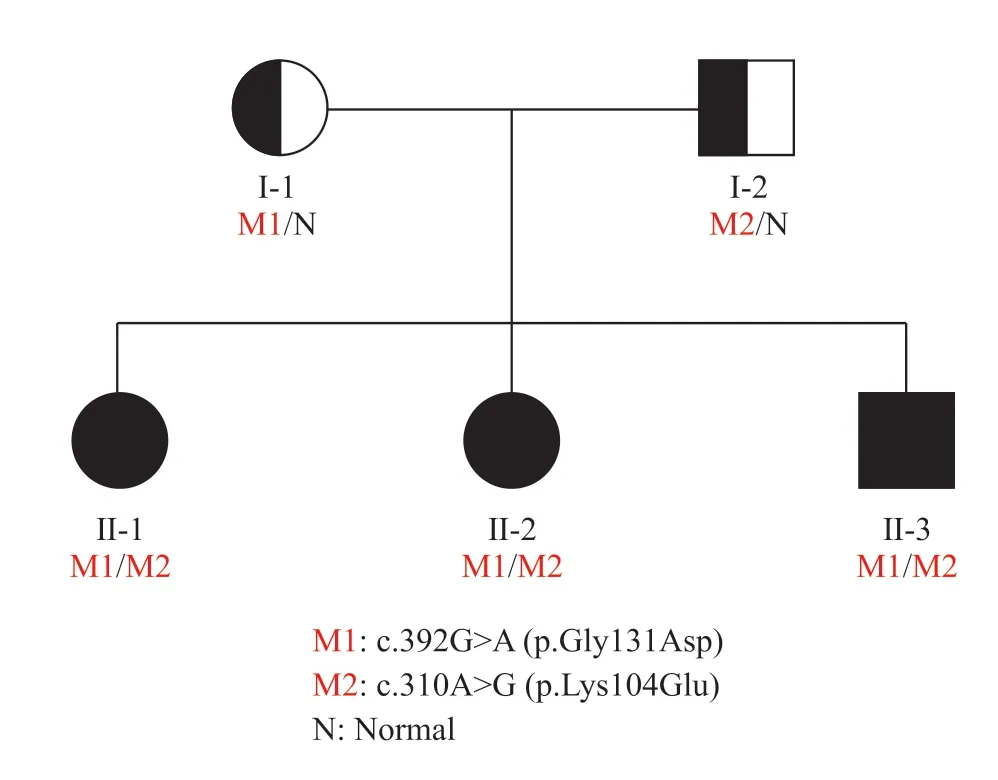
图2 FSHR基因突变家系图Fig. 2 Family Tree of FSHR gene mutationM1表示携带c.392G>A突变;M2表示携带c.310A>G突变;N表示不携带FSHR基因变异。M1 means the person carries the c.392G>A variant; M2 means the person carries the c.310A>G variant; N means the person does not carry the FSHR gene variant.
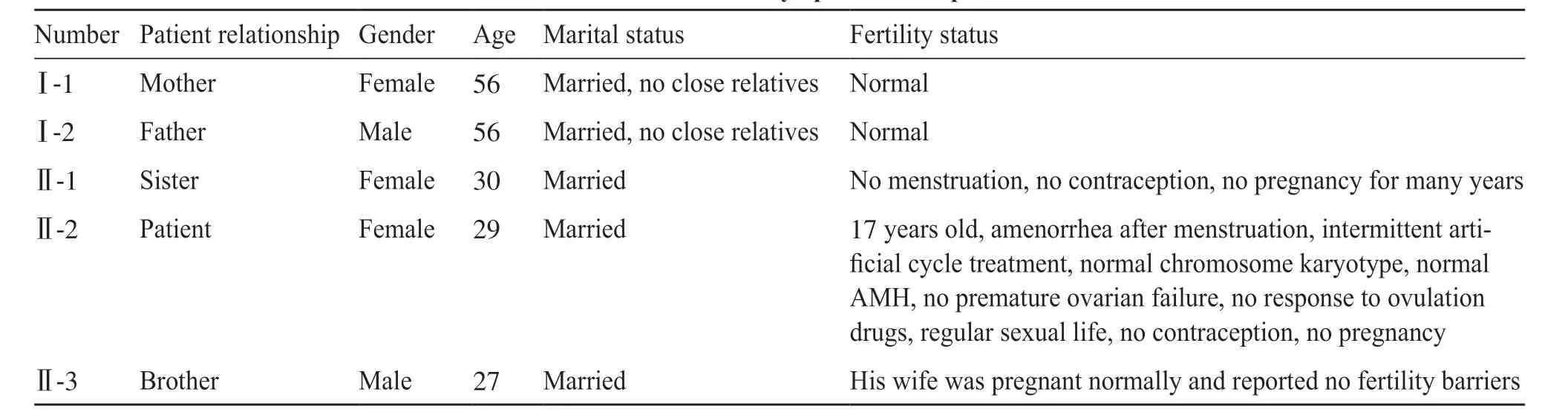
表1 患者及其家人的基本信息及临床症状Tab. 1 Basic information and clinical symptoms of the patient and her families
1.2 方法
1.2.1 全外显子组测序
在获得书面知情同意后,提取患者的外周血,使用安捷伦ClearSeq遗传性疾病试剂盒和因美纳捕获试剂盒(TruSeq v3 Cluster and SBS Kit)进行外显子组捕获。在Illumina HiSeq平台上进行全外显子组测序(whole-exome sequencing,WES)。临床外显子及其上游和下游20 bp序列的平均测序深度≥94×,富集区平均≥20×的覆盖率为97.0%。平均覆盖深度为55.8×,99.0%的目标DNA覆盖10×以上[12]。主要使用Sentieon软件套件对测序数据进行二级分析,通过Sentieon BWA与UCSC hg19参考基因组对测序数据进行比较。每个碱基的测序覆盖率均来自所有基因组测序数据。
1.2.2 全外显子组测序数据分析
使用明码生物公司(https://csa.wuxinextcode.cn)的临床测序分析系统(the clinical sequence analyzer,CSA)对测序数据进行分析,使用系统的默认设置对用户界面、原始测序数据读取以及基因组浏览器进行分析。使用系统分析可能导致蛋白质变异的纯合子或者杂合子(无义、错义、剪接位点或非编码调控区),并用明码生物公司的变异效应预测器(variant effect predictor,VEP)(评分≥0.9)评估其预测的有害影响[13]。VEP主要是利用蛋白功能损伤预测软件(sorting intolerant from tolerant,SIFT)[14]和polyphen2(polymorphism phenotype)[15-16]的信息来预测变异对基因、转录本和蛋白质序列的影响。如果该变异在之前的同行评审出版物或公共数据库[如人类基因突变数据库(HGMD专业版)、ClinVar或人类孟德尔遗传在线(online Mendelian inheritance of man,OMIM,https://omim.org/)数据库、本地数据库]中报告为致病性,则该变异将被标记为致病性或可能致病性。为了过滤出高频率的变异,我们从人群频率数据库(gnomAD,http://gnomad.broadinstitute.org/)的公共数据集中对等位基因频率进行了注释。根据美国医学遗传学与基因组学学会(American college of medical genetics and genomics,ACMG)的标准和指南[17]对与患者表型相关的变异进行分类。变异命名遵循人类基因组变异学会(human genome variation society,HGVS)的标准建议[18]。通过Alamut Visual软件[版本号为v.2.15.0(19 Feb. 2020,Interactive Biosoftware,Rouen,France)]对已鉴定的变异进行可能的有害影响预测,使用Sentieon算法和NextGENe软件(2.4.2.3版本)检测拷贝数变异(copy number variation,CNV)。
1.2.3 Sanger验证和共分离分析
提取并使用患者及其家属的外周血样本DNA,使用自动测序仪(3500XL Genetic Analyzer, Applied Biosystems,USA)从正向和反向两个方向对家庭成员的变异进行Sanger测序验证。外显子编号按照参考序列NM_000145.4(10个外显子)进行。采用Primer Premier 5.0软件设计聚合酶链反应扩增引物。采用FinchTV软件(Version 1.4.0)分析Sanger测序序列。Sanger测序所用引物有:FSHR-chr2-49217759-F1(TGGCCTCCCTATCTTTGCTAAC)、FSHR-chr2-49217759-R1(GCATCCTAATCCCCTTGTGACT)、FSHR-chr2-49244692-F1(ACCAAGTATCTCTCCACCTCCA)、FSHR-chr2-49244692-R1(CAGCAGGGAGACAGGGTTAATA)。
1.2.4 变异位点的保守性分析
使用MUSCLE(multiple sequence comparison by log-expectation)软件[19]默认参数分析 FSHR氨基酸位点的进化保守性。
2 结果与分析
2.1 全外显子组测序结果
基于患者的临床表型,选用以下人类表型标准术语(human phenotype ontology,HPO)和/或在线孟德尔遗传(online mendelian inheritance in man,OMIM)术语筛选出合适的候选致病基因:HP:0000141-Amenorrhea、HP:0000789-Infertility、HP:0008232-Elevated circulating follicle stimulating hormone level、HP:0030345-Abnormal circulating luteinizing hormone level、HP:0000137-Abnormality of the ovary、HP:0008222-Female infertility。经筛选,全外显子组测序结果显示,患者FSHR基因第5外显子存在chr2: 49217759, NM_000145.4, c.392G>A (p.Gly131Asp)错义变异(图3a),第4外显子存在chr2: 49244692, NM_000145.3, c.310A>G (p.Lys104Glu)错义变异(图3b)。
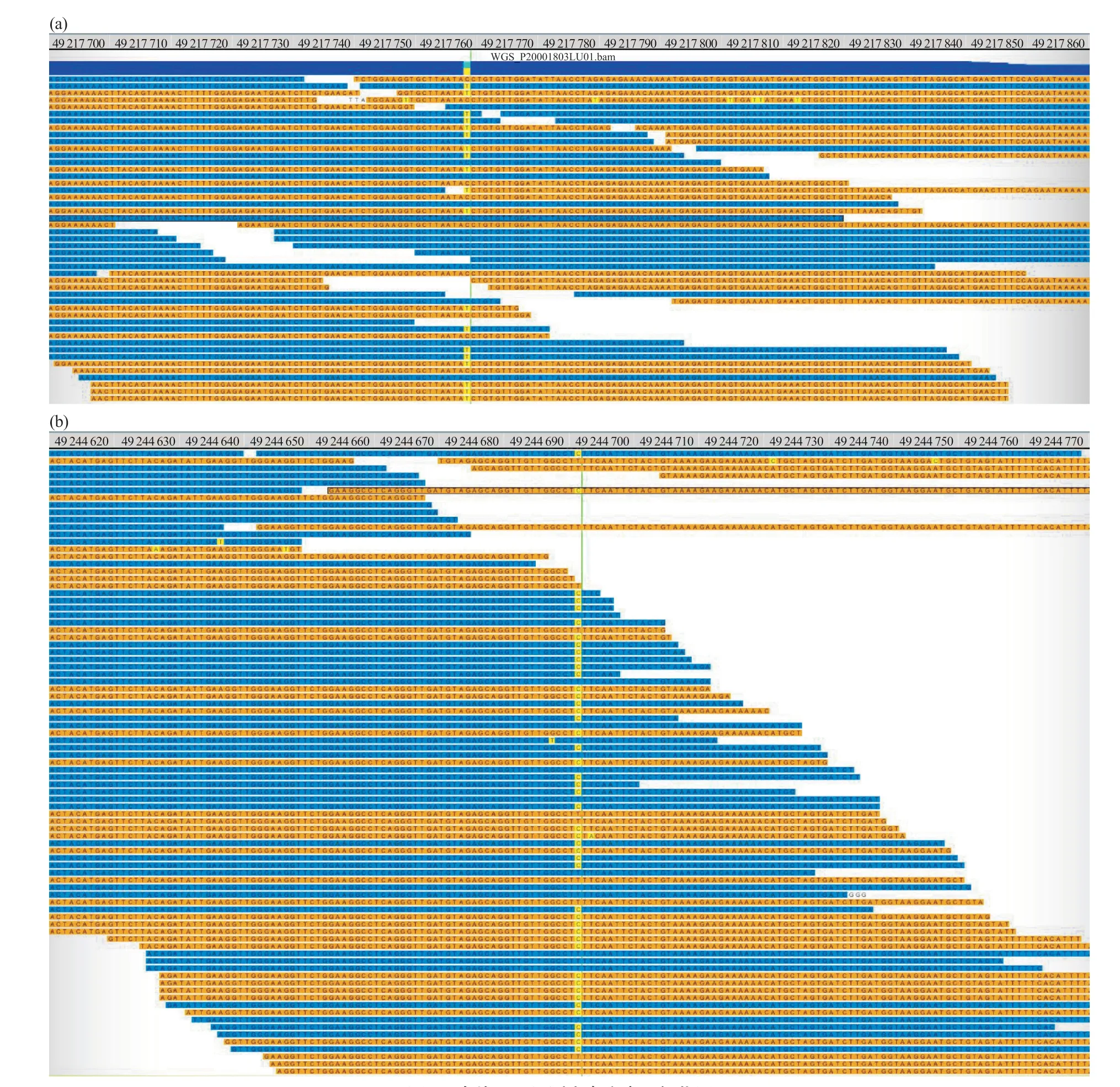
图3 全外显子组测序点突变可视化展示Fig. 3 Integrative genomics viewer for whole exome sequencing mutations(a)c.392G>A(p.Gly131Asp)可视化展示;(b)c.310A>G(p.Lys104Glu)可视化展示。第一行是染色体位置坐标。(a) c.392G>A (p.Gly131Asp) integrative genomics viewer; (b) c.310A>G (p.Lys104Glu) integrative genomics viewer. The first line is the chromosome position coordinates.
2.2 Sanger测序结果
Sanger测序发现患者母亲携带与患者FSHR基因第5外显子相同的完整变异(chr2: 49217759; NM_000145.4: c.392G>A)(图4a),其父亲携带与患者FSHR基因第4外显子相同的完整变异(chr2: 49244692; NM_000145.3: c.310A>G)(图4b),患者姐姐(图4c)和弟弟(图4d)检出与患者完全相同的FSHR基因复合杂合变异。
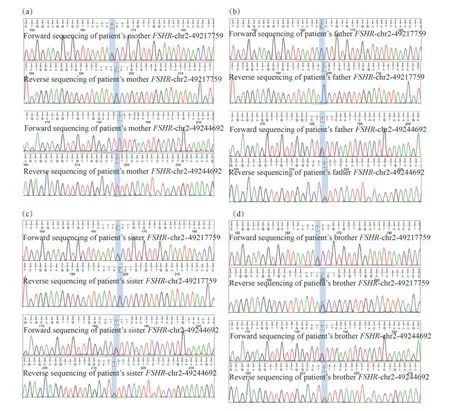
图4 患者父母及姐姐、弟弟FSHR基因变异位点Sanger测序的验证结果Fig. 4 The results were verified by Sanger sequencing of the FSHR gene mutation locus of the patient’s parents, elder sister and younger brother蓝色柱状标记为变异所在位置。 The blue bars mark the location of the mutations.
2.3 变异位点生物信息学分析
生物信息学结果显示,FSHR基因第5外显子错义变异c.392G>A(p.Gly131Asp)所在位点氨基酸在不同物种中高度保守(图5a)。根据ACMG指南[17]致病性分类可将其分为可能致病(likely pathogenic,LP)变异,证据如下。PM2:隐性基因FSHR在gnomAD外显子组数据库中纯合子等位基因频率数为0(gnomAD外显子组覆盖率为77.6%),在gnomAD基因组数据库中未发现该变异(gnomAD基因组覆盖率=31.5%),符合在正常对照人群数据库中未发现的变异(或隐性遗传病中极低频位点)证据。PP2_Supporting:FSHR基因中的37个非VUS错义变异中有31个致病性的变异,占比为83.8%,高于51.0%的阈值;临床报告的93个FSHR基因变异中有33个致病性的变异,占比为35.5%,高于12.0%的阈值,所以符合对某个基因来说,如果这个基因的错义变异是造成某种疾病的原因,并且这个基因中良性错义变异所占的比例很小,那么在这样的基因中所发现的新的错义变异,可以使用PP2_Supporting证据。PP3_Supporting:基于BayesDel_addAF、DANN、EIGEN、FATHMM-MKL、LIST-S2、M-CAP、MVP、MutationTaster和SIFT的9个致病预测与PrimateAI的1个良性预测,符合多种统计方法预测出该变异会对基因或基因产物造成有害的影响的结果。PP4:变异携带者的表型或家族史高度符合某种单基因遗传疾病。PP1:突变与疾病在家系中共分离(在家系多个患者中检测到此变异)。
FSHR基因第4外显子错义变异c.310A>G(p.Lys104Glu)所在位点氨基酸在不同物种高度保守(图5b)。根据ACMG指南致病性分类可将其分为LP,证据包括PM2、PP2_Supporting、PP3_Supporting、PP4、PP1。

图5 FSHR基因突变所在位点氨基酸在不同物种中的保守性分析Fig. 5 Analysis of conserved amino acids at the sites of FSHR gene mutations in different species (a)c.392G>A(p.Gly131Asp)所在位点氨基酸在不同物种中的保守性分析;(b)c.310A>G(p.Lys104Glu)所在位点氨基酸在不同物种中的保守性分析可视化展示。红线标注列为变异所在位点氨基酸在不同物种保守性分析。(a) The conserved analysis of amino acids at the site of c.392G>A (p.Gly131Asp) in different species; (b) The conserved analysis of amino acids at the site of c.310A>G (p.Lys104Glu) in different species. The red line indicates the conserved analysis of amino acids at the mutation site.
基于以上分析,我们认为c.392G>A(p.Gly131Asp)与c.310A>G(p.Lys104Glu)的复合杂合变异是患者及其姐姐不孕的原因。
3 讨论
人类FSHR基因定位于2号染色体短臂2区1带(2p2.1),全长约54 kb,由10个外显子与9个内含子构成,编码FSHR蛋白。其中1~9号外显子较短,编码胞外区的氨基酸部分,10号外显子负责编码其他蛋白结构。其与生殖相关疾病关系的研究一直备受关注。FSHR基因突变存在失活突变和激活突变两种形式。其中失活突变主要出现在早发性卵巢功能不全(premature ovarian insufficiency,POI)患者中,这些突变导致了FSHR基因功能的部分或全部丧失,对FSH的反应性减弱或缺乏。激活突变主要见于卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)的研究,这些突变导致FSHR功能异常活跃,对FSH的反应性增强。但FSHR基因突变具有显著的种族差异,目前仅在芬兰POI人群中报道较多,而在其他种族人群中比较罕见。
本研究检测发现的2个FSHR基因突变均为未曾报道的新突变,丰富了FSHR基因突变谱及表型谱,同时为该家系的遗传咨询和生育指导提供了依据。遗传性高促性腺激素闭经的女性患者通常表现为不孕。随着辅助生殖技术的发展,各类促排卵方案的不断涌现能够帮助许多不孕家庭成功拥有自己的后代。当突变FSHR残留部分功能时,可以尝试用高剂量的FSH来刺激卵泡发育,但是需要告知患者预期较差;当突变FSHR完全丧失功能时,对各类促排卵方案均难以有应答。如果未明确诊断则容易造成无谓的尝试,给患者的心理以及经济均带来严重的负担。根据文献报道,可以尝试卵母细胞体外成熟培养来获得成熟卵子[20],但目前未见通过该方法患者成功生育的例子,现阶段更行之有效的方案是建议患者选择捐卵。

