果蝇心脏发育标记基因Lbe抗体的制备与应用
赵梦婧,覃 彬,陈 宇,吴秀山,江志钢,万永奇
(湖南师范大学生命科学学院心脏发育研究中心,长沙 410081)
黑腹果蝇(Drosophila melanogaster)是一种应用广泛的模式生物,拥有许多独特的优点,如体型小、便于饲养管理、繁殖力强、性状易于观察等[1]。果蝇的大多数发育相关基因与人类基因高度保守,近年来其在人类发育与疾病研究领域也挥着重要作用[2]。数据表明,预计到2030年,全球死于心血管疾病的人数将达到2 300万,占据非传染性疾病致死人数的44%,是死于癌症人数的2倍[3-4]。而果蝇心脏发育过程与人类的心脏发育过程高度相似,研究果蝇心脏发育的调控机制将能为人类心脏疾病的治疗提供重要的线索[5-7]。
Lbe基因是果蝇同源框基因的成员之一,也是果蝇心脏发育的重要标记基因。它参与了果蝇的心源性途径,并在果蝇胚胎早期的成心细胞和心脏前体细胞中均有表达,与中胚层Tinman基因、Wg基因和神经基因等共同调控果蝇的心脏发育[8-10]。有研究表明,特异性干扰Lbe将会扰乱心脏中胚层内特定细胞类型的基因表达空间模式,从而导致心脏祖细胞分化与定位紊乱,如Lbe过表达将导致心脏前体细胞的异常增多,而Lbe基因失活将导致心脏循环异常等[10-13]。这表明Lbe的调控对于心脏的正常发育过程是必不可少的。因此,制备针对Lbe的抗体可以更清楚地了解该基因的表达状况,为研究其在心脏发育过程中的具体功能奠定基础。
DNA免疫是利用基因重组技术将目的基因与合适的表达载体相连作为抗原,直接免疫机体以表达相应抗体的新技术[14]。与传统的抗体制备方法相比,DNA免疫具有许多优势[15-16],如DNA免疫不需要在体外合成蛋白质作为抗原,体内表达的蛋白质可以最大程度地维持天然构象和翻译后修饰形成的独特结构,从而有助于针对天然构象抗原的高亲和力抗体的产生。基于以上优点,本文选择通过DNA免疫来制备Lbe抗体。
1 材料与方法
1.1 试验试剂及材料
试验所用的大肠杆菌菌株DH5α由本实验室保种;哺乳动物表达载体pCAGGS-P7由本实验室提供;限制性内切酶KpnI、XhoI以及2×MIX Taq酶购买自sigma公司;蛋白胨、酵母提取物、氯化钠、丙烯酰胺、通用胚胎固定液、含有0.5%牛血清蛋白的磷酸盐缓冲液(phosphate buffered saline with 0.5% bovine serum albumin,PBSBT)购买自生工公司;组织快速裂解液(radio-immunoprecipitation assay lysis buffer,RIPA)和蛋白上样缓冲液购买自康为试剂公司;RNA试剂盒购买自上海飞捷生物技术有限公司;反转录试剂盒购买自Takara公司;无内毒质粒提取试剂盒(离心柱型)购自康为试剂公司;昆明白小鼠由本动物实验室提供。
1.2 试验方法
1.2.1 引物设计与合成
在NCBI(https://www.ncbi.nlm.nih.gov/)数据库中找到果蝇的Lbe基因序列,并找出抗原性最佳的片段,随后利用Primer5.0 软件设计产物长度约为440 bp的聚合酶链式反应(polymerase chain reaction, PCR)引物。正义引物:5'CTATAGGGCGAATTGGG TACCATGCTCTGCCCTCCAACCAT 3'(划线部分是KpnI同源臂);反义引物:5'ATCGATACCGTCGACC TCGAGCGCTGCTTCTCCGAGTGACC 3'(划线部分是XhoI同源臂)。引物由北京擎科生物公司合成。Lbe蛋白的分子量大小约为51 kD。
1.2.2 基因克隆及载体构建
选取w1118野生型果蝇发育后期(10 h)胚胎50枚,使用RNA提取试剂盒提取其RNA,再进行反转录,构建cDNA文库;随后以cDNA为模板进行PCR扩增,设计梯度为53、56、59、62及65℃的退火温度,得到扩增长度为440 bp的片段。经纯化后将片段与哺乳动物载体pCAGGS-P7连接并转化至DH5α大肠杆菌中,挑取单克隆进行菌液扩大培养和测序分析。
1.2.3 重组质粒的提取
将测序正确的单克隆扩大培养后,用无内毒素质粒试剂盒进行质粒提取。质粒提取后于-20℃保存。
1.2.4 多克隆抗体的制备
将重组质粒pCAGGS-P7-Lbe免疫4周龄小鼠。分别对体型相似、性别一致的3只小鼠其后肢股四头肌注射质量浓度为500 ng/μL的重组质粒DNA 40 μL,注射完毕后立即在注射部位两侧5 mm处用细胞融合转基因仪两端电极电击3次,让质粒DNA尽快扩散均匀。分别在注射7、14、21 d后,按上述方法给这3只小鼠注射同种相同剂量质粒DNA用于加强免疫。于35 d后取血收集血清,将血清分装后加入等体积浓度为0.05%的叠氮化钠,于-80℃保存。
1.2.5 多克隆抗体的效价评价
收集的血清用于后续的蛋白质印迹(Western blot)试验检测效价。取发育后期(10 h)的w1118野生型果蝇胚胎100枚研磨,加入RIPA组织裂解液后静置10 min,待溶液澄清后加入蛋白上样缓冲液约100 μL,上下混匀后煮沸10 min,即得到蛋白样本。使用前先12 000 r/min离心1 min,取用上清。将Lbe血清抗体稀释为1∶200、1∶500后,采用Western blot试验检测多克隆抗体的特异性。相同条件下,用免疫前的小鼠血清作为对照。在果蝇发育不同时期的试验中,不同发育时间的胚胎均取用100枚,幼虫与成蝇均取用1只。
1.2.6 果蝇胚胎固定
收集胚胎后,用毛笔轻轻扫下胚胎于30%的次氯酸钠溶液中脱壳,约5 min后可在显微镜下观察到胚胎触角消失;此时用逆渗透(reverses osmosis,RO)水冲洗3~4遍,再将胚胎转入到含有胚胎固定液(4 mL正庚烷、3 mL通用胚胎固定液、1 mL甲醛)的带盖玻璃瓶中;震荡30 min后,将下层吸弃,并用RO水清洗2遍,再将胚胎吸入到装有1 mL甲醛的EP管中。
1.2.7 果蝇胚胎抗体染色
将固定好的胚胎加入到1 mL PBSBT中,摇洗1 min后,除去废液。加入1 mL PBSBT,摇洗10 min,再吸出废液。加入1 mL PBSBT,在室温摇洗1 h,进行封闭。封闭完成后,吸弃液体,加入200 μL PBSBT与1 μL一抗,室温孵育2 h。回收一抗后,加入PBSBT摇洗30 min,随后按200∶1的体积比混合PBSBT与荧光二抗,避光孵育2 h。最后PBSBT摇洗30 min后即可在显微镜下进行观察。
1.2.8 胚胎染色观察与图像处理
果蝇胚胎染色制片后使用蔡司(ZEISS)正置智能显微镜 Axio Imager M2 进行观察拍摄,拍摄所得图片使用Photoshop CS6软件进行标注编辑。
2 结果与分析
2.1 目的片段的克隆及重组载体鉴定
利用添加同源臂后设计的引物进行PCR。为了找到最适PCR退火温度,本研究设计了53、56、59、62及65℃ 5个温度梯度。PCR结果如图1所示。PCR扩增条带均一且位置符合预期,表明目的片段成功扩增。将目的片段纯化后与pCAGGS-P7质粒同源重组,构建如图2所示的pCAGGS-P7-Lbe重组载体。使用KpnI和XhoI对重组质粒进行双酶切,电泳结果显示,所得条带大小分别与载体和目的片段一致(图3)。对单克隆菌液进行扩大培养后测序,序列比对结果表明pCAGGS-P7-Lbe载体构建成功(图4)。序列比对发现重组载体中有3处点突变,分别位于171、371和431 bp处,但3处突变均为同义突变(CCG-CCA-脯氨酸;GTT-GTC-缬氨酸),不影响氨基酸序列。

图1 Lbe基因 PCR扩增的电泳结果Fig. 1 PCR amplification and electrophoresis result of Lbe geneM:DNA marker;1:53℃退火温度时PCR扩增条带;2:56℃退火温度时PCR扩增条带;3:59℃退火温度时PCR扩增条带;4:62℃退火温度时PCR扩增条带;5:65℃退火温度时PCR扩增条带。M: DNA Marker; 1: PCR amplification band at 53℃ annealing temperature; 2: PCR amplification band at 56℃ annealing temperature; 3: PCR amplification band at 59℃ annealing temperature; 4: PCR amplification band at 62℃ annealing temperature; 5: PCR amplification band at 65℃ annealing temperature.

图3 pCAGGS-P7-Lbe重组质粒Kpn I和Xho I双酶切的电泳结果Fig. 3 Double digested with Kpn I and Xho I and electrophoresis result of pCAGGS-P7-Lbe recombinant plasmidM:DNA Marker;1:pCAGGS-P7-Lbe重组质粒Kpn I和Xho I双酶切的产物。M: DNA marker; 1: The recombinant plasmid pCAGGS-P7-Lbe was double digested with Kpn I and Xho I.
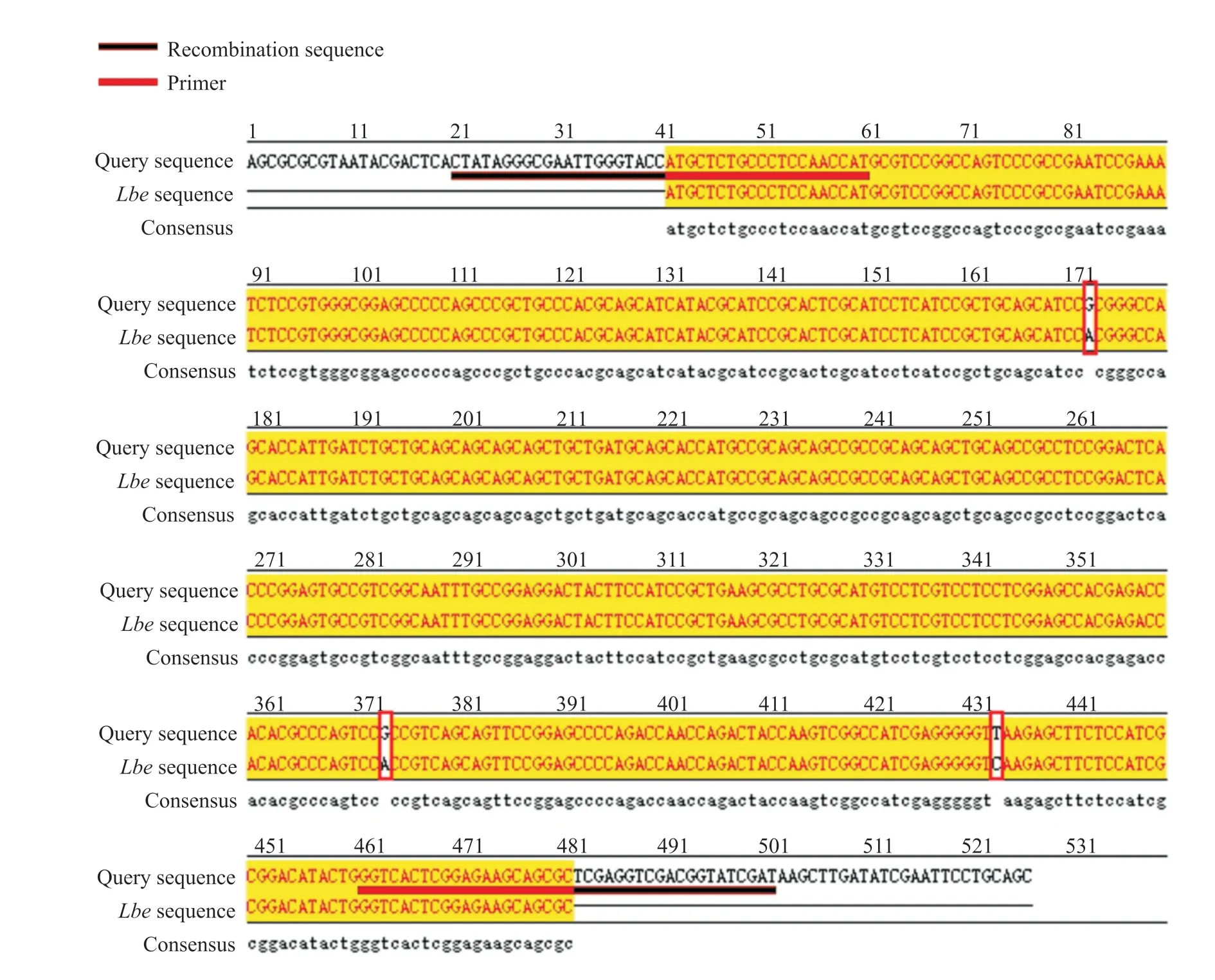
图4 pCAGGS-P7-Lbe重组质粒测序的比对结果Fig. 4 Sequencing comparison result of recombinant plasmid pCAGGS-P7-Lbe红色方框内为3处同义突变(CCG-CCA-脯氨酸;GTT-GTC-缬氨酸)。Three synonymous mutations were identified in the red box (CCG-CCA-proline; GTT-GTC-valine).
2.2 Lbe多克隆抗体的Western blot鉴定
将免疫后小鼠血清作为一抗针对野生型果蝇胚胎全蛋白进行Western blot试验,结果显示,该血清的全蛋白检测中只出现了一条蛋白带(图5a),且大小与预计的Lbe蛋白大小接近,表明该血清的特异性较好,无交叉反应。随后,对该血清使用的最佳稀释比例进行摸索,分别以1∶200、1∶500两种稀释比例进行Western blot试验(图5b、5c),结果显示当稀释比例为1:200时,条带清晰且背景干净(图5b),表明1:200为该抗血清的适宜稀释比例。所有Western blot试验均以β-actin作为内参(图5d)。

图5 抗Lbe血清特异性与适宜稀释比例检测结果Fig. 5 Specificity and appropriate dilution ratio detection results of anti-Lbe serum(a)抗Lbe血清的全蛋白检测结果;(b)血清稀释比例为1∶200时的Western blot结果;(c)血清稀释比例为1∶500时的Western blot结果;(d)β-actin抗体稀释比例为1∶1 000时的Western blot结果。(a) Whole protein detection result of anti-Lbe serum; (b) Western blot result when the dilution ratio of serum is 1∶200; (c) Western blot result when the dilution ratio of serum is 1∶500; (d) Western blot result when the dilution ratio of anti-β-actin is 1∶1 000.
2.3 Lbe蛋白在果蝇不同发育阶段的表达状况
为了深入了解Lbe蛋白在果蝇不同发育阶段的表达情况,我们利用制备的抗体检测了w1118果蝇不同时期的胚胎中Lbe蛋白的表达水平。结果显示,在胚胎中,Lbe在4 h时开始表达,在7 h和10 h时表达不断增强,但在13 h和16 h时表达有所下降(图6a)。我们认为这可能是由于Lbe基因在胚胎发育早期发挥了作用,在果蝇胚胎生殖带伸长时期便有表达,随后参与中胚层心脏前体细胞与神经系统的发育,故在此期间表达量不断增加,而在果蝇胚胎中线闭合后表达下降。为了验证上述猜想,我们选择了果蝇发育的3个不同时期,即胚胎、幼虫和成虫,检测这3个时期Lbe蛋白的表达水平。结果表明,在胚胎阶段,Lbe蛋白的表达量较高,而在幼虫阶段表达明显减少,在成蝇中基本检测不到Lbe的表达(图6b)。这与我们的猜想相一致。上述结果提示,Lbe基因在果蝇胚胎早期发育过程中发挥了重要作用,我们制备的抗体能够准确反映Lbe蛋白的表达水平。
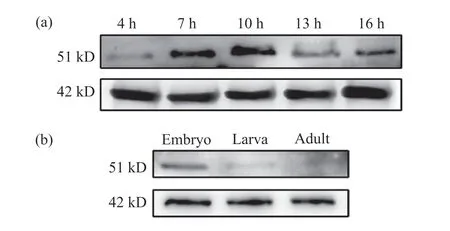
图6 果蝇不同发育时期的Lbe蛋白表达情况Fig. 6 Expression of Lbe protein in Drosophila melanogaster at different developmental stages(a)胚胎发育到4、7、10、13和16 h时 Lbe的蛋白表达;(b)果蝇胚胎、幼虫、成蝇阶段的Lbe蛋白表达。(a) The expression level of Lbe protein in Drosophila melanogaster embryo at 4, 7, 10, 13 and 16 h; (b) The expression of Lbe protein in Drosophila melanogaster embryo, larva and adult stages.
2.4 胚胎抗体染色
为了检测抗体能否用于免疫染色,我们用血清对不同发育时期的果蝇胚胎进行免疫染色,发现在stage 8时期,Lbe基因的表达集中在胚胎的肛板处(图7b)。随着发育的进行,到stage 10时期,Lbe基因的表达在胚胎内开始增加,主要集中在胚胎触角段、上下颌节段和唇部等部位,并且在胚胎边缘的神经母细胞中也能检测到Lbe的表达,肛板处的表达仍然强烈(图7c)。stage 11时期,Lbe基因的表达相较上一时期有了明显回缩的趋势,集中在上下颌节段中。值得注意的是,在位于表皮内侧的成心前体细胞中能检测到较强的Lbe表达信号(图7d)。这表明Lbe基因确实参与了成心前体细胞的发育。而在胚胎发育末期,在节段边界肌形成细胞中与表皮内侧能检测到广泛的Lbe蛋白阳性信号,并且表达Lbe蛋白的表皮内侧细胞的宽度也有所增加(图7e)。在stage 15时期,表达Lbe蛋白的成心前体细胞有向背中线迁移的趋势(图7f)。这也证明了Lbe的正确表达与果蝇心管的形成密不可分。上述免疫染色结果中Lbe阳性信号与其发育规律高度符合,表明我们制备的抗体能够精确检测Lbe蛋白的表达定位,可用于胚胎抗体染色,且效果良好。

图7 Lbe多克隆抗体胚胎染色鉴定(×200)Fig. 7 Immunofluorescence identification of Lbe polyclonal antibody (×200)(a)空白血清对照组;(b)stage 8时期的野生型果蝇胚胎(发育时间为3 h 30 min);(c)stage 10时期的野生型果蝇胚胎(发育时间为4 h 20 min);(d)stage 11时期的野生型果蝇胚胎(发育时间为7 h);(e)stage 15时期的野生型果蝇胚胎(发育时间为13 h);(f)stage 13时期的野生型果蝇胚胎(发育时间为10 h)的背观图。图中的胚胎均按照头部向左,腹部向下的姿势摆放。ap:肛板;nb:神经母细胞;de:表皮内侧;cb:成心前体细胞;mf:节段性边界肌形成细胞。黄色箭头所示均为细胞类型和特定细胞区域;白色箭头所示为细胞运动趋势。(a) Blank serum control group; (b) Wild type Drosophila embryos at stage 8 (development time 3 h 30 min); (c) Wild type Drosophila embryos at stage10 (development time 4 h 20 min); (d) Wild type Drosophila embryos at stage 11 (development time 7 h); (e) Wild type Drosophila embryos at stage 15 (development time 13 h); (f) Wild type Drosophila embryos at stage 13 (development time 10 h). All whole-mounts are oriented with the anterior to the left; (f) is the back view. ap: Analplate; nb: Mandibular segment; de: Dorsal epidermis; cb: Cardioblast precursors; mf: Segmental border muscle founder cells. yellow arrow shows cell type and specific cell area; white arrow shows cell movement trendency.
3 讨论
心脏作为身体内最重要的器官之一,从早期发育阶段就担负着全身循环的功能。在脊椎动物和无脊椎动物中,心脏起源于双侧中胚层的原基细胞,并且越来越多的证据表明,心脏谱系的分子控制机制在生物进化过程中是保守的。果蝇虽然在进化上离脊椎动物较远,但它的心管在形态上类似于脊椎动物心脏发育早期的线性管,其心管发育基因的同源物也在脊椎动物心脏发育中发挥重要调控功能。因此,本文选择果蝇为模式生物来研究心脏发育。Lbe基因会在果蝇特定的成心细胞亚群中表达,并在心脏前体的多样化中发挥作用。已有研究表明,当Lbe基因被敲除表达时,果蝇心脏前体细胞的数量会减少,而过度表达Lbe将会导致果蝇表现出心脏结构缺陷,以及心律失常、心脏停搏等症状[17-18]。Lbe基因在进化上是保守的,在小鼠和人类中已经发现同源基因[13]。
果蝇与人体的心脏发育基因具有高度保守性,故研究果蝇心脏发育基因是探索人类心脏发育基因的一条有效途径。但由于市面上的果蝇心脏基因抗体难以购得,导致果蝇心脏发育基因研究缺少合适的工具。本文通过DNA免疫技术成功制备了可用于Western blot和胚胎染色的果蝇Lbe基因的抗体。虽然与原核表达载体相比,血清抗体的效价略低,但DNA免疫的独特优点(如可以直接免疫小鼠、方法更加简便、耗时更少等)使其成为快速制备分子量较小的蛋白抗体的有效途径之一[15-17]。Western blot和免疫染色结果表明,所制备抗体的特异性和敏感性都较好,这为将来运用免疫共沉淀等方法研究Lbe基因调控果蝇心脏发育的分子机制奠定了基础。

