结核分枝杆菌DNA糖基化酶TagA的表达、纯化及晶体学研究
刘作隆,祁 祺,战博闻,耿 璐,李继喜
(复旦大学生命科学学院,上海 200438)
结核病被认定为全球十大主要死亡原因之一,其病原体结核分枝杆菌(Mycobacterium tuberculosis)也是最致命的传染病病原体之一。目前全世界大约四分之一的人口感染了结核分枝杆菌[1]。仅2019年,全球大约就有1 000万新增病例以及140万死亡病例。虽然近几年结核病病例数量正在缓慢下降,但突如其来的一场新冠肺炎疫情很可能使各国政府和世界卫生组织的努力付之一炬。根据世界卫生组织(World Health Organization,WHO)模型估算的结果,新冠肺炎疫情对公共卫生服务造成的干扰可使得发现和治疗的结核病患者人数在3个月内下降25%~50%,最终导致全球结核病死亡人数可能增加约20万~40万[2]。因此,结核病仍然是对世界公共卫生安全的一项严峻挑战。
结核分枝杆菌寄生在宿主巨噬细胞中,经常受到各种内源性和外源性因素的DNA损伤攻击,且基因组完整性对其生存和增殖至关重要[3]。结核分枝杆菌中存在强大的DNA修复系统,不仅确保其遗传物质的复制准确无误,而且在结核分枝杆菌的基因组多样化以及耐药性的发展中也发挥着重要作用[4]。DNA修复系统中的碱基切除修复(base repair excision,BER)主要用于修复单核苷酸损伤[5-6],结核分枝杆菌在这一途径中进化出了显著的功能冗余。它表达大量的DNA糖基化酶,识别和切除各种受损的碱基和DNA骨架之间的N-糖苷键,产生脱嘌呤嘧啶(apurinic or apyrimidinic,AP)位点[7]。糖基化酶可分为单功能酶和双功能酶,单功能酶仅具有糖基化酶活性,而双功能酶还具有裂解酶活性,能裂解AP位点的DNA骨架[8-9]。
作为一种单功能3-甲基腺嘌呤DNA糖基化酶,TagA目前仅在原核生物及拟南芥中发现同源序列,在结构上属于烷基化DNA糖基化酶中的螺旋-发夹-螺旋(helix-hairpin-helix,HHH)蛋白超家族。其中结核分枝杆菌来源Ⅰ型3-甲基腺嘌呤DNA糖基化酶TagA(MtbTagA)共包含204个氨基酸,理论相对分子质量(molecular weight,Mw)为21 005.10 Da,理论等电点(theoreticalpI)为7.72,最早于1998年通过基因组学鉴定出来。一直到2019年,MtbTagA的研究仍然止步于基因层面,几乎没有生理功能以及结构性质的相关报道[10]。HHH超家族糖基化酶都有一个保守的天冬氨酸残基,用于去质子化或稳定糖苷键断裂时在糖上形成的正电荷[11-12]。然而其同源蛋白大肠杆菌来源的TagA(EcTagA)却不存在这一保守残基。因此,EcTagA使用Glu38、Tyr16以及Leu44,通过氢键连接到6-氨基和N7位[13],通过与3-甲基腺嘌呤(3-methyladenine,3MA)的范德华力相互作用以及与保守的Trp侧链的传统π-π堆积来选择性地将中性的3MA结合在带正电的碱基上,以此促进受损碱基的识别和去除,维持基因组的正常复制、转录和翻译[14-15]。结核分枝杆菌的BER过程在宿主巨噬细胞维持正常生理过程中起着重要作用[16]。因此,针对BER,尤其是关键蛋白MtbTagA的研究可为发掘新型抗结核感染药物提供理论依据。
1 材料与方法
1.1 材料
表达载体pSMT3质粒[通过在pET28b(+)质粒的T7启动子后添加6×组氨酸(histidine,His)-类泛素蛋白修饰分子(small ubiquitin-like modifier,SUMO)标签改造获得]为本实验室保存;Ulp1酶购于BioVision公司;E. coliDH5α以及E. coliBL21(DE3)感受态菌株均购于上海诺唯赞生物技术有限公司;BamHⅠ和XhoⅠ限制性内切酶均购于New England Biolabs公司;卡那霉素、二硫苏糖醇(dithiothreitol,DTT)、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β -D-1-thiogalactopyranoside,IPTG)等试剂均购于生工生物工程(上海)股份有限公司;Anti-6×His tag一抗以及Goat-Anti-Mouse二抗均购于Abcam公司;3MA和次黄嘌呤(hypoxanthine,Hx)购于MedChemExpress公司;镍-氮三乙酸(nickel-nitrilotriacetic acid,Ni-NTA)介质、Superdex 200 16/600凝胶过滤层析柱、Superdex 75 10/300 GL凝胶过滤层析柱以及Q Sepharose Fast flow阴离子交换柱均购于GE healthcare公司;蛋白结晶试剂盒JCSG2 Suite、JCSG+Suite、Crystal Screen(HR2-110)、Crystal Screen 2(HR2-112)、PEG/Ion Screen(HR2-126)以及Index(HR2-144)均购于Hampton公司;Wizard I~Ⅳ购于Rigaku公司;蛋白质结晶优化试剂购于Hampton公司和Sigma公司。
1.2 方法
1.2.1MtbTagA的克隆、蛋白表达及纯化
以结核分枝杆菌Mycobacterium tuberculosisH37Ra(无毒株)基因组DNA片段作为模板扩增获得MtbTagA的基因(NP_215726.1);使用双酶切(酶切位点为BamHⅠ和XhoⅠ)以及同源重组的方法构建表达带有6×His-SUMO标签MtbTagA重组蛋白的MtbTagA-pSMT3质粒,经测序鉴定正确后将重组质粒转化到E. coliBL21(DE3)感受态细胞中用于蛋白表达。当OD600nm达到0.8时,加入终浓度为0.4 mmol/L的IPTG,在18℃条件下诱导蛋白表达20 h后,于4℃以5 000 r/min离心15 min,收集表达菌株;将菌体沉淀重悬于裂解缓冲液[50 mmol/L Tris-HCl(pH 9.0)、500 mmol/L NaCl、10 mmol/L咪唑、体积分数为5%的甘油、2 mmol/L β-巯基乙醇(β-mercaptoethanol,β-ME)、体积分数为1‰的聚乙二醇单辛基苯基醚(nonidet p40,NP40)]中,经高压破菌仪破碎,然后在4℃下以18 000 r/min离心60 min,去除细胞碎片。将收集到的上清溶液通过Ni-NTA层析柱纯化,并在含有30~250 mmol/L咪唑的缓冲液[50 mmol/L Tris-HCl(pH 8.0)、500 mmol/L NaCl、体积分数为5%的甘油、2 mmol/L β-ME]中梯度洗脱。使用Ulpl酶切除His-SUMO标签,同时透析降低咪唑浓度。酶切时,MtbTagA的质量浓度为0.05 mg/mL,Ulp1酶的质量浓度为1 mg/mL,透析缓冲液为50 mmol/L Tris-HCl(pH 8.0)、500 mmol/L NaCl、体积分数为5%的甘油,透析和酶切在4℃下过夜。通过二次Ni-NTA层析柱纯化,收集流穿样品,以去除His-SUMO标签。再用Superdex 200 16/600、Superdex 75 10/300 GL凝胶过滤层析柱以及阴离子交换柱,通过蛋白质层析纯化系统AKTA Purifier(GE)进一步纯化MtbTagA蛋白。其中凝胶过滤层析洗脱缓冲液为20 mmol/L Tris-HCl(pH 9.0)、300 mmol/L NaCl、2 mmol/L DTT;阴离子交换柱洗脱缓冲液为A液[20 mmol/L Tris-HCl(pH 9.0)、2 mmol/L DTT]和B液[1 mol/L NaCl、20 mmol/L Tris-HCl(pH 9.0)、2 mmol/L DTT]各500 mL。阴离子交换柱层析的具体方法如下:将蛋白样品通过AKTA Purifier系统上样至阴离子交换柱中,并设定梯度洗脱程序为60 min内B液所占洗脱液比例从0%匀速提高至100%,随后打开UV280、UV260以及电导率的监控设备,用于实时观测蛋白质、核酸以及盐离子浓度;将对应的上样管放入A液和B液中,点击执行,并对出峰位置处样品进行收集。使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、考马氏亮蓝染色以及免疫印迹试验(Western blot,WB)等方法鉴定蛋白性质[17]。
1.2.2 动态光散射分析
在DynaProNanoStar®(Wyatt Technology,USA)的DYNAMICS软件上完成动态光散射(dynamic light scattering,DLS)。设置温度为25℃,光源波长为658 nm,固定散射角为90°,待指示灯变绿即可上样。将MtbTagA蛋白稀释至1 mg/mL,稀释缓冲液成分为20 mmol/L Tris-HCl(pH 8.0)、300 mmol/L NaCl、2 mmol/L DTT。然后将其分为3组:第一组作为对照组添加相同体积的缓冲液;第二组添加终浓度为50 nmol/L的Hx;第三组添加终浓度为50 nmol/L的3MA。室温孵育30 min后,每组取3个样品,每个样品测量10次。统计并分析所采集参数,包括分子半径(radium,R)、粒度分布(ploydispersity,PD)和不同半径分子所占质量分数(mass fraction,MF)等。
1.2.3 结晶和数据收集
将MtbTagA蛋白样品分装并分别浓缩至1.6、2.3、3.4 mg/mL,采用气相坐滴扩散法,通过96孔结晶板以及7种结晶试剂盒,使用Gryphon LCP蛋白自动结晶工作站(Art Robbins Instruments)进行晶体初筛,并置于18℃结晶房中。3 d后,发现2.3 mg/mLMtbTagA蛋白在体积分数为22.5%的PEG 4000、100.0 mmol/L Bis-Tris(pH 4.5)、0.2 mol/L Li2SO4条件下出现针状晶体。验证其可重复后,将MtbTagA蛋白与初始结晶条件中不同浓度的沉淀剂和不同pH组成的池液以1∶1的体积比混合,并在18℃结晶房通过悬滴扩散法进行MtbTagA蛋白晶体的优化。经过几轮优化后,筛选出生长状态较好的晶体。将晶体挑入含有体积分数为25%的甘油做防冻剂的结晶缓冲液中,并在液氮中快速冷冻后保存,X射线衍射数据在BL17U1线站(SSRF,中国)收集。其衍射波长为0.979 3 Å,与探测器间的距离为250 mm。最后通过HKL2000软件将收集的数据进行整合[18]。
2 结果与分析
2.1 MtbTagA与同源家族DNA糖基化酶蛋白的生物信息学分析
通过MtbTagA的基因序列比对发现,TagA蛋白家族除了在真细菌中普遍存在以外,在拟南芥中同样发现存在8个MtbTagA同源蛋白(37%~40%的同源性)。然而,在古生菌、酵母或其他低等真核生物以及哺乳动物中没有发现同源编码序列。为了揭示DNA糖基化酶MtbTagA的潜在催化活性位点,本文将其和HHH蛋白超家族的其他同源酶类(包括大肠杆菌来源的EcTagA以及伤寒沙门氏菌来源的StTagA)通过氨基酸多序列同源比对以及云深智药蛋白质结构预测比对(https://drug.ai.tencent.com/)进行分析(图1)。结果发现:MtbTagA在二级结构上展现出经典的HHH蛋白超家族的特点,由两段螺旋结构以及中间的短链组成;与大肠杆菌来源的EcTagA以及伤寒沙门氏菌来源的StTagA同源性为35%~45%,与其他4种已有结构的同源蛋白同源性为7%~20%(未展示);它们在MtbTagA的α2、α3、α4、α7、α8、α9、α10这7个α螺旋上存在保守序列,其中亮氨酸、苯丙氨酸占比最高,两者相同特点为均具有疏水基团的侧链;在EcTagA的酶活位点(Glu38、Tyr16、Leu44)为高度保守序列。这表明MtbTagA属于HHH蛋白超家族,这3个氨基酸残基可能是其催化活性位点和辅助催化的氨基酸残基。
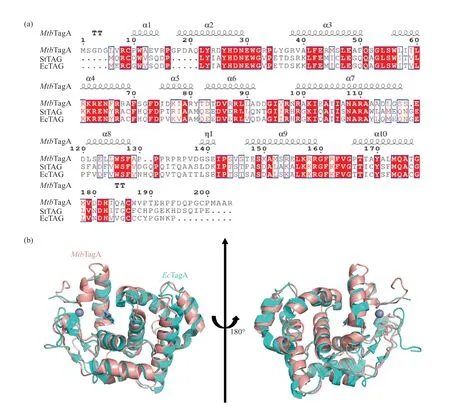
图1 Tag家族的氨基酸序列多重对比和同源建模Fig. 1 Multiple comparison of amino acid sequences of Tag family and homology modeling(a)氨基酸序列同源性比对。结核分枝杆菌来源(MtbTagA,结构来源云深智药预测);大肠杆菌来源(EcTagA,PDB ID: 1P7M;伤寒沙门杆菌来源(StTagA,PDB ID: 2OFK);(b)同源建模。红色代表MtbTagA,青色代表EcTagA,紫色代表锌原子。(a) Amino acid sequence homology comparison. Mycobacterium tuberculosis (MtbTagA, iDrug Protein Structure Prediction); Escherichia coli (EcTagA, PDB ID:1LMZ); Salmonella typhimurium (StTagA, PDB ID:2OFK); (b) Homology modeling: red represents MtbTagA, cyan represents EcTagA, purple represents zinc atom.
2.2 MtbTagA蛋白的表达与纯化
对MtbTagA的基因(NCBI ID: NP_215726.1)进行分析,根据本实验室改造的pSMT3质粒,设计MtbTagA-pSMT3质粒,如图2所示。该质粒所表达的重组蛋白6×His-SUMO-MtbTagA一共有322个氨基酸,分子量为36 394.06 Da,等电点为6.30。
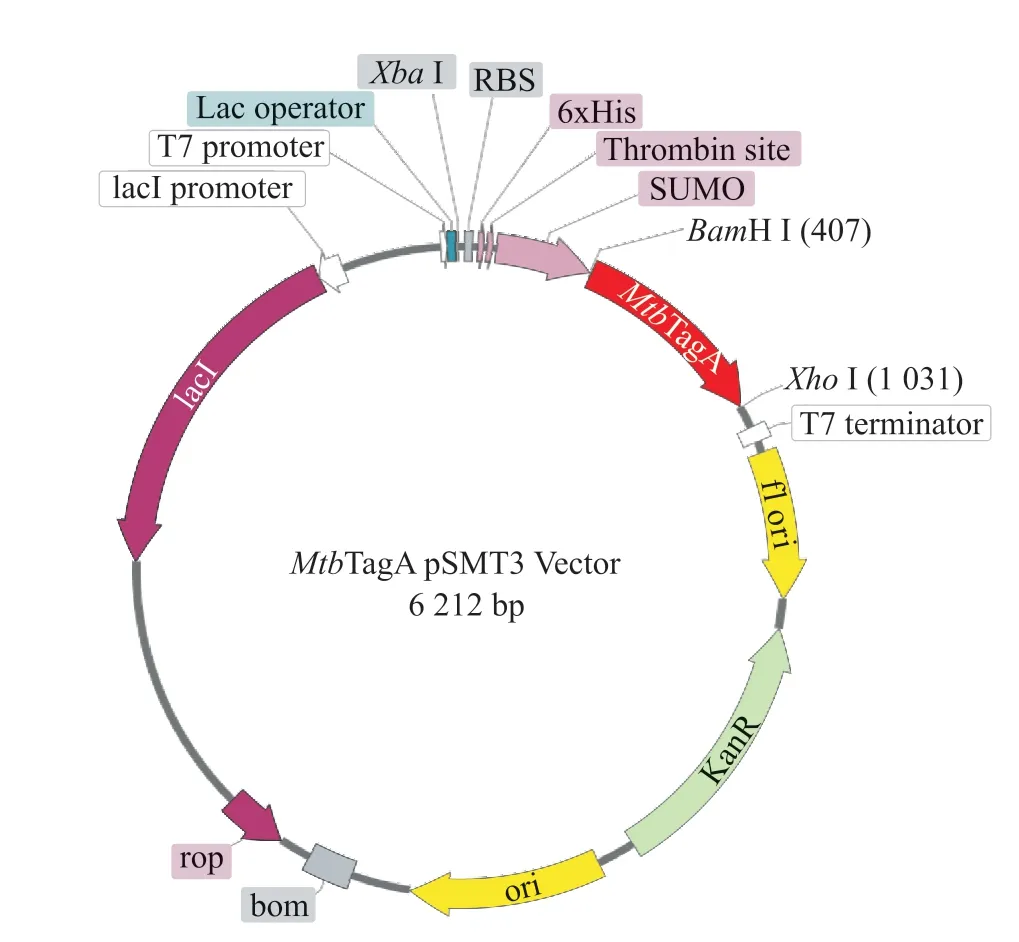
图2 MtbTagA全长重组蛋白的质粒构建框架图Fig. 2 Plasmid diagram of MtbTagA full-length fusion protein
从图3a可以看出,虽然重组MtbTagA质粒所表达的重组蛋白6×His-SUMO-MtbTagA在大肠杆菌(泳道1)中表达量较高,但是大部分在沉淀(泳道3)中,并且在二次Ni-NTA梯度洗脱杂蛋白的过程中出现大量灰色絮状沉淀。因此酶切后二次Ni-NTA的流穿样品(红框部分)中蛋白含量较低。如图3b所示,表达蛋白(泳道1~3)的确含有带有6×His-SUMO标签的重组蛋白,并且在Ulp1酶切(可特异性识别SUMO的三级结构)及二次Ni-NTA亲和层析后,所得的蛋白样品(红框部分)已去除6×His-SUMO标签。通过多次试验发现,在1.2.1的裂解缓冲液条件下MtbTagA蛋白溶解度最高。使用Superdex200 16/600凝胶过滤层析柱对去除6×His-SUMO标签后的MtbTagA全长蛋白进行纯化后发现,目的蛋白在91.6 mL洗脱液处出峰,但是存在大小接近的杂蛋白(未展示),因此,利用蛋白在不同盐离子浓度下对填料的结合能力不同,使用阴离子交换柱对其进行进一步纯化。最后在Superdex75 10/300 GL凝胶过滤层析柱上验证,发现蛋白在13.8 mL的峰上被洗脱出来,其对应分子量约为25 kD,与理论分子量21 kD基本相符合,表明MtbTagA在溶液中以单体形式存在。其洗脱样品的SDS-PAGE和考马斯亮蓝染色分析结果如图3e~3f所示。
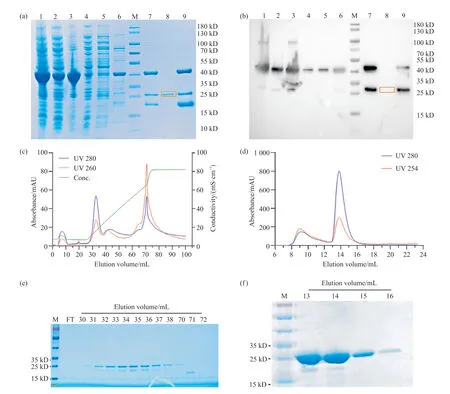
图3 MtbTagA蛋白表达与纯化结果Fig. 3 Expression and purification of MtbTagA protein(a)大肠杆菌表达与Ni-NTA纯化MtbTagA蛋白样品的SDS-PAGE检测结果。1:全菌样品;2:上清样品;3:沉淀样品;4:流穿样品;5:咪唑浓度为10 mmol/L的洗脱样品;6:咪唑浓度为50 mmol/L的洗脱样品;7:咪唑浓度为250 mmol/L的洗脱样品;8:Ulp1酶切后过二次Ni-NTA的流穿样品;9:酶切后二次Ni-NTA中咪唑浓度为250 mmol/L的洗脱样品;M: 蛋白标准品;(b)大肠杆菌表达与Ni-NTA纯化MtbTagA蛋白样品的WB检测结果。一抗为6×His标签;1~9以及M所代表样品与图a一致;(c)MtbTagA蛋白阴离子交换柱纯化结果。MtbTagA(Mw:21 kD)在阴离子交换柱上从32.6 mL的峰上洗脱出来,其对应分子量约为25 kD;(d)MtbTagA蛋白凝胶过滤层析柱纯化结果。MtbTagA(Mw:21 kD)在阴离子交换柱上从13.8 mL的峰上洗脱出来,其对应分子量约为25 kD;(e)MtbTagA蛋白阴离子交换柱样品的SDS-PAGE检测结果。M:蛋白标准品;FT:流穿样品;30~38以及70~72:图c中相应体积(30~38 mL以及70~72 mL)洗脱样品;(f)MtbTagA蛋白凝胶过滤层析柱样品的SDS-PAGE检测结果。M:蛋白标准品; 13~16:图d中相应体积(13~16 mL)洗脱样品。(a) The SDS-PAGE analysis of MtbTagA protein samples expressed by E. coli and purified by use of Ni-NTA purification; 1: Whole cell sample; 2: Supernatant sample; 3: Precipitation sample; 4: Flow through sample; 5: Elution sample with imidazole concentration of 10 mmol/L; 6: Elution sample with imidazole concentration of 50 mmol/L; 7: Elution sample with imidazole concentration of 250 mmol/L; 8: Flow through sample of secondary Ni-NTA after Ulp1 digestion; 9: Elution sample with 250 mmol/L concentration in secondary Ni-NTA after restriction enzyme digestion; M: Protein marker; (b) The WB analysis of MtbTagA protein samples expressed by E. coli and purified by use of Ni-NTA purification; primary antibody was anti-6×His tag; the samples of 1~9 and M were consistent with (a); (c) The purification of MtbTagA protein by anion-exchange chromatography. MtbTagA (Mw: 21 kD) was eluted from the peak of 32.6 mL on an anion exchange column with Mw of about 25 kD; (d) The purification of MtbTagA protein by gel filtration chromatography. MtbTagA (Mw: 21 kD.) was eluted at a peak of 13.8 mL, the corresponding Mw was about 25 kD; (e) The SDS-PAGE analysis of MtbTagA protein samples purified by anion-exchange chromatography. M: Protein marker; FT: Flow through sample; 30~38 and 70~72: Elution sample of corresponding volume (30~38 mL and 70~72 mL) in (c) ; (f) The SDS-PAGE analysis of MtbTagA protein samples purified by gel filtration chromatography. M: Protein marker; 13~16: Elution sample of corresponding volume (13~16 mL) in (d).
2.3 底物对MtbTagA蛋白聚集状态的影响分析
为了探究MtbTagA蛋白的底物对其聚合状态的影响,我们根据已报道的同源家族蛋白EcTagA(PDB ID: 1P7M)选择Hx和3MA这两种底物,分别与MtbTagA蛋白共孵育作为试验组,通过DLS检测溶液中粒子的平均半径(RAVG/nm)以及各组分所占质量百分数(Mass%)。结果发现:对照组MtbTagA的RAVG为(7.54±0.275)nm,粒子半径为3.1 nm的峰1的Mass%为99.5%,说明在溶液中多为单体存在;而添加Hx与3MA后的RAVG分别为(12.99±2.260)nm和(145.66±30.670)nm;通过One-Way ANOVA检验显著性发现,添加Hx后RAVG无显著性差异,而添加3MA后RAVG存在极显著提高,并且溶液中半径更大的粒子所占的Mass%也更高(图4)。这说明预测底物3MA与MtbTagA存在相互作用,并能使其蛋白构象发生改变,从而促进MtbTagA蛋白发生聚集沉淀。
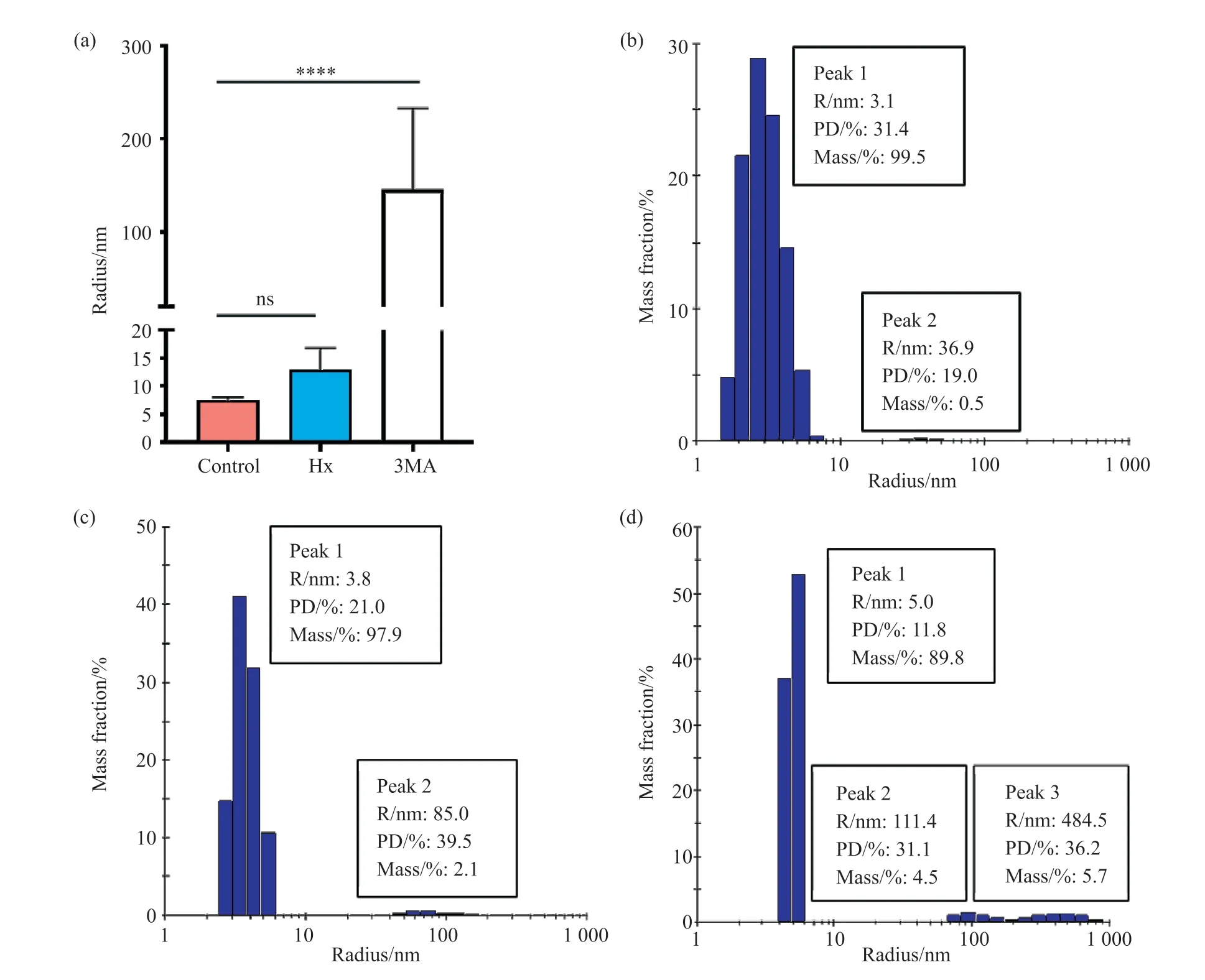
图4 MtbTagA蛋白与底物共孵育DLS分析Fig. 4 DLS analysis of co-incubation of MtbTagA protein with substrate(a)不同条件蛋白溶液平均粒子半径的比较。白色代表2 mg/mL MtbTagA蛋白,蓝色代表2 mg/mL MtbTagA蛋白与50 nmol/L Hx共孵育,红色代表2 mg/mL MtbTagA蛋白与50 nmol/L 3MA共孵育。数据用三组平行试验的均值±标准误表示(n=30),通过One-Way ANOVA计算显著性;(b)MtbTagA蛋白溶液中粒子分布状况的单次检测;(c)添加Hx的MtbTagA蛋白溶液中粒子分布状况的单次检测;(d)添加3MA的MtbTagA蛋白溶液中粒子分布状况的单次检测。(a) Comparison of the average particle radius of protein solution under different conditions. White represents 2 mg/mL MtbTagA protein, blue represents 2 mg/mL MtbTagA protein co-incubated with 50 nmol/L Hx, and red represents 2 mg/mL MtbTagA protein co-incubated with 50 nmol/L 3MA; the data were expressed by the ± s of three groups of parallel experiments (n=30), and the significance was calculated by Student’s t test; (b) Single detection of particle distribution in MtbTagA protein solution; (c) Single detection of particle distribution in MtbTagA protein solution with Hx; (d) Single detection of particle distribution in MtbTagA protein solution with 3MA.
2.4 MtbTagA蛋白结晶与数据收集
将新鲜纯化的MtbTagA蛋白浓缩至2.3 mg/mL,并用于7×96个条件下的初始晶体筛选。在体积分数为22.5%的PEG 4000、100 mmol/L Bis-Tris(pH 4.5)、0.2 mol/L Li2SO4条件下,针状和片状晶体在第3天长出。经过几轮优化后,于第3天在体积分数为18%的PEG 4000、100 mmol/L Na Acetate(pH 5.2)、0.2 mol/L Li2SO4的条件下(条件一)筛选品质较高的晶体(图5a)。晶体保存于含体积分数为25%的甘油防冻剂的结晶缓冲液中并迅速在液氮中冷冻保存。随后在上海同步辐射装置(中国上海)的BL17U1线站上收集X射线衍射数据,最终得到约7 Å分辨率的衍射数据(图5b)。在2个月后,在体积分数为20%的PEG 4000、100 mmol/L Na Acetate(pH 5.6)、0.2 mol/L Li2SO4的条件(条件二)下发现有质量更高的晶体生长,有望获得分辨率更高的衍射数据(图5c)。

图5 MtbTagA的晶体图和X射线衍射图Fig. 5 The crystals and X-ray diffraction image of MtbTagA (a)条件一中MtbTagA蛋白晶体图。上方两块长方体晶体;(b)条件一中MtbTagA蛋白晶体的X射线衍射图。分辨率约为7 Å;(c)条件二中MtbTagA蛋白晶体图。中间三块片状晶体。(a) The crystal image of MtbTagA on the first condition. Two rectangular crystals are on the top; (b) The X-ray diffraction image of MtbTagA crystal in the first condition. The resolution is about 7 Å; (c) The crystal image of MtbTagA on the second condition. Three pieces of lamellar crystals are in the middle.
3 讨论
结核病是目前世界上最致命的传染病,中国也是受结核病影响最深的国家之一[19]。结核病的致病菌结核分枝杆菌是专性需氧菌,可以侵染全身的组织和器官,并且拥有高度冗余的DNA损伤修复机制。已有研究表明,3-甲基腺嘌呤DNA糖基化酶能够识别并切除受损碱基,在BER通路中发挥重要作用,从而对抗人体中的活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)引发的基因损伤,因此对结核分枝杆菌的生存繁殖和耐药性都有重要意义[20-21]。另外,被用于多药耐药结核病治疗的一种新药griselimycins能通过抑制DNA聚合酶滑动钳蛋白DnaN的酶活性发挥作用[22]。因此,MtbTagA能作为结核分枝杆菌来源的3MA DNA糖基化酶在DNA修复途径发挥功能,也有望作为结核药物开发新靶点的潜在来源。
本研究通过氨基酸序列比对分析发现,MtbTagA与EcTagA的同源度在35%左右,但在二级结构上呈现出相似的HHH蛋白超家族特点,并且酶活位点高度保守,且首次在大肠杆菌中成功异源表达并纯化了MtbTagA全长蛋白,这对后续的功能研究具有重要意义。通过DLS发现,异源表达的MtbTagA蛋白在溶液中多为单体存在,并且在预测的2种底物3MA和Hx中,只有3MA能够使其发生极显著高聚。虽然Hx也能提高RAVG值,但是并不存在显著性。这暗示我们MtbTagA蛋白可能在底物选择性上更倾向于偏中性的3MA,这也与Cao等[23]对EcTagA的研究结果一致。同时,晶体生长的条件中存在的锂离子与EcTagA(PDB ID: 1P7M)结构中存在的锌离子均为金属离子,说明金属离子可能对稳定蛋白结构、辅助其行使生理功能具有一定意义。对MtbTagA蛋白进行的晶体筛选和X射线衍射分析有助于其结构的解析,以便于阐明其催化机制以及与底物结合的特点,为进一步探究DNA糖基化酶蛋白的生化性质和结构性质奠定了基础。

