抗鱼类病原菌的放线菌分离鉴定及其活性研究
马永红,朱 丽,刘思蓓,余子全
(湖南师范大学生命科学学院,淡水鱼类发育生物学国家重点实验室,微生物分子生物学湖南省重点实验室,长沙 410081)
杀鲑气单胞菌(Aeromonas salmonicida)是一种嗜冷无动力的气单胞菌, 广泛分布于淡水与海水环境中,是一种不能运动、兼性厌氧的革兰氏阴性菌。其最适生长温度为22~25℃,35℃以上不生长,是一种条件致病菌,能引起疖疮病,对鱼类的存活有着显著的影响,曾经给全球水产养殖业造成了巨大的困扰[1]。
疖疮病是由杀鲑气单胞菌引起的一种高发性的鱼类疾病,影响着世界范围内的水产养殖,其特点是发病率高,死亡率高[2]。病鱼的病症主要表现为鱼体内腹水,体表多处溃烂[3]。在疖疮病等鱼类细菌性疾病的预防与治疗中,不规范频繁地使用化学药物导致病原体耐药性增强,水体严重污染,从而造成水产疾病难以控制,同时也引发了一系列食品安全问题。因此,利用无毒无污染的微生物及其次级代谢产物作为微生物渔药来防控水产疾病无疑成为了鱼病研究的热点[4]。
放线菌能产生多种具有独特作用机制的活性天然产物,同时已有部分研究表明放线菌也能作为一种益生菌用于水产病害的防治。如Babu等[5]在虾养殖区域的淤泥中分离到多株对白斑综合征病毒(white spot syndrome virus,WSSV)具有活性的放线菌,并且发现这些放线菌在虾养殖系统中具有潜在的生物修复作用。拮抗作用是细菌或其他微生物相互作用的方式之一,是指一种微生物在生长过程中通过某种代谢产物或改变生活环境来抑制其他微生物的生长,甚至杀死它们的现象。利用拮抗性能强的菌株抑制病原菌的生长、繁殖或致病性是生物防治的手段之一[6]。疾病防控的重点应该是预防。拮抗菌可以作为抑制病原菌的生物控制剂,能够减少对化学药品的使用和依赖,比治疗更具经济效益[7]。因此,本研究主要以杀鲑气单胞菌为指示菌,从特殊生境下取土样对该致病菌进行拮抗菌的筛选以及活性研究,为鱼类疖疮病的防治提供新的策略和方法。
1 材料与方法
1.1 链霉菌I6分离的材料来源
银川市贺兰山平均海拔2 000 m以上,是温带草原与荒漠的交界线。该地区植被垂直分布,自然环境较为复杂,土壤类型较多。本研究从该地区山地草甸取土样,从中分离到链霉菌I6。
1.2 链霉菌I6的形态学观察
将无菌盖玻片以45°左右的角度并排插入高氏固体平板培养基中,插入深度为盖玻片的1/3左右;用无菌竹签挑取链霉菌I6孢子,接种于盖玻片与高氏培养基的交界线上,在28℃下培养3 d左右;在相差显微镜与扫描电镜下观察链霉菌I6菌丝与孢子的形态特征以及排列情况等[8]。
1.3 链霉菌I6 16S rDNA的扩增测序及系统发育树的构建
使用细菌基因组DNA快速抽提试剂盒提取链霉菌I6的全基因组[9],以基因组DNA为模板,用通用引物扩增目的基因。引物序列:27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-ACGGCTACCTTGTTACGACTT-3')。序列预期长度约为1 500 bp。PCR反应体系:DNA模板2.5 μL(放线菌I6基因组稀释10倍)、上游引物1.0 μL、下游引物1.0 μL、dNTP Mixture(2.5 mmol/L)4.0 μL、10×Ex Taq Buffer 5.0 μL、Ta-KaRa Ex Taq(5 U/μL)1.0 μL、无菌超纯水35.5 μL,总体积50.0 μL。PCR反应条件:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸2 min,30个循环,72℃补平10 min,16℃保存。电泳检测PCR扩增结果[10]。用胶回收试剂盒纯化PCR产物,并送至上海生物工程有限公司进行测序[11]。将测序获得的链霉菌I6的16S rRNA测序结果上传至NCBI(https://www.ncbi.nlm.nih.gov/),利用BLAST和GenBank数据库中的序列进行同源性分析。根据比对结果,在GenBank中检索获得标准菌株的16S rDNA序列,使用MEGA7.0.26软件并采用邻接法构建系统发育树。
1.4 链霉菌I6活性产物分布的检测
刮取适量链霉菌I6孢子至AM6培养基,置于28℃、200 r/min摇床发酵5 d;收集发酵液并离心(8 000 r/min,8 min),分别收集链霉菌I6的发酵上清液与细菌沉淀。菌体沉淀用无菌水洗3次,之后加入少量AM6培养基重悬、超声破碎菌体,最后使用无菌滤头将发酵上清液与沉淀破碎液过滤后进行抑菌试验,测定抑菌圈的大小。
1.5 链霉菌I6发酵条件的优化
为了提高链霉菌I6的抗菌活性物质产量,本研究对链霉菌I6的发酵条件进行了优化。首先,刮取高氏平板上培养好的链霉菌I6孢子至胰蛋白胨大豆肉汤(trypticase soy broth,TSB)培养基中,置于28℃、200 r/min摇床活化2 d,然后再按5%的接种量将种子液分别接入7种不同的发酵培养基(表1)中培养5 d;取出培养后的发酵上清液,以杀鲑气单胞菌为指示菌,未接菌的发酵培养基做为对照进行抑菌试验,筛选活性最强的培养基。接下来将链霉菌I6接种至AM3-1最适发酵培养基中,置于28℃,200 r/min摇床培养,在培养的第1~12天,每天取发酵上清液(以杀鲑气单胞菌为指示菌,未接菌的AM3-1培养基做对照)进行1次抑菌试验,测定不同培养时间对链霉菌I6产抗菌物质的影响。试验每组设3个平行,重复3次。最后,将最适发酵培养基AM3-1的初始pH分别调节至4、5、6、7、8、9、10,以5%的接种量将链霉菌I6的种子液分别转接至不同初始pH的发酵培养基中,置于28℃、200 r/min摇床培养5 d;取各组链霉菌I6的发酵上清液,以杀鲑气单胞菌为指示菌,未接菌的AM3-1培养基做为对照进行抑菌试验,测定不同的初始pH对链霉菌I6产抗菌物质的影响,试验每组设3个平行,重复3次。
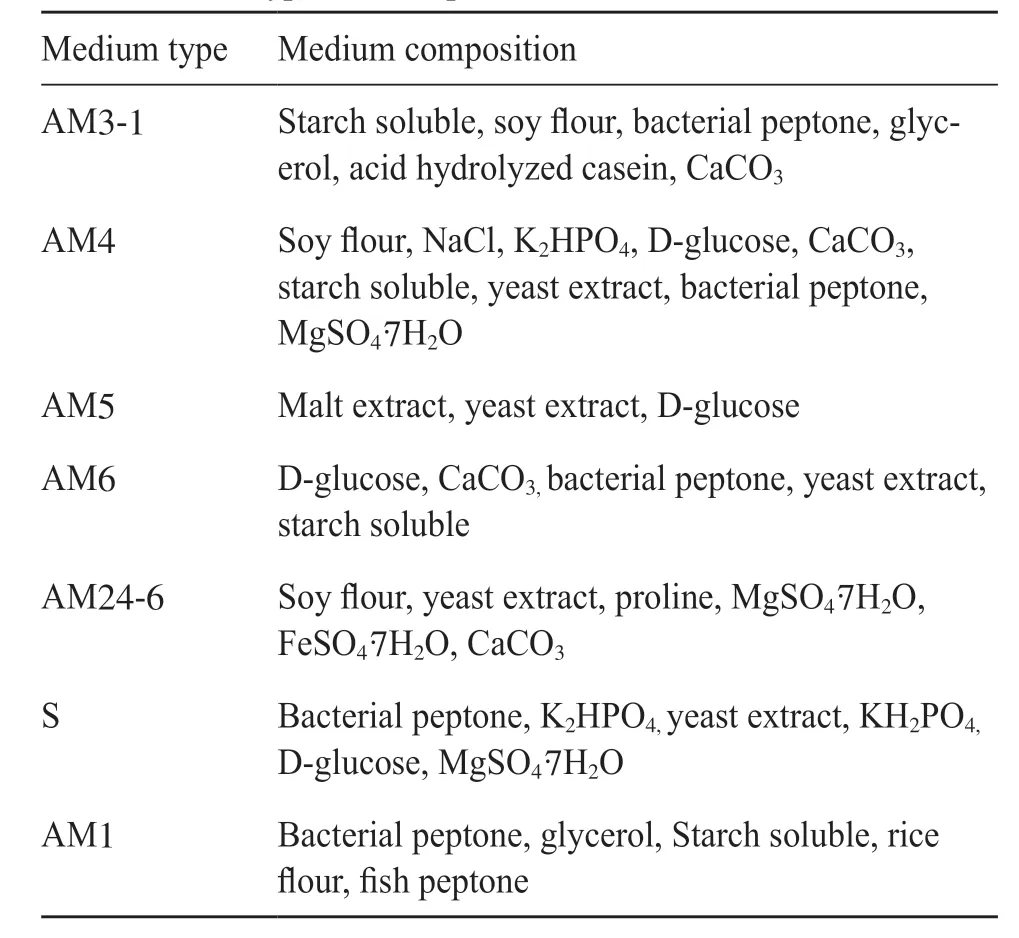
表1 发酵培养基的类型及组成Tab. 1 Type and composition of fermentation medium
1.6 链霉菌I6生理生化特征的检测
根据《链霉菌鉴定手册》中的方法配制各类生理生化培养基,在无菌超净工作台内用已灭菌的竹签挑取少量链霉菌I6孢子接种至各类生理生化培养基中,按照该手册中的检测方法进行各类生理生化检测[12]。
1.7 链霉菌I6发酵液对杀鲑气单胞菌的最小抑菌浓度(MIC)测定
通过梯度稀释法对链霉菌I6的发酵上清液进行稀释,得到不同浓度的稀释液,并以未接菌的AM3-1培养基作为对照,每个样品中加入10.0 μL(1×107CFU/mL)杀鲑气单胞菌的菌液,于30℃过夜培养。观察菌株的生长情况,以肉眼观察到没有杀鲑气单胞菌生长的发酵液浓度设定为最小抑菌浓度(minimum inhibitory concentration,MIC)。观察结束后,取每个浓度组的菌悬液100.0 μL至溶菌肉汤(lysogeny broth,LB)固体平板上涂布均匀,30℃过夜培养,观察平板上杀鲑气单胞菌的生长情况,平板内无杀鲑气单胞菌生长的发酵液浓度设定为最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.8 庆大霉素与诺氟沙星标准曲线的绘制及链霉菌I6发酵液效价的测定
选用常用来防治鱼类病害的庆大霉素与诺氟沙星抗生素作为标准品来衡量链霉菌I6发酵液的效价。称取2 mg庆大霉素与2 mg诺氟沙星抗生素分别溶解于1 mL无菌水中,配成2 mg/mL的庆大霉素母液与2 mg/mL的诺氟沙星母液,并在超净工作台内用无菌滤头过滤,分别配置成1 000.00、500.00、250.00、125.00、62.50、31.25、15.63、7.81 μg/mL的庆大霉素溶液与诺氟沙星溶液。
以杀鲑气单胞菌作为指示菌,将其涂布在LB平板上吹干;在涂有病原菌的板上打6个直径为7 mm的孔(图1a),分为S和K 2组孔,分别在不同的平板上加入50.0 μL不同浓度的庆大霉素与诺氟沙星抗生素以及已过滤的链霉菌I6的发酵上清液到S孔中,每个浓度重复3次,K孔中加入相同浓度的抗生素标准品,30℃过夜培养,观察并计算出各浓度组的抑菌圈直径的平均值。
将所有平板中K孔的浓度抑菌圈直径的平均值减去每个平板上K孔的浓度抑菌圈直径的平均值获得每个平板的校正值。根据每个平板的校正值对各组浓度庆大霉素与诺氟沙星抑菌圈的直径及链霉菌I6发酵上清液抑菌圈的直径进行校正,得到校正值。分别以庆大霉素与诺氟沙星浓度的对数值为横坐标,杀鲑气单胞菌抑菌圈直径校正值为纵坐标,绘制庆大霉素与诺氟沙星标准曲线(图1b、1c)。然后将链霉菌I6发酵液校正的抑菌圈直径数值代入标准品的回归方程中算出所对应的标准品的浓度,得到发酵液的效价。
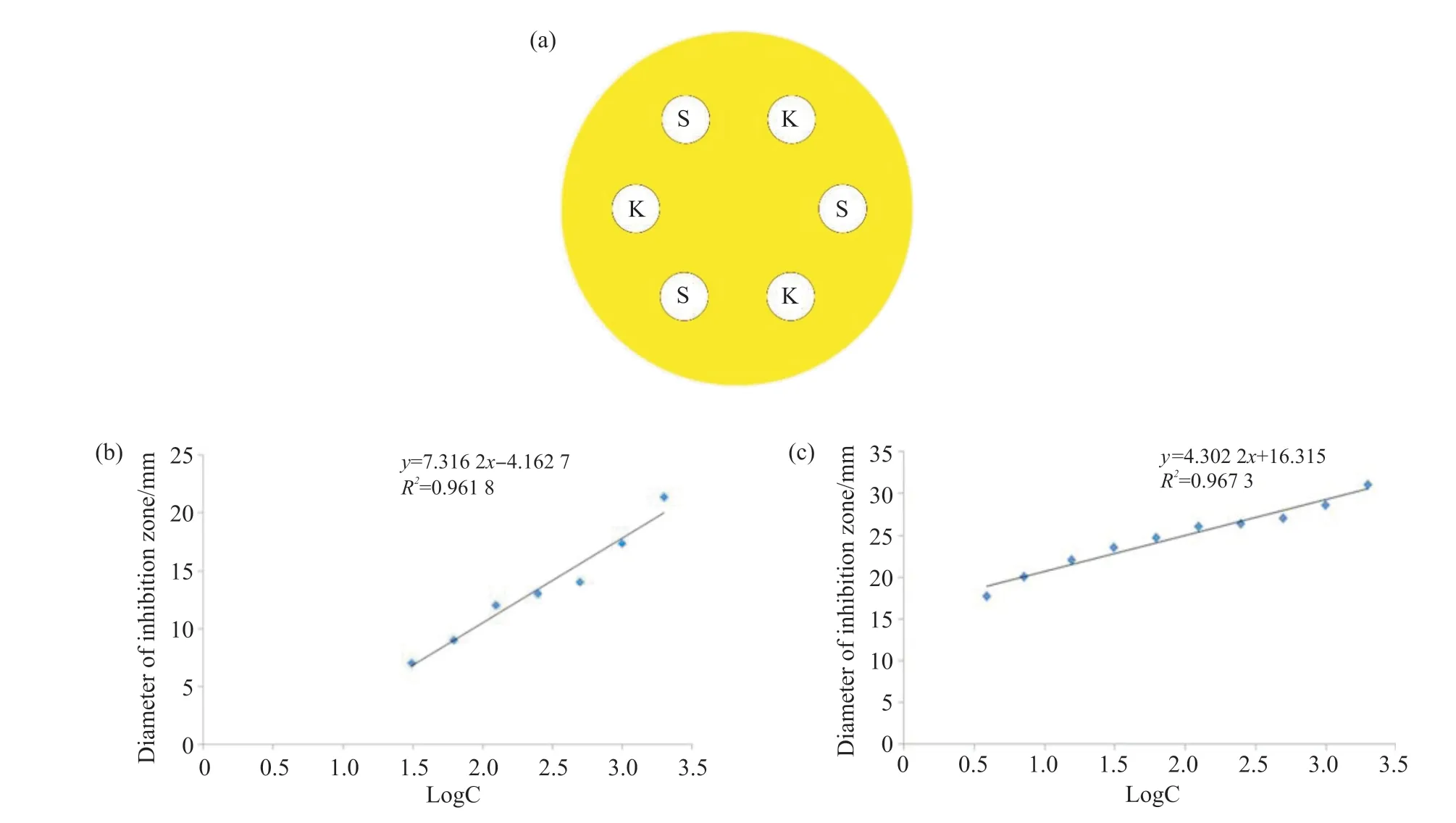
图1 抗生素滴加位置及抗生素对杀鲑气单胞菌的标准曲线Fig. 1 Antibiotic dropping position and standard curve of antibiotic against Aeromonas salmonicida(a)抗生素的滴加位置;(b)诺氟沙星对杀鲑气单胞菌的标准曲线;(c)庆大霉素对杀鲑气单胞菌的标准曲线。(a) Antibiotic dropping position; (b) Standard curve of norfloxacin against Aeromonas salmonicida; (c) Standard curve of gentamicin against Aeromonas salmonicida.
1.9 链霉菌I6发酵液对鱼类的安全性评估
链霉菌I6发酵液对多种鱼类病原菌具有抑制作用,尤其对杀鲑气单胞菌具有非常强的抑制活性。为了将链霉菌I6应用到鱼类养殖的疾病防控中,本研究对链霉菌I6的次级代谢产物进行毒性检测,通过体外反应评估链霉菌I6发酵液对鱼类细胞的安全性。将草鱼肝脏细胞L8824培养至对数期后,在显微镜下观察草鱼肝脏细胞的生长状态。将生长状况较好的对数期草鱼肝脏细胞的细胞密度稀释为1×105个/mL,取100.0 μL加入96孔板中,放置在30℃细胞培养箱中培养12 h,随后分别加入10.0 μL的链霉菌I6发酵液、未接种的AM3-1培养基、杀鲑气单胞菌,置于30℃细胞培养箱培养12 h和24 h后,显微镜下观察草鱼肝脏细胞的形态。
2 结果与分析
2.1 链霉菌I6的鉴定
链霉菌I6的菌落呈圆形扁平状且较为干燥,中间凸出,气生菌丝为淡粉色,基内菌丝为淡黄色并伴有黄色可溶性色素产生。用显微镜观察链霉菌I6,发现其营养菌丝没有隔膜、不断裂,菌丝细长且分支多而短,孢子丝呈螺旋状。在扫描电镜下可以看出,链霉菌I6孢子丝呈紧密螺旋状(5~8圈),孢子呈扁平椭圆状,中央有凹陷,并且孢子表面有褶皱(图2、3)。
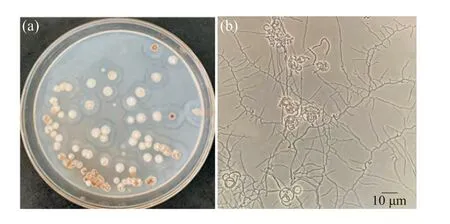
图2 链霉菌I6的培养特征及相差显微镜观察Fig. 2 The phase-contrast microscopy and culture characteristics of Strptomyces sp. I6(a)链霉菌I6的培养特征;(b)链霉菌I6的相差显微镜观察。(a) Culture characteristics of Strptomyces sp. I6; (b) The phase-contrast microscopy of Strptomyces sp. I6.
2.2 链霉菌I6的16S rDNA扩增及系统发育分析
链霉菌I6的全基因组DNA提取凝胶电泳图中条带清晰。该菌用16S rDNA的通用引物进行PCR扩增获得长度约为1 500 bp的特异性条带。将16S rDNA扩增测序结果进行BLAST比对分析后,选择相似度高的不同物种的同源序列,以FASTA格式下载。使用MEGA7.0.26软件,运用邻接法构建链霉菌I6的系统发育树,结果显示,链霉菌I6单独为一支,与Streptomyces triticistrain NEAU A3和Streptomyces bikiniensisstrain WANG1的亲缘关系较近(图4)。但将链霉菌I6的生理生化特征与Streptomyces triticistrain NEAU A3和Streptomyces bikiniensisstrain WANG1的生理生化特征相比较后发现,其生理生化特征与这两株菌稍有差异[13-14](表2),推测链霉菌I6可能为一株新的链霉菌。

表2 链霉菌I6与菌株Streptomyces tritici strain NEAU A3和Streptomyces bikiniensis strain WANG1的生理生化比较Tab. 2 Physiological and biochemical comparison of Streptomyces sp. I6 and Streptomyces tritici strain NEAU A3 and Streptomyces bikiniensis strain WANG1
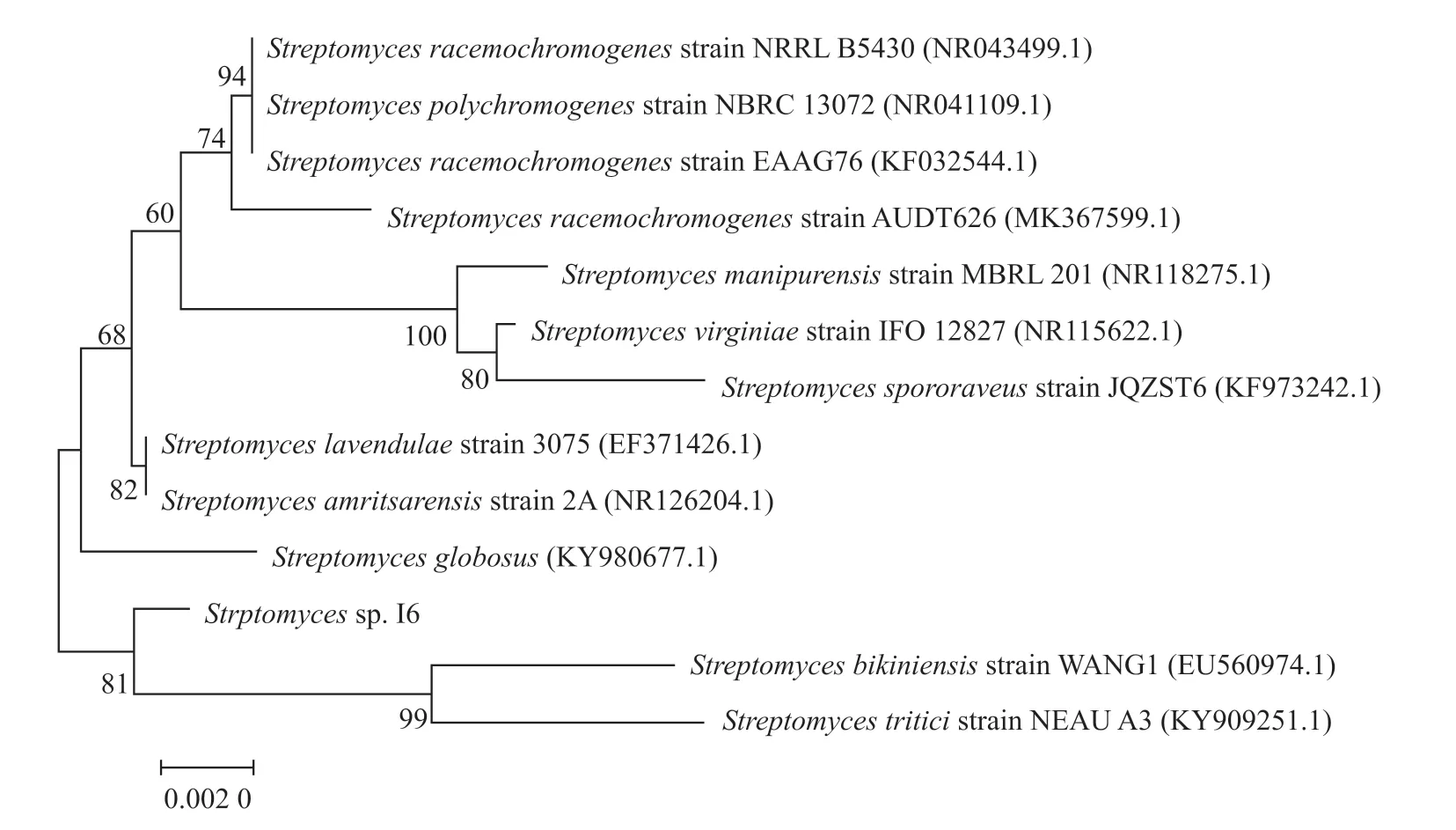
图4 链霉菌I6的系统发育树Fig. 4 Phylogenetic tree of Strptomyces sp. I6
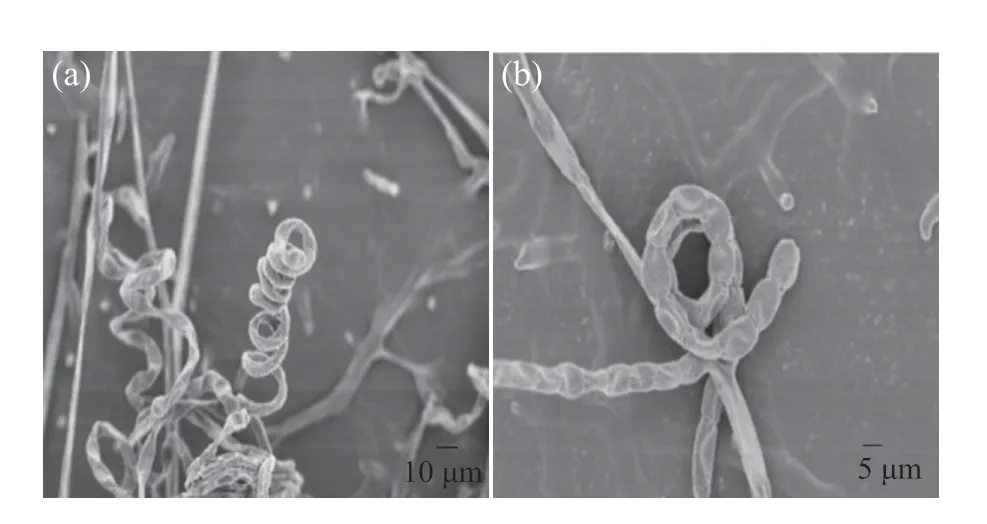
图3 链霉菌I6扫描电镜观察Fig. 3 The scanning electron microscope of Strptomyces sp. I6(a)链霉菌I6;(b)链霉菌I6孢子。(a) Strptomyces sp. I6; (b) Spore of Strptomyces sp. I6.
2.3 链霉菌I6发酵条件的优化
首先将链霉菌I6分别接入7种培养基中发酵,取样检测发酵上清液对杀鲑气单胞菌的抑制作用,发现在AM3-1、AM6、AM24-6、AM5以及AM1培养基中能产生抗菌物质,在AM4与S培养基中不能产生抗菌物质,且AM3-1发酵液的抑菌圈直径比其他培养基抑菌圈直径大5.0~10.0 mm,其中比AM1培养基大10.0 mm左右,比AM6培养基大5.0 mm左右,故确定AM3-1培养基为链霉菌I6的最佳发酵培养基(图5a)。接下来用最适培养基AM3-1发酵链霉菌I6,分别在不同的时间段进行取样,检测发酵上清液对杀鲑气单胞菌的抑制作用。结果表明,活性物质在发酵后开始产生,第5天的发酵液对杀鲑气单胞菌的抑菌作用最强,抑菌圈直径达到25.0 mm左右,说明活性物质产量在第5天时达到顶峰,第5天后随着发酵时间的增加,发酵液中的活性物质的产量稍有降低,但基本保持稳定,故确定链霉菌I6的最佳发酵时长为5 d(图5b)。最后以5%的接种量将链霉菌I6的种子液分别转接至不同初始pH的最适发酵培养基AM3-1中,发酵5 d后,取样检测发酵上清液对杀鲑气单胞菌的抑制作用。结果表明,发酵液初始pH对链霉菌I6活性化合物的生产有明显的影响。当pH为4时,链霉菌I6的发酵液内基本无抗菌化合物的产生,抑菌圈直径为0;随着发酵液初始pH从4增大到7~8时,抑菌圈直径从无逐渐增大到25.0 mm左右,表明pH为7~8时活性化合物的产量达到最大;当发酵液初始pH继续增大时,抑菌圈直径逐渐变小;当pH为10时,抑菌圈直径下降到10.0 mm左右,故确定链霉菌I6的最适pH为7~8。
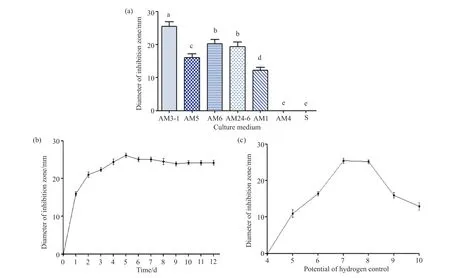
图5 链霉菌I6发酵条件的优化Fig. 5 The fermentation conditions of Streptomyces sp. I6 were optimized(a)不同发酵培养基对链霉菌I6产活性化合物的影响。字母表示显著性差异;(b)不同发酵时间对链霉菌I6产活性化合物的影响;(c)发酵初始pH对链霉菌I6产活性化合物的影响。(a) Effects of different fermentation media on active compounds produced by Streptomyces sp. I6. Letters indicate significant differences; (b) Effects of different fermentation time on active compounds produced by Streptomyces sp. I6; (c) Effects of initial pH of fermentation broth on active compounds produced by Streptomyces sp. I6.
2.4 链霉菌I6抗鱼类病原菌活性物质的研究
为了探究链霉菌I6的抗菌活性物质的分布,本研究分别用发酵上清液与沉淀做了抗杀鲑气单胞菌的活性试验,研究表明,链霉菌I6的发酵上清液对杀鲑气单胞菌具有很强的抑菌活性(图6)。链霉菌I6发酵液对杀鲑气单胞菌的MIC为稀释16倍后的发酵液(表3)。链霉菌I6发酵上清液对杀鲑气单胞菌的校正抑菌圈直径为25.3 mm。将此数值代入庆大霉素和诺氟沙星标准品的回归曲线方程中,得出链霉菌I6发酵上清液分别相当于庆大霉素与诺氟沙星为7.67 μg/mL与665.00 μg/mL的效价。接下来评估链霉菌I6发酵液对草鱼肝脏细胞的安全性,发现杀鲑气单胞菌与草鱼肝脏细胞共孵育12 h和24 h后细胞严重变形,所有细胞全部死亡。链霉菌I6发酵液与草鱼肝脏细胞共孵育12 h和24 h后,草鱼肝脏细胞未出现坏死、病变等情况,生长状况与对照组一致,说明链霉菌I6的代谢产物对草鱼肝脏细胞无毒性(图7)。
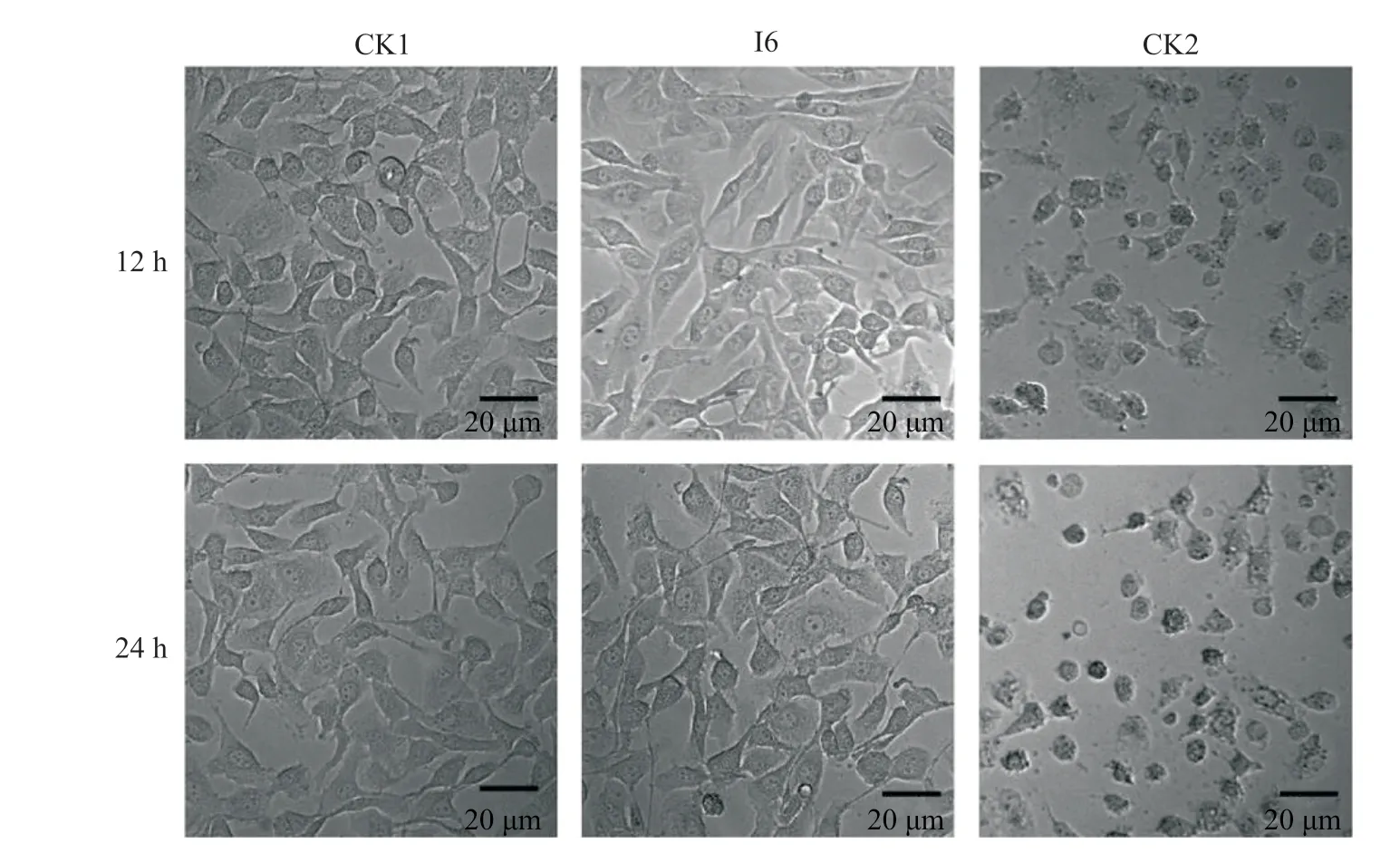
图7 链霉菌I6发酵上清液对草鱼肝脏细胞的影响Fig. 7 Effects of supernatant of Streptomyces sp. I6 on liver cells of grass carpCK1:AM3-1发酵培养基处理;I6:链霉菌I6发酵液处理;CK2:杀鲑气单胞菌处理。CK1: AM3-1 fermentation medium treatment; I6: Streptomyces sp. I6 fermentation broth treatment; CK2: Aeromonas salmonicida treatment.
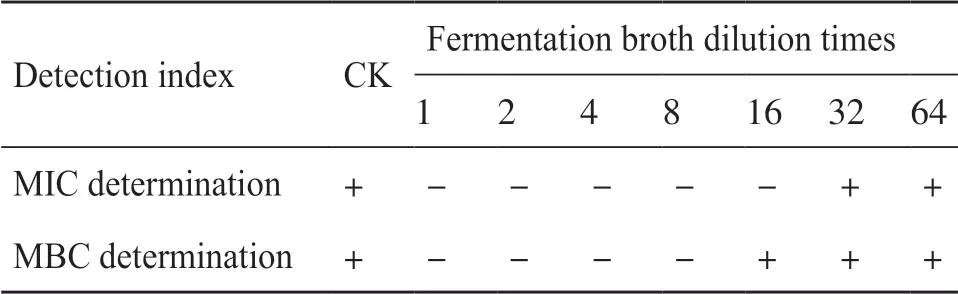
表3 链霉菌I6发酵液对杀鲑气单胞菌MIC与MBC值的检测Tab. 3 Detection of MIC and MBC values of Streptomyces sp. I6 fermentation broth against Aeromonas salmonicida
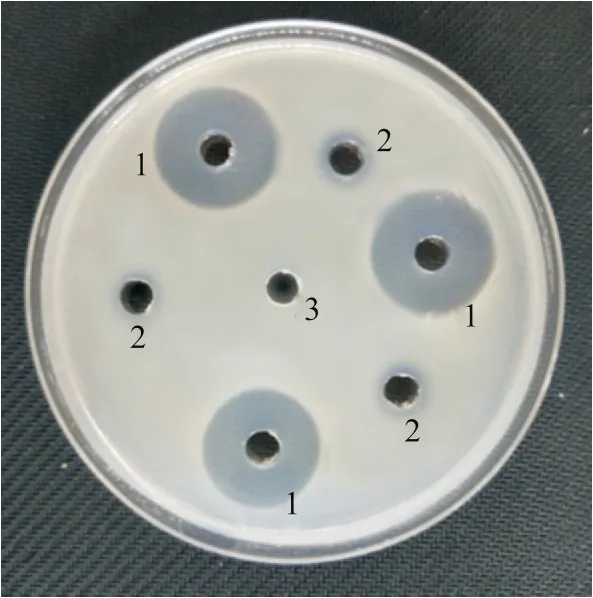
图6 链霉菌I6活性物质的分布Fig. 6 Active substance distribution of Streptomyces sp. I61:链霉菌I6发酵上清液;2:菌体破碎重悬液;3:AM6培养基。1: Streptomyces sp. I6 fermentation supernatant; 2: Bacterial sedimentation and suspension; 3: AM6 medium.
3 讨论
链霉菌是微生物的重要类型,广泛存在于各种生态环境中,在陆地、海洋、空气尘埃等环境中都有发现。链霉菌产生的次生代谢产物更是药物研发的重要来源,在药物研发中发挥着重要的作用[15-16]。统计数据表明,以链霉菌为代表的放线菌贡献了一半以上的临床抗生素药物及先导物[17-19],链霉菌属微生物占据了微生物代谢产物的39%。目前发现的1 000多种微生物生物活性物质中,由链霉菌属微生物所产生的次生代谢产物中得到的抑菌活性物质约占2/3[20]。据报道,链霉菌对鱼类病原菌有抑制效果,其中李梦茜等[21]分离的链霉菌LFJK-11发酵液对引起罗非鱼败血症的嗜水气单胞菌有较强的抑制作用。这与本文中研究的链霉菌I6发酵液对引起鱼类疖疮病的病原菌杀鲑气单胞菌具有很强的抑制活性相类似。
杀鲑气单胞菌广泛分布于自然界中,是气单胞菌中最早被鉴定的致病菌,能引起疖疮病,对鱼类的存活有着显著的影响。目前常用药物治疗的方法防治杀鲑气单胞菌。但是随着药物的使用,杀鲑气单胞菌的耐药性越来越强,甚至出现了可移动的耐药性基因[22]。也有研究发现,杀鲑气单胞菌还可以和常见的嗜水气单胞菌等细菌引发鱼类的混合感染。因此,寻求水产防治杀鲑气单胞菌的益生菌迫在眉睫。本研究中筛到的链霉菌I6对杀鲑气单胞菌有很强的抑制作用,更庆幸的是,链霉菌I6发酵液对杀鲑气单胞菌的MIC分别相当于庆大霉素7.67 μg/mL、诺氟沙星665 μg/mL的效价,且对鱼类细胞无毒性,是一种益生菌。这与陆婷巍等[23]的杀鲑气单胞菌拮抗菌X8安全性测试结果相同。因此链霉菌I6的活性产物有望开发成新的微生物制剂应用于水产疾病的防控中,具有潜在的经济效益和社会效益。但目前研究抗鱼类病原菌活性化合物生物合成途径的报道寥寥无几。因此,我们将继续对链霉菌I6发酵液中抗杀鲑气单胞菌活性化合物进行分离鉴定,并根据其分子结构、结合基因编辑和生物信息学技术研究其生物合成途径。

