当归-川芎药对对脑缺血/再灌注损伤大鼠JAK-STAT信号通路的影响
泥文娟,张书琦,王晓艳,3,贾文汇,张明亮,李 琨,唐进法,,3,李伟霞,,3
(河南中医药大学 1.药学院、2. 第一附属医院中药临床评价技术河南省工程实验室、 3. 呼吸疾病中医药防治省部共建协同创新中心,河南 郑州 450046)
脑中风(也称脑卒中)因其高发病率、高致残率、高死亡率的特点,已成为危害人类健康的重大疾病,且近年来呈现发病率上升,发病年龄提前的趋势[1]。缺血性中风在脑中风中占比较大,对急性期的有效治疗是降低脑中风患者向后遗症期发展的关键。现有临床证据表明,与西医治疗相比,中医药在脑中风的整体治疗中具有独特优势。中医理论认为,从瘀论治缺血性中风是基本疗法[2]。研究表明,理血类活血药对当归-川芎是缺血性中风的核心药味和药对[3]。当归能补血活血,川芎能行气散血,二药相使配对可活血、养血、行气三者并举,使祛瘀而不耗伤气血,养血而不致血壅气滞。当归-川芎配伍不仅是临床常用经典活血化瘀药对(佛手散、芎归散、芎汤、中成药舒脑欣滴丸等),还是治疗缺血性中风的经典方药补阳还五汤和脑心通胶囊等的重要组成。
Janus激酶/信号转导子及转录激活子(Janus kinase-sinal transducer and activator of transcription,JAK-STAT)作为人体重要的细胞内信号转导通路,它的缺陷和异常活化与多种疾病的发生发展及预后的关系正日益受到人们的关注。有研究表明,该通路的激活与脑缺血/再灌注(I/R)损伤的病理生理过程密切相关[4],但当归-川芎药对如何通过调节JAK/STAT通路家族成员或上下游因子的表达,产生相应的生物学效应,进而发挥脑保护作用的具体机制尚不清楚。故本研究采用线栓法制备大鼠大脑中动脉阻塞(MCAO)致I/R损伤动物模型,观察当归-川芎药对的活血化瘀和脑保护作用,并探讨其对JAK-STAT信号通路的影响。
1 材料与方法
1.1 实验动物SPF级健康♀ ,SD大鼠,体质量(220±20)g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。
1.2 药物与试剂当归(批号18110101),购自郑州瑞龙制药股份有限公司;川芎(批号171229),购自安徽石田中药饮片有限公司,经河南中医药大学第一附属医院药学部陈天朝主任药师鉴定,符合2015版《中国药典》一部相关规定。尼莫地平片(批号BJ43395),购自拜耳医药保健有限公司;2%TTC染色液(批号20190723)购于北京索莱宝科技有限公司;甲醛溶液(批号20190101)购于烟台市双双化工有限公司;大鼠核因子κB(NF-κB)、血管内皮生长因子(VEGF)、细胞间黏附分子-1(ICAM-1)和纤溶酶原激活物抑制剂-1(PAI-1)ELISA试剂盒均购自上海茁彩生物科技有限公司(批号0711E19);丙二醛(MDA)测试盒(批号20191006)、总超氧化物歧化酶(T-SOD)测试盒(批号20190930)、谷胱甘肽-过氧化物酶(GSH-Px)测试盒(批号20190927)和总蛋白定量(考马斯亮蓝法)测试盒(批号20190726)均购自南京建成生物工程研究所;兔抗ERK1/2(批号00077469)、兔抗JAK2(批号00046735)、兔抗AKT(批号00077916)购自Proteintech中国公司;兔抗p-STAT3购自Cell Signaling Teachnology公司;SP9000试剂盒和DAB试剂盒购自北京中杉生物工程有限公司。
1.3 仪器Neofuge 1600R型台式低温高速离心机(上海力申科学仪器股份有限公司);S10型手提式高速分离器(宁波新芝生物科技股份有限公司);元素型18120 Molecular(摩尔)超纯水系统(上海摩勒科学仪器有限公司);SHP-250型生化培养箱(上海森信实验仪器有限公司);BS224S型电子天平(北京赛多利斯仪器系统有限公司);L3200型线栓(广州佳灵生物技术有限公司);DHG-9031型电热恒温水浴箱(上海精密仪器仪表有限公司)。
1.4 药物的制备取当归和川芎药材各1 kg混合,加10倍量体积的50%乙醇冷凝回流提取3次,每次2 h,将3次滤液合并,减压浓缩至稠浸膏,称重为1 340 g,计算得到当归-川芎药对的生药量为1.49 g生药/g浸膏。
1.5 大鼠脑缺血/再灌注模型的制备参照Zea Longa的线栓法[5]加以改良制备大鼠MCAO致脑缺血-再灌注(I/R)损伤动物模型,大鼠禁食12 h后,经腹腔注射10%水合氯醛(0. 35 mL/100 g)进行麻醉,仰卧位固定在鼠板上,75%酒精消毒大鼠颈部手术区域,沿颈部正中纵向切口,切开皮肤后钝性分离组织,暴露右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),完全剥离血管表面迷走神经。结扎CCA近心端和ECA,用动脉夹暂时夹闭CCA远心端,在距动脉分叉处3 mm的CCA上剪一小口,将线栓有硅胶的一端从小口插入,松开动脉夹,快速将线栓经过动脉分叉处继续送入ICA,当线栓上的黑点接近动脉分叉处时减缓进线栓的速率,感到轻微阻力时停止插入。结扎固定CCA与线栓,在切口处给予青霉素预防感染,缝合切口,将线栓尾端留在皮肤外。将大鼠放在电热毯上,缺血2 h后轻轻拔出线栓再灌注24 h。
1.6 动物分组及给药将90只大鼠随机分为:假手术组(sham)、模型组(I/R)、GX低剂量组(GXL, 4.86 g·kg-1)、GX中剂量组(GXM, 8.10 g·kg-1)、GX高剂量组(GXH, 11.34 g·kg-1)和尼莫地平片对照组(Nimodiping,15 mg·kg-1),每组15只。给药组大鼠每天灌胃给药1次,连续给药7 d。于d 6晚上将大鼠禁食不禁水饲养,d 7按照模型制备方法造模。假手术组和模型组大鼠灌胃给予等体积生理盐水。动物给药剂量按体表面积换算系数计算:人临床用量×0.018/200×1 000×临床等效量的倍数,当归-川芎药对的低、中、高剂量组分别为临床等效量的3、5和7倍。
1.7 标本采集及指标检测
1.7.1神经功能评分 大鼠再灌注24 h后,采用Longa五分制评分法进行神经功能评分[5]:正常行走,无神经功能缺损,0分;垂直提起时左前爪无力或未完全伸直,轻度局灶性神经功能缺损,1分;行走时转到对侧即左转,中度局灶性神经功能缺损,2分;行走时向左侧跌倒,严重局灶性神经功能缺损,3分;不能自主行走,意识低下,4分。
1.7.2脑梗死体积测定 每组大鼠取5只用10%水合氯醛进行麻醉后,使用普通采血管进行腹主动脉取血,取血后迅速断头取出完整脑组织,在-20 ℃冰箱中冷冻30 min,进行2 mm连续冠状切片,放于2% TTC染液中,在37 ℃生化培养箱中避光染色30 min,每5 min翻面一次。脑组织染色结束后拍照记录,其中白色部分为梗死区域,红色部分为正常区域。
1.7.3脑组织病理学检测 每组中另外10只大鼠用10%水合氯醛进行麻醉后,使用普通采血管进行腹主动脉取血,取血后迅速断头取脑组织,切取前半部分用于生化指标含量测定,后半部分置于4%多聚甲醛中固定过夜。石蜡包埋,进行2 μm切片,采用H&E染色法对脑组织进行染色,并在显微镜下观察脑半暗带区病理改变。
1.7.4生化指标测定 将大鼠大脑前半部分按质量 ∶体积=1 ∶9加入预冷的生理盐水,于冰上使用高速分离器制成脑组织匀浆,采用ELISA法对脑组织匀浆中NF-κB、VEGF、VACM-1、ICAM-1、PAI-1的表达水平进行检测;采用生化法对脑组织匀浆中MDA、SOD和GSH-Px的表达水平进行检测。所有试剂盒均按照说明书进行操作。
1.7.5免疫组化检测 将脑组织切片脱蜡,柠檬酸抗原修复,3% H2O2封闭内源性过氧化物酶,加山羊血清并室温封闭内源性生物素,分别滴加兔抗大鼠一抗(JAK2、p-STAT3、AKT、ERK1/2)、抗兔二抗、辣根酶标记卵霉链白素,依次进行DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。采用日本尼康显微照像系统选取视野进行图像采集。
2 结果
2.1 神经功能评分假手术组大鼠无神经功能损伤症状。模型组大鼠(n=12)中3只轻度神经功能缺损,6只中度神经功能缺损,3只严重神经功能缺损;阳性给药组大鼠(n=13)中3只无神经功能缺损,5只轻度神经功能缺损,3只中度神经功能缺损,1只严重神经功能缺损;GXL组大鼠(n=14)中4只无神经功能缺损,3只轻度神经功能缺损,5只中度神经功能缺损,3只严重神经功能缺损;GXM组大鼠(n=10)中1只无神经功能缺损,8只轻度神经功能缺损,1只严重神经功能缺损;GXH组大鼠(n=10)中4只无神经功能缺损,3只轻度神经功能缺损,2只中度神经功能缺损,1只严重神经功能缺损(Fig 1)。结果表明,当归-川芎药对低、中和高剂量给药组及阳性药尼莫地平均能显著改善I/R损伤大鼠的神经功能缺损症状。

Fig 1 Neurological function score results of each group
2.2 脑梗死体积测定假手术组大鼠脑组织染色均匀,无梗死区域。模型组和各给药组大鼠脑组织易碎,均可见白色的梗死区域,且与红色的正常脑组织之间界限不明显(Fig 2)。
2.3 脑组织病理学检测假手术组大鼠脑组织半暗带区结构清晰,排列紧密整齐,神经细胞形态完全正常,胞核居中,未见空泡样改变。模型组大鼠脑组织半暗带区出现坏死、水肿、炎症、神经细胞排列紊乱、细胞异常增大、出现空泡样改变、神经元数量减少等病理特征。与模型组比较,当归-川芎药对给药组和尼莫地平组均对脑组织病理状态有一定改善作用,其中,GXH、GXM组和尼莫地平片组的改善作用最强,能有效改善水肿、炎症神经细胞空泡变性和组织紊乱等病理状态(Fig 3)。
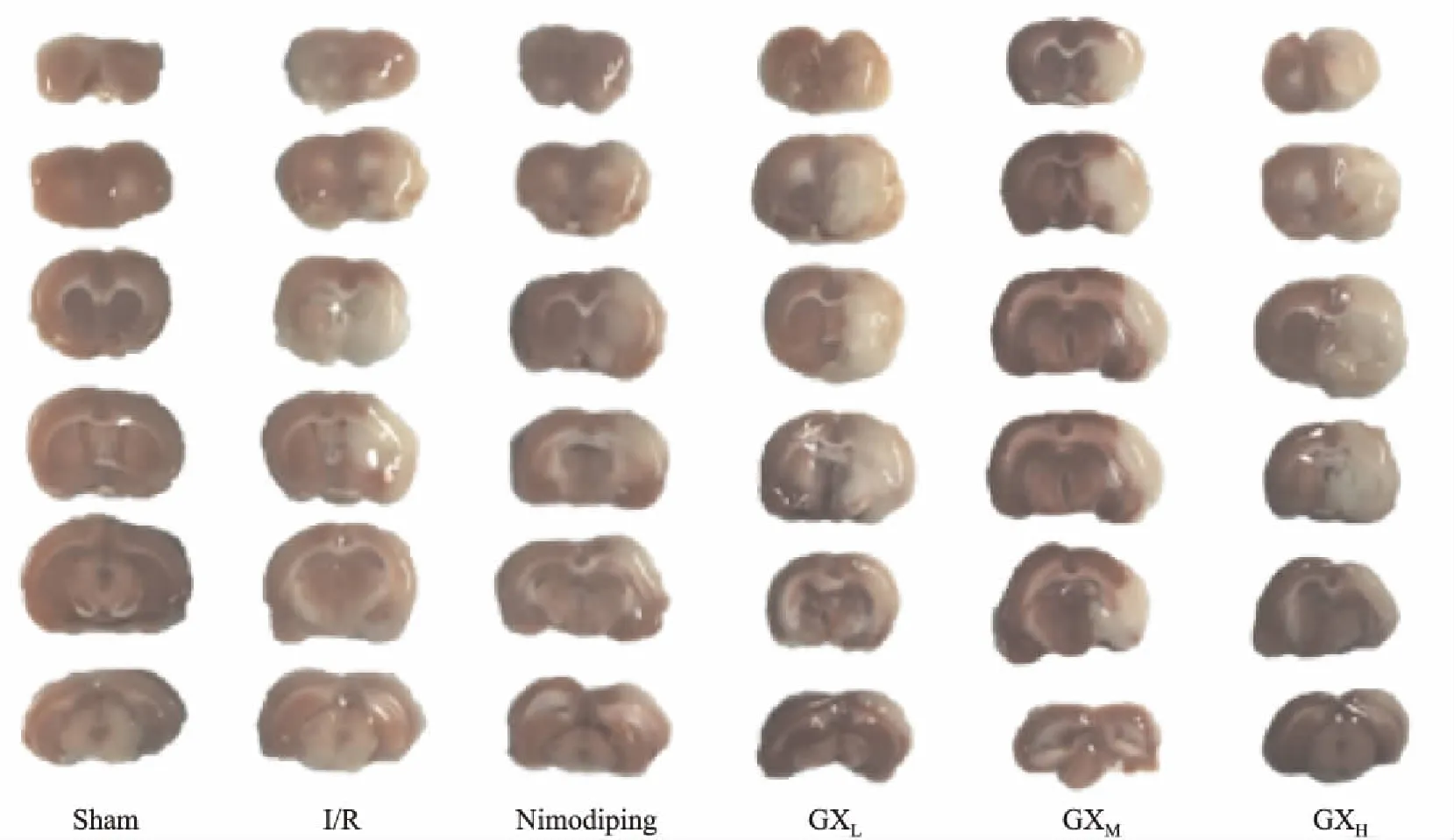
Fig 2 Results of TCC staining

Fig 3 HE staining of penumbra of rat brain tissues (×40)
2.4 生化指标测定与假手术组比较,模型组大鼠脑组织中MDA、NF-κB、VEGF、PAI-1和ICAM-1表达水平明显升高(P<0.05),GSH-Px和SOD表达水平明显降低(P<0.01);与模型组比较,当归-川芎药对给药组能明显下调脑缺血/再灌注大鼠脑组织中MDA、NF-κB、VEGF、PAI-1和ICAM-1的水平(P<0.05),上调GSH-Px和SOD表达水平(P<0.05),见Tab 1。
2.5 脑组织免疫组织化学检测假手术组大鼠脑组织半暗带区的JAK2和AKT主要表达于细胞质中,p-STAT3和ERK1/2表达于细胞核中(Fig 5)。与假手术组比较,模型组大鼠脑组织半暗带区的JAK2和p-STAT3表达量均明显升高,AKT表达量明显降低(P<0.05)。与模型组比较,当归-川芎药对各给药组的JAK2和p-STAT3表达量明显降低,AKT和ERK1/2表达量明显升高(P<0.05)。见Fig 4。
3 讨论
临床上缺血性脑中风多为半侧大脑出现梗死,局灶性I/R模型更符合缺血性脑血管病的特点。I/R引起的损伤主要由两个方面造成,一是缺血导致的损伤,二是血液恢复供应引起的继发损伤,故I/R模型是目前研究药物对缺血性脑血管病治疗作用的常用动物模型[6]。尼莫地平是第二代二氢吡啶Ca2+通道拮抗剂,具有亲脂性,可通过血脑屏障进入中枢神经系统,显著减少脑梗死体积和神经元凋亡,使短暂性局灶性脑缺血的损伤降低33%,是目前脑血管疾病治疗的首选药物,已成为公认的神经保护药物,故本研究选用该药物作为阳性对照药[7]。
课题组前期通过临床数据挖掘发现,当归-川芎药对1 ∶1配比在脑病科中最为常用[8];且实验研究发现,当归-川芎药对1 ∶1醇提物的总活血效应优于水提和先水提后醇提给药组,而醇提物中芳香酸类和苯酞内酯类成分的含量在相同配比中高于先水提后醇提物及水提物组[9]。故本研究选用当归-川芎药对1 ∶1醇提物来探索其对I/R大鼠的活血化瘀和脑保护作用。结果发现当归-川芎药对及阳性药尼莫地平均可明显改善I/R损伤大鼠的神经功能缺损症状,降低脑梗死面积,改善水肿、炎症神经细胞空泡变性和组织紊乱等病理状态。
JAK-STAT信号通路是近年来发现的一条与神经细胞增殖、分化、凋亡、细胞信号传导相关的通路,与I/R发生发展密切相关。研究表明[10],缺血后脑组织中JAK2和STAT3阳性表达均上调,并激活JAK2-STAT3磷酸化,使p-JAK2和p-STAT3蛋白表达明显增加,诱导脑损伤,出现脑水肿、梗死面积扩大、神经功能障碍等现象;而下调JAK2/STAT3信号通路可减少缺血性脑梗死,恢复血脑屏障的完整性,促进I/R损伤后神经系统的恢复[11]。本研究结果发现,当归-川芎药对组大鼠脑组织缺血半暗带区细胞中JAK2和p-STAT3表达水平较模型组均明显降低,AKT和ERK1/2表达水平明显升高,表明当归-川芎药对可通过抑制JAK/STAT信号通路发挥对大鼠I/R损伤的保护作用。
缺血性中风急性期可快速激活免疫炎症反应,引起继发性脑损伤,炎症是I/R损伤的关键驱动因素[12],NF-κB信号通路是炎症调控中枢,与多种关键炎症因子如细胞因子类(TNF-α、IL-6)、黏附分子类(VCAM-1、ICAM-1)等的表达有关,且血管黏附分子VCAM-1和ICAM-1水平是心脑血管疾病病变炎症和活血效应的重要评价指标[13]。本研究结果表明,当归-川芎药对可明显降低I/R损伤大鼠脑组织中NF-κB和ICAM-1水平,但剂量依赖性不强,提示抗炎是当归-川芎药对改善I/R损伤的机制之一。
Tab 1 Effects of GX on biochemical indexes of brain tissue in rats n=10)

Fig 4 Immunohistochemical results of JAK2, p-STAT3, AKT, ERK1/2 in penumbra and mean optical density of rat brain tissues (×40,
氧化应激是I/R过程中导致神经元损伤的关键机制之一,MDA是氧化应激的特异性标志物,SOD是机体内重要的抗氧化酶,GSH-Px可清除体内的脂类氢过氧化物,三者均是氧化应激过程中重要检测指标[14]。本文研究结果显示,当归-川芎药对组大鼠脑组织中MDA水平较模型组明显降低,而GSH-Px和SOD水平明显升高,说明抗氧化亦是当归-川芎药对保护脑组织的机制之一。
PAI是由血管内皮细胞合成和释放的活性物质,是纤溶酶原激活物的生理性抑制剂,其在机体内含量越高,则形成血栓的可能性就越高,危险系数也会越高[15]。本研究结果发现,当归-川芎药对可明显降低模型组大鼠脑组织中PAI-1水平。VEGF是目前已知的作用最强、特异性最高的血管生长因子,参与血管再生、神经保护及缺血后神经元再生,保护脑损伤[16]。在本研究中,当归-川芎药对组大鼠脑组织中VEGF并未表现出促进作用,可能因本实验为I/R急性期。有研究显示,治疗脑梗塞的药物早期能改善脑功能部分原因可能是减轻了脑梗死、脑水肿及其对周围组织的压迫作用,而不是由于神经细胞增殖代偿,因为神经细胞发挥增殖、迁移,且进一步与全脑进行功能整合至少应该在恢复期[17]。
综上,本文研究结果显示当归-川芎药对可改善I/R损伤大鼠神经功能缺损、降低脑梗死面积、改善炎性水肿等作用,其机制与调控JAK-STAT信号通路及抗炎、抗氧化、保护神经等有关,为深入探究当归-川芎药对的活血化瘀及脑保护作用提供了重要参考。

