吉祥草活性成分RCE-4触发内质网应激调控人宫颈癌Ca Ski细胞周期阻滞
牟丽云,邢翔飞,陈重旭,张 晶,金桂兰,奚 伟,陈剑锋
(1. 三峡大学人民医院,宜昌市第一人民医院药学部,湖北 宜昌 443000;2. 三峡大学医学院,湖北 宜昌 443002; 3. 三峡大学生物与制药学院天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002)
宫颈癌是一种常见的妇科恶性肿瘤,目前临床上对其治疗仍以手术和放化疗为主,但化疗所产生的耐药性和肿瘤复发往往导致治疗预期不佳。天然来源的药物因其多靶点、毒性低的优势一直受到学者的重视。RCE-4是本实验室从百合科铃兰族吉祥草植物中分离得到的一个螺甾烷型甾体皂苷,化学名称为(1β,3β,5β,25S)-螺甾烷-1,3-diol1-[α-L-鼠李糖-(1→2)-β-D-木吡喃糖苷],结构见Fig 1,其在吉祥草总皂苷中的含量最高(达13%),对宫颈癌Ca Ski细胞具有较好的选择性细胞毒性[1],能明显抑制裸小鼠移植瘤生长,最高抑瘤率可达到69.1%,且对正常组织的毒性极低,显示了其对宫颈癌治疗的巨大潜力[2],现已作为吉祥草的标志性成分被湖北省地方中药材标准收录。
内质网中未折叠或错误折叠的蛋白积累所导致的内质网应激(endoplasmic reticulum stress,ER stress)是调节细胞适应不利微环境的重要防御机制之一,在肿瘤细胞生长、存活、分化和维持蛋白质稳态等过程中发挥着至关重要的作用。细胞周期阻滞同样也是细胞在处于不利环境下的一种自我保护机制,为细胞提供额外的时间用于修复损伤[3]。已有研究证明,二者之间存在密切的联系,内质网应激可导致细胞内蛋白合成广泛性抑制,其中就包括细胞周期蛋白(cyclin)和细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)等关键的细胞周期调控因子,从而诱发细胞周期阻滞[4-5]。反过来,细胞周期阻滞也是促进内质网应激使细胞恢复功能的机制之一,细胞周期阻滞不仅降低了应激细胞的能量消耗,也为内质网稳态的重构提供了时间。
化疗所触发的肿瘤细胞自我保护机制是肿瘤细胞产生耐药性和肿瘤复发的重要原因,对其进行深入研究有利于寻找规避途径或指导临床用药。目前,关于RCE-4所触发的内质网应激和细胞周期调控尚未见研究。本研究拟以宫颈癌Ca Ski细胞为对象,系统解析RCE-4对Ca Ski细胞内质网应激和周期阻滞的影响及其分子作用机制,为RCE-4将来的临床应用提供理论支撑。
1 材料与方法
1.1 材料
1.1.1细胞株 人宫颈癌Ca Ski细胞由中国科学院典型培养物保藏委员会细胞库提供,本实验室培养保存。
1.1.2药物与试剂 RCE-4由本实验室从吉祥草中分离并进行结构鉴定;人抗兔一抗p21、p27、p53、p-p53、cdc25C、p-cdc25C、CyclinB1、Chk2、p-Chk2、ATM、Gadd45α、MDM2、PERK、eIF2α、p-eIF2α、ATF4、CHOP、β-actin,人抗鼠一抗CDK1均购自美国Cell Signaling Technology公司;二抗辣根酶标记山羊抗小兔、山羊抗小鼠IgG( H + L)购自武汉塞维尔生物科技有限公司;RPMI 1640培养基购自美国Gibco公司(批号:2164175);胎牛血清购自浙江天杭生物科技股份有限公司(批号:18110506);青霉素-链霉素混合液购自北京索莱宝科技有限公司(批号:20201011);MTT购自美国Amersco公司;DMSO购自美国Sigma公司(批号:RNBG7127);ECL超敏发光液购自北京普利莱基因技术有限公司(批号:201900AP1020);细胞周期检测试剂盒购自上海碧云天生物技术有限公司(批号:062719190909)。
1.1.3仪器 酶标仪(瑞士TECAN公司);流式细胞仪(美国BD公司);CO2培养箱(德国binder公司)。
1.2 方法
1.2.1细胞培养 Ca Ski细胞置于含10%胎牛血清的RPMI 1640培养基中,在37 ℃、5% CO2的培养箱中培养。
1.2.2MTT实验 取对数生长期的Ca Ski细胞,调整细胞浓度为1×105个·L-1,接种于96孔板中,每孔100 μL。实验分3组,每组5个复孔。空白组:不含细胞和RCE-4,仅含RPMI 1640完全培养基;对照组:含细胞、RPMI 1640完全培养基,但不含RCE-4;实验组:含细胞、RPMI 1640完全培养基和RCE-4(终浓度为2、4、8、12、16 μmol·L-1)。分别培养24、48、72 h后弃培养基,每孔加入5 g·L-1MTT 20 μL,避光孵育4 h后每孔加入150 μL DMSO并剧烈温震荡10 min。用酶标仪检测490 nm波长处各孔的OD值。细胞抑制率/ %= (对照组吸光度-实验组吸光度) /(对照组吸光度-空白孔吸光度)×100%。
1.2.3克隆形成实验 取对数生长期细胞,铺6孔培养板,每孔细胞约500 个,设置对照组、RCE-4(2、4、8、12、16 μmol·L-1)处理组,作用时间为1周,每2 d换液1次,药物浓度保持不变。然后用PBS轻轻漂洗2次;甲醇固定30 min,PBS轻轻漂洗3次;结晶紫染色25min,PBS漂洗4-5次;晾干,相机拍照,ImageJ软件计数。
1.2.4流式细胞术检测细胞周期 以每孔5.0×105个细胞接种于6孔板中,待细胞贴壁之后,用不同浓度的RCE-4(0、8、12、16 μmol·L-1)处理24 h,胰酶消化收集细胞,用1× PBS重悬,并缓慢加入预冷的70%乙醇于4 ℃固定过夜。次日,离心洗去乙醇,加入RNase A消化,500 μL碘化丙啶(PI)试剂室温避光孵育30 min,将样品通过流式细胞仪进行细胞周期检测。实验重复3次,采用Flow-jo7.6软件进行分析统计。
1.2.5Western blot检测相关蛋白表达 分别收取经不同方式处理的细胞,用含蛋白酶抑制剂的RIPA液裂解细胞后,12 000 r·min-1、4 ℃离心15 min,将上清转移至新的EP管。用BCA法测定细胞裂解液中的蛋白浓度,取适量上清液(含50 μg蛋白),加入1/4体积的5× loading buffer,100 ℃煮沸10 min。所得样品经SDS-PAGE分离,电转移至PVDF膜。膜用10%脱脂牛奶( TBST配制)室温封闭2 h后,TBST洗膜10 min×3次。加对应一抗(稀释比例为1 ∶1 000)4 ℃孵育过夜,TBST洗膜10 min×3次;再加二抗室温孵育1 h(稀释比例为1 ∶5 000),TBST洗膜10 min×3次,最后用ECL化学发光法显影并记录结果。
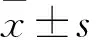
2 结果

Fig 1 The chemical structure of RCE-4
2.1 RCE-4对人宫颈癌Ca Ski细胞的增殖抑制作用如Fig 2 MTT结果所示,RCE-4对人宫颈癌Ca Ski细胞的增殖具有明显的抑制效果,随着RCE-4浓度的升高和作用时间的延长,抑制率逐渐增强,具有时间和浓度依赖性。作用24、48、72 h的IC50值分别为8.61、4.69、4.34 μmol·L-1。Fig 3克隆形成的实验结果进一步确认了RCE-4对人宫颈癌Ca Ski细胞增殖的抑制作用,与对照组相比,8、12、16 μmol·L-1RCE-4 组细胞克隆形成数目明显减少,与对照组相比差异有统计学意义(P<0.01)。

Fig 2 Effects of different concentrations of RCE-4 on proliferation of cervical cancer Ca Ski cells after treatment for 24 h, 48 h and 72 h respectively n=3) **P<0.01 vs control.
2.2 RCE-4对PERK/eIF2α/ATF4/CHOP通路的影响PERK/eIF2α/ATF4/CHOP是内质网应激主要的信号通路之一。Western blot的结果显示(Fig 4A-C),不同浓度的RCE-4分别作用于Ca Ski细胞6 h、12 h、24 h后,与对照组相比,PERK、p-eIF2α、ATF4和CHOP的表达水平均明显升高,差异具有统计学意义(P<0.05),而eIF2α的表达水平基本无明显变化。

Fig 3 Effects of different concentrations of RCE-4 on colony formation of Ca Ski cells n=3) **P<0.01 vs control
2.3 RCE-4促进Ca Ski细胞周期阻滞于G2/M期CDK1与CyclinB1是细胞周期G2/M期检查点的关键蛋白。Western blot的结果显示(Fig 5A-C),不同浓度的RCE-4分别作用于Ca Ski细胞6 h、12 h、24 h后,与对照组相比,CDK1与CyclinB1的表达水平均被明显抑制,差异具有统计学意义(P<0.01)。Fig 6流式细胞仪结果显示,与对照组相比,RCE-4(8、12、16 μmol·L-1)处理Ca Ski细胞24 h后,G2/M期细胞数量由8.05%分别增加至13.76%、19.53%、27.50%,S期细胞数量由39.44%分别降低至30.55%、30.96%、28.86%。结果表明随着RCE-4浓度的增加,Ca Ski细胞G2/M期细胞数量逐渐增多,S期细胞数量逐渐减少,细胞被阻滞于G2/M期。
2.4 RCE-4对ATM/Chk2/cdc25C信号通路的影响考虑到ATM/Chk2/cdc25C信号传导通路在G2/M期的转化中起着重要作用,我们研究了该通路中相关分子蛋白质的表达水平。Western blot结果显示(Fig 7A-C),不同浓度的RCE-4分别作用于Ca Ski细胞6 h、12 h、24 h后,与对照组相比,ATM的蛋白表达水平明显升高,而Chk2、p-Chk2、cdc25C、p-cdc25C的表达均被明显抑制,差异有统计学意义(P<0.05)。

Fig 4 Effects of different concentrations of RCE-4 on PERK-eIF2α pathway proteins expression at 6 h, 12 h and 24 h n=3) *P<0.05,**P<0.01 vs control.

Fig 5 Effects of different concentrations of RCE-4 on CDK1 and CyclinB1 protein expression at 6 h, 12 h, 24 n=3) **P<0.01 vs control.
2.5 RCE-4对p21、p27及其他细胞周期相关蛋白的影响Western blot结果显示(Fig 8A-C),不同浓度的RCE-4分别作用于Ca Ski细胞6 h、12 h、24 h后,与对照组相比,RCE-4明显提高了Ca Ski细胞中p21和p27蛋白的表达,差异有统计学意义(P<0.05),而p53、p-p53蛋白水平均下调。提示RCE-4可能通过非p53依赖途径上调p21和p27,并将Ca Ski细胞周期阻滞在G2/M期,从而抑制Ca Ski细胞的生长。此外,参与调控细胞周期的其他基因—MDM2和GADD45α的蛋白表达水平均下调(P<0.05)。

Fig 6 Effects of different concentrations of RCE-4 on cell cycle distribution of Ca Ski cells for 24 h n=3) *P<0.05 vs control.

Fig 7 Effects of different concentrations of RCE-4 on ATM/Chk2/cdc25C signaling pathway at 6 h, 12 h and 24 n=3) *P<0.05 vs control
3 讨论
内质网是真核细胞内蛋白质合成、加工、分泌及质量监控的关键细胞器,细胞通过未折叠蛋白效应(unfolded protein response, UPR)感应外界不同刺激引发的内质网应激,在维持细胞功能稳态中发挥至关重要的作用。PERK/eIF2α是UPR效应主要的信号通路之一,在外界刺激下,人蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)二聚化并通过反式自磷酸化的方式激活,进而使α亚基真核起始因子2(α subunit of eukaryotic initiation factor 2,eIF2α)的51位丝氨酸磷酸化,同时,激活转录因子4(activating transcription factor 4,ATF4)在eIF2α功能受限时被优先翻译,并激活转录因子CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding homologous protein,CHOP)的转录,以此激活下游UPR靶基因的表达,抑制蛋白翻译和折叠[6-7]。ATF4和CHOP的高水平表达会导致持续的内质网应激,从而影响细胞生长、周期阻滞及细胞凋亡等多种生物学过程[8-9]。目前已有研究指出,内质网应激和随后的UPR可诱导细胞周期G2/M期阻滞,且此过程与PERK/eIF2α信号传导途径有关[4-5]。

Fig 8 Effects of RCE-4 on cell cycle related proteins such as p21 and p27 at 6 h, 12 h and 24 h n=3) *P<0.05,**P<0.01 vs control
本实验中,RCE-4以不同的浓度和时间处理Ca Ski细胞后,Western blot结果显示PERK、p-eIF2α、ATF4、CHOP的蛋白表达水平均明显升高,说明RCE-4触发了Ca Ski细胞持续的内质网应激。进一步,CyclinB1与CDK1的表达均被明显抑制,推测Ca Ski细胞周期调控受到影响。细胞周期的调控是通过细胞周期各时相中各自特异性的细胞周期蛋白实现,其中Cyclin、CDKs和CDK抑制蛋白(cyclin-dependent kinase inhibitors,CDKIs)是参与细胞周期调控的主要因子[10]。CyclinB1与CDK1是调控细胞周期G2/M期的核心蛋白,对细胞周期调控至关重要。在S期末期,CyclinB1开始合成并作为调节亚基与CDK1结合为有丝分裂促进因子(mitosis-promoting factor,MPF),驱动G2到M期的转换[11-12]。流式细胞术的结果验证了我们的推测,不同浓度和时间的RCE-4处理Ca Ski细胞后,处于G2/M期的细胞数量明显上升,表明RCE-4可将Ca Ski的细胞周期阻滞在G2/M期。
考虑到ATM/Chk2/cdc25C信号传导通路对G2/M期阻滞的重要作用,我们研究了RCE-4对该通路相关蛋白的影响。该信号通路能以级联反应顺次磷酸化,最终激活cdc25C分子,从而激活CyclinB1/CDK1复合体,促进细胞周期G2/M期的转化[13]。cdc25C的降解是维持G2/M期阻滞的必要条件[14]。实验结果显示,RCE-4处理之后ATM被激活,Chk2的表达及其磷酸化过程被抑制,并最终导致cdc25C及磷酸化的cdc25C均被降解,Ca Ski被阻滞于G2/M期。p21和p27是主要的CDK抑制蛋白(CDKIs),其活性可通过内质网应激相关分子ATF4和CHOP介导,竞争性抑制CyclinB1或者CyclinB1/CDK1复合物,抑制细胞从G2期进入M期[15-17]。Western blot结果显示,不同浓度和时间的RCE-4处理CaSki细胞后,p21和p27的表达均被明显抑制,表明RCE-4所触发的内质网应激通过p21和p27介导,将CaSki的细胞周期阻滞在G2/M期。然而,RCE-4诱导的G2/M期周期阻滞并不依赖与p53的参与,因为p53和磷酸化的p53(p-p53)的表达在处理过程中是都下降的。MDM2是p53下游的靶基因,已被证明以一种不依赖p53的方式负调控p21蛋白水平,MDM2基因沉默时,Cdc25C基因表达受到抑制,延迟细胞周期在G2/M期的进展[18];GADD45α是内质网应激诱导的生长阻滞的关键介质,通过eIF2信号通路调控G2/M过渡和细胞死亡[5],本实验中,经RCE-4处理的Ca Ski细胞中MDM2和GADD45α的蛋白表达水平均下调,提示RCE-4诱导的内质网应激与细胞周期阻滞可能与GADD45α和MDM2等分子的表达有关。
综上所述,RCE-4通过上调PERK/eIF2α/ATF4/CHOP通路激活内质网应激,并以p21、p27、MDM2、GADD45α等分子为介导,调控ATM/Chk2/cdc25C信号通路,诱导Ca Ski细胞阻滞于G2/M期。对RCE-4所诱导的两种细胞自我保护机制的解析,可为RCE-4将来的临床应用提供理论依据。

