秀丽莓原花青素对糖尿病小鼠胰腺组织的保护作用
方 健,朱桂行,童金枝,杨宇凡,张建辉,朱甜甜,尚娇娇,童 丽,孙 敏
(1. 安徽大学生命科学学院,安徽 合肥 230601;2. 颍上县人民医院病理科,安徽 阜阳 236200; 3. 青海大学医学院中藏药研究中心,青海 西宁 810016)
糖尿病是一种因胰岛素分泌不足和(或)胰岛素抵抗所引起的代谢性疾病[1]。随着居民生活水平的上升,高糖高脂饮食产生的糖脂毒性可损伤胰岛β细胞功能,造成2型糖尿病的发生和发展[2]。研究表明,保护胰岛细胞损伤是治疗糖尿病的根本环节[3],而氧化应激是导致胰岛细胞损伤的关键因素。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素氧合酶(heme oxygenase-1,HO-1)信号通路是细胞重要的防御系统,可抵抗氧化应激,因此激活Nrf2/HO-1信号通路能预防或减轻糖尿病肾病的进展。
悬钩子属植物的降血糖活性已在临床和实验研究中得到报道,并与升高胰岛素水平有关[4],但是悬钩子属植物中起降糖作用的活性成分及作用机制尚不清楚。本实验室前期采用β细胞膜固相色谱法对秀丽莓的活性成分进行筛选,结果表明原花青素(proanthocyanidins,PC)B和C为保护胰岛β细胞的活性成分,本实验将通过建立C57BL/6糖尿病小鼠模型进一步研究秀丽莓原花青素对糖尿病小鼠胰腺组织的保护作用及其机制。
1 材料
1.1 药物与试剂二甲双胍片购自上海施贵宝制药有限公司(批号:H20023370);TC、TG、HDL-C、LDL-C测试盒购自南京建成研究所(批号:A111-1-1、A110-1-1、A113-1-1、A112-1-1);STZ购自美国Sigma公司(批号:S0130);Nrf2抗体、HO-1抗体购自proteinch公司(批号:16396-1-AP、10701-1-AP);AKT抗体、p-AKT抗体购自美国SAB公司(批号:YT0175、YP0006);ECL显影液购自上海天能科技有限公司(批号:180-501)。
秀丽莓原花青素(RPC)的提取:秀丽莓干燥茎采自青海果洛,经中国科学院西北高原生物研究所卢学峰老师鉴定为蔷薇科悬钩子属植物秀丽莓(RubusamabilisFocke)。丙酮水浸泡粉碎后的干燥茎,提取3次浸泡过夜,取滤液,反复提取,合并滤液,旋转蒸发至干,制得秀丽莓干燥茎原花青素粗提物。粗提物经D101大孔树脂柱纯化,得到含量>95%的总原花青素,再旋转蒸发至干,放置冰箱备用[5]。
1.2 仪器Gynergy HI型酶标仪(美国伯腾仪器有限公司);JS-1070P型化学发光成像系统(上海培清科技有限公司);ACCUCHEK型血糖仪及配套血糖试纸(上海罗氏制药公司);DYY-4C型电转膜仪及电泳仪装置(上海天能科技有限公司)。
2 方法
2.1 分组及给药体质量(20±2)g的雄性C57BL/6小鼠,购自安徽医科大学实验动物中心,许可证号:SCXK(皖)2019003。随机抽取8只作为对照组(Con)给与普通饲料喂养;其它小鼠给与高脂饲料喂养,4周后50 mg·kg-1的剂量腹腔注射STZ(持续3 d),注射后的72 h,血糖仪尾尖取血检测小鼠空腹血糖(fasting blood-glucose, FBG),抽取FBG≥16.7 mmol·L-1的小鼠继续给予高脂饲料饲养,并将其随机分为模型组(Mod)、二甲双胍组(Met)、原花青素低剂量组(RPCL)、原花青素高剂量组(RPCH),每组8只。Met组小鼠按20 mg·kg-1剂量给予二甲双胍片溶液灌胃;RPCL组和RPCH组小鼠分别按50、150 mg·kg-1剂量给予原花青素溶液灌胃;Mod组和Con组小鼠灌胃给予等体积蒸馏水灌胃,每日1次,连续给药7周。每周记录1次体质量和每2周记录1次FBG。
2.2 口服葡萄糖耐量实验在药物干预的第6周末进行,所有小鼠禁食12 h后,根据每只小鼠的体重给予葡萄糖溶液(2 g·kg-1)灌胃,按顺序分别检测0、30、60、120 min的血糖,利用GraphPad Prism 8.3.0绘制血糖变化折线图,并计算曲线下面积(AUC)。
2.3 生化指标检测7周后小鼠眼球取血,置于抗凝管中,3 000 r·min-1离心5 min分离血浆,检测血浆中血脂、SOD活力和MDA含量。红细胞沉淀用于检测GHb含量。解剖小鼠分离胰腺组织,一部分使用4%多聚甲醛固定用于HE染色;其余部分于-80 ℃冰箱中保存,用于Western blot的检测。
2.4 HE染色取固定的胰腺组织,进行脱水、石蜡包埋,切片(厚4-5 μm)、染色、封片等步骤,完成操作后将切片放置于Leica光学显微镜下拍照,观察其形态特征。
2.5 Western blot检测取胰腺组织,加入适量预冷的RIPA裂解液,置于冰上超声,裂解1 h。裂解液于4 ℃、12 000 r·min-1离心,取上清并检测蛋白浓度,使用裂解液调各样品蛋白浓度一致后,加上样缓冲液煮沸5 min制作Western blot标本。蛋白样品经电泳,电转移至NC膜后,5%脱脂牛奶封闭1 h,加一抗AKT(1 ∶500)、p-AKT(1 ∶500)、Nrf2(1 ∶750)、HO-1(1 ∶1 000)置于4 ℃孵育过夜,次日洗膜后加二抗孵育2 h,ECL曝光,曝光后用ImageJ进行灰度分析。
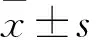
3 结果
3.1 RPC对糖尿病小鼠一般情况的影响Con组小鼠毛色正常,精力旺盛,反应快,无多饮多食多尿现象;Mod组小鼠毛色灰暗,精神萎靡、反应慢,有明显的多饮多食多尿;RPC组及Met组小鼠经治疗后,毛色恢复光泽,多饮多食多尿有所改善,精神状态及反应灵敏度均优于Mod组。
3.2 RPC对糖尿病小鼠体重的影响小鼠分组后喂养7周,每周测1次体重,由Fig 1可知,从第2周开始小鼠体重发生差异,RPC组及Met组小鼠体重均高于Mod组,一直持续到第7周。

Fig 1 Effect of RPC on body weight of diabetic mice n=8)
3.3 RPC对糖尿病小鼠FBG的影响由Tab 1可知,Mod组小鼠的FBG水平明显高于Con组(P<0.01),而经过Met和RPC的7周治疗后,Met组、RPCL组和RPCH组的FBG水平较Mod组明显降低(P<0.05)。
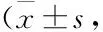
Tab 1 Effect of RPC on FBG in diabetic mice n=8)
3.4 RPC对糖尿病小鼠生化指标的影响由Tab 2表明:Mod组小鼠血浆TG、TC、LDL-C、GHb较Con组明显增加(P<0.01),HDL-C略微降低(P<0.05);与Mod组比较,Met组、RPCL组和RPCH组能明显降低TG、TC、LDL-C、GHb(P<0.05),增加HDL-C(P>0.05)。
3.5 RPC对糖尿病小鼠葡萄糖耐量的影响在实验结束前1周进行,由Fig 2A可知,所有组别小鼠30 min时血糖浓度达到峰值,然后血糖浓度呈下降趋势。利用GraphPad Prism 8.3.0计算葡萄糖曲线下的面积(AUC)并绘制成柱状图如Fig 2B所示,Mod组葡萄糖耐量曲线下的面积(AUC)明显高于Con组(P<0.01),表明Mod组小鼠胰岛β细胞的葡萄糖刺激的胰岛素分泌功能受损较为严重。Met组、RPCL组和RPCH组葡萄糖耐量曲线下的面积(AUC)明显比Mod组降低(P<0.05),提示RPC能减轻糖尿病小鼠的糖耐量受损,改善胰岛β细胞功能。

Fig 2 Effect of RPC on OGTT in diabetic mice n=6)
3.6 RPC对糖尿病小鼠氧化应激的影响由Fig 3可知:经过Met和RPC的7周治疗后,Met组、RPCL组和RPCH组小鼠血浆SOD活力升高,MDA含量降低(P<0.01)。

Fig 3 Effect of RPC on SOD activity and MDA level in diabetic mice n=8)
3.7 RPC对糖尿病小鼠胰腺组织形态学的影响由Fig 4 HE染色可知,Con组胰腺组织、胰岛、以及胰岛细胞无明显病变;与Con组比较,Mod组胰腺组织可见胰岛缩小,结构紊乱,胰岛细胞分布不均匀,边界模糊;与Mod组比较,Met组、RPCL和RPCH组小鼠胰腺组织有所恢复。提示RPC对糖尿病小鼠的胰腺组织病理损伤有明显改善作用。
3.8 RPC对糖尿病小鼠胰腺组织相关蛋白表达的影响由Fig 5可知,Mod组p-AKT/AKT、Nrf2和HO-1表达比Con组明显下降(P<0.01);Met组、RPCL组和RPCH组p-AKT/AKT、Nrf2和HO-1表达比Mod组明显增加(P<0.05),提示RPC能激活PI3K/AKT/Nrf2信号通路。
4 讨论
原花青素是存在于水果、树皮、红酒、绿茶和许多种子中最丰富的多酚类化合物[6],具有抗氧化、降血糖、降血脂、抗肿瘤和保护心血管等多种药理活性。秀丽莓中含有丰富的原花青素,研究表明,原花青素的降糖作用是通过促进外周葡萄糖摄取,保护胰岛细胞和胰腺功能以及调节GLP-1的分泌等途径实现的[7]。本研究结果表明原花青素通过抑制氧化应激而保护糖尿病小鼠胰腺组织的损伤。
糖尿病是由多种因素所引起的代谢性综合症,胰岛β细胞的功能降低和凋亡在糖尿病发病过程中起到了重要的作用[8]。葡萄糖耐量作为胰岛β细胞功能的表征指标,同时可以反映机体对血糖的调节能力。结果显示Mod组小鼠在30 min时血糖浓度达到最高水平,120 min时血糖仍维持在较高水平,表明胰岛β细胞功能受损。RPC组能增强胰岛β细胞功能,改善糖尿病小鼠葡萄糖耐量受损。研究表明原花青素通过胰岛素的合成、分泌和降解来改变β细胞的功能[9],Sun等[10]研究进一步证实原花青素对棕榈酸和H2O2诱导的胰岛细胞凋亡与降低氧化应激有关。

Fig 4 Effect of RPC on morphology of pancreatic tissues in diabetic mice (HE staining×400) A. Con group; B. Mod group; C. Met group; D. RPCL group; E. RPCH group
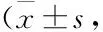
Tab 2 Effect of RPC on biochemical indicators in diabetic mice n=8)

Fig 5 Effect of RPC on expression of p-AKT/AKT, Nrf2 and HO-1 in pancreatic tissues of diabetic mice n=8)
氧化应激是导致胰岛β细胞损伤和凋亡的一个重要因素。糖尿病患者由于长时间接触高糖高脂物质会导致代谢异常并诱发细胞产生过量的活性氧簇[11],引起氧化应激反应,从而导致胰岛β细胞的损伤和凋亡。而MDA和SOD可用于指示机体的抗氧化能力。本研究结果显示RPC使小鼠胰腺组织MDA含量下降,SOD活性增加,表明RPC通过增加抗氧化物质的活性与含量,提高机体抗氧化能力,拮抗氧化应激损伤。
Nrf2/HO-1信号通路参与了多种组织、器官氧化应激的损伤,是细胞对抗氧化应激以维持细胞内稳态的关键通路[12]。正常状况下,Nrf2以胞浆中的二聚体形式与Keap1蛋白结合,当机体受到活性氧刺激时,活化后的Nrf2从Keap1上解偶联转移至细胞核中与抗氧化反应元件结合并激活靶基因HO-1的转录[13];HO-1能清除氧自由基,从而产生抗氧化损伤[14]。
PI3K/ AKT信号通路广泛存在细胞中,参与细胞外信号促进代谢、增殖、细胞存活、生长、凋亡、炎症反应等重要的细胞活动[15]。研究发现,该途径与多种疾病相关联,如肿瘤、肥胖症和糖尿病[16-17]。正常情况下,调节亚基p85对PI3K起着抑制作用,当细胞受到细胞外信号刺激后,p85激活催化亚基p110让PI3K活化,并催化PIP2为PIP3,进而导致AKT磷酸化使之被激活,激活后从质膜进入胞质,使Nrf2蛋白的丝氨酸位点磷酸化,削弱与Keap1的结合,增强其表达并促进Nrf2向细胞核转运,从而引起信号的级联反应[18]。在本研究中,RPC能够激活PI3K/AKT信号通路,引发Nrf2/HO-1的激活,进而抑制氧化应激对胰岛β细胞的损伤。
本研究结果表明,秀丽莓原花青素通过激活PI3K/AKT/Nrf2信号通路,减轻糖尿病小鼠的胰岛β细胞氧化应激损伤,从而使糖尿病小鼠损伤的胰腺组织得到改善。

