基于网络药理学的双黄杞贞克瘤方抗肿瘤机制
郎晓娜,邱玉玲,孔德新
(1.天津医科大学药学院,天津 300070;2.天津市天津医院药学部,天津 300211)
双黄杞贞克瘤方包含的黄精、灵芝、黄芪、枸杞子和女贞子5种中药,均具有显著地抗肿瘤功效。本研究对该组方进行网络药理学分析,研究组方的活性成分和抗肿瘤机制,为今后的实验研究提供有效且合理的数据。
1 材料与方法
1.1 收集和筛选双黄杞贞克瘤方中的5种中药(黄芪、黄精、枸杞子、女贞子、灵芝)的活性成分在中药系统药理学数据库TCMSP(https://tcmspw.com/tcmsp.php)中搜索并收集黄芪、黄精、枸杞子、女贞子和灵芝的活性成分及靶点。本文筛选药物活性成分的依据是口服利用度(OB)≥0.3,类药性(DL)≥0.18,从而进行筛选。并且找到其相对应的靶点。将其导入Excel表格中进行规范化处理以便于后续研究分析。整理后的靶点使用Uniprot 数据库(https://www.uniprot.org),将靶点的来源物种校正为Human,并整理记录靶点蛋白的基因信息,用于之后研究的规范性处理。
1.2 收集疾病的相关靶点信息通过Gene Cards数据库(https://www.genecards.org/)、TTD数据库(http://db.idrblab.net/ttd/)和OMIM数据库(https://www.omim.org/)以“tumour”为关键词检索肿瘤相关靶点,并将其导入Excel表格中进行规范化处理以便于后续研究分析。
1.3 筛选核心靶点并构建网络图将活性成分所对应的靶点基因和肿瘤相关靶点基因进行匹配,通过绘制韦恩图找到核心靶点(http://bioinformatics.psb.ugent.be/webtools/Venn/)。采用Cytoscape 3.7.2软件来构建“药物-活性成分-靶点”和“核心活性成分-核心靶点”网络。
“药物-活性成分-靶点”网络中的节点表示这5种中药的活性成分以及活性成分对应的靶点基因。整体网络是来展示药物-活性成分与其对应靶点的联系。为作图易看并且方便,成分用不同颜色区分,各个活性成分用其名称的拼音首字母加阿拉伯数字标记,5种中药共有的成分用大写字母A、B、C表示。“核心活性成分-核心靶点”网络中的节点表示与疾病相关的活性成分及其对应靶点基因。通过构建网络来探讨5种中药抗肿瘤的作用机制。
1.4 构建蛋白质网络PPIString数据库(https://string-db.org/,Version11.0)可以用来检索蛋白质之间的相互作用关系。将“1.3”项中所获得的核心靶点导入String数据库,将研究物种设置为人类(Homo sapiens),将置信度选择“高置信度”(置信度>0.9),其他参数为默认值,同时删除网络中未与其他基因靶点具有互作关系的基因靶点,从而获得结果可信度较高的重要基因靶点蛋白的互作关系。将网络数据导入 Cytoscape3.7.2软件进行可视化处理,绘制蛋白互作网络图。设置用网络中的节点的大小以及颜色深浅来反映Degree值的大小,边的粗细来反映Combine score的大小。
1.5 对靶点进行GO分析,KEGG通路富集在 Metascape在线平台(http://metascape.org/)输入核心靶点,设置P<0.01,进行 GO富集分析[由细胞成分(cellular component,CC)、分子功能(molecular function,MF)、生物过程(biological process,BP)三部分组成]和KEGG(Kyoto Encyclopedia of Genes and Genomes)分析,按P值升序排列,各选择前20条分析结果,通过OmicShare网站(https://www.omicshare.com/)分别绘制高级气泡图,将结果可视化。
小波变换的阈值去噪过程中,选取合适的阈值和恰当的分解层次是保证良好去噪效果的首要条件。为避免因阈值选取不合理而影响信号去噪,本文在对微流控芯片信号去噪过程中引进能量元的方法,通过能量元放大有用信号和噪声小波系数之间的差异,在阈值选取时有更大的裕度[11],更容易选取较为合理的阈值。
1.6 绘制“靶点-通路”网络图将得到的前20条KEGG富集通路与相关作用靶点整理后导入Cytoscape3.7.2中,绘制“靶点-通路”网络图。
2 结果
2.1 活性成分筛选结果通过TCMSP数据库共检索到黄芪的化学成分87个,黄精的化学成分38个,枸杞子的化学成分188个,灵芝的化学成分242个,女贞子的化学成分119个。以OB值≥0.3,DL值≥0.18为标准筛选得到各高度活性的化合物,得到黄芪的活性成分20个,黄精的活性成分12个,枸杞子的活性成分45个,灵芝的活性成分61个,女贞子的活性成分13个。合并整理后得到共145个活性成分,其中有3个活性成分重叠出现,结果见Tab 1。由于数量较多,表格只展示部分活性成分。
在TCMSP数据库继续用活性成分去检索其相关靶点,将没有搜索结果的活性成分删除,把5种中药找到的活性成分及对应靶点整理到Excel表格中,将每种中药的相关靶点合并去重,并用Uniprot数据库为靶点基因找出对应的基因名,将靶点的来源物种校正为 Human,找不到的靶点视为无效并删除,将结果规范化,用于以后的分析。得到的结果分别是:黄芪的靶点为200个,黄精的靶点为76个,枸杞子的靶点190个,灵芝的靶点为37个,女贞子的靶点为174个。绘制韦恩图后可发现5种中药的靶点都有交集,共同拥有的靶点有22个。体现出这5种中药之间共同靶点的关系,揭示其协同作用的药理学特点。5种中药的靶点合并去重后,通过Uniprot数据库规范化以后共得到241个靶点。通过Cytoscape3.7.2软件作“药物-活性成分-靶点”的蛋白质互作网络图。
通过作图得出:网络中共319个节点,1 215条边。319个节点包括78个活性成分和241个靶点。其中每个活性成分平均作用于15.58个靶点,每个靶点链接药物数量为5.04。这代表5种中药是有共同的成分和靶点作用于疾病。药物作用是多途径、多靶点、多环节的,整体以协同方式发挥药效。
结果显示,拥有最多靶点的是槲皮素(quercetin),共有146个;其次是山奈酚(kaempferol),共有60个;木犀草素(luteolin),共有55个;7-O-甲基-异微凸剑叶莎醇(7-O-Methylisomucronulatol)共42个;β-谷甾醇(β-sitosterol),共35个靶点。此外,槲皮素、山奈酚、β-谷甾醇这3种化合物重复出现在5种中药中,表明该成分有关键的作用。
2.2 疾病基因筛选结果通过OMIM平台,TTD数据库,Gene Cards数据库对疾病靶点进行搜索,以“tumour”为关键词检索肿瘤的疾病相关靶点。OMIM平台搜索到相关基因354个,TTD数据库搜索到87个,Gene Cards数据库由于数量过多,按照Relevance Score分数由高到低进行排序,筛选到数值较大的靶点,共搜索到930个,合并三大数据库的数据之后去重共得到1 285个疾病靶点。

Tab 1 The active compounds in five kinds of traditional Chinese medicine with their OB and DL parameters
2.3 核心靶点筛选及构建网络图将药物靶点和与肿瘤相关的靶点基因进行匹配,并绘制韦恩图得到核心靶点,见Fig 1。

Fig 1 Matching of target genes between disease and drug
其次,可得知共有113个靶点是5种中药共同直接作用于肿瘤的核心靶点。再将靶点数据及其相关活性成分导入Cytoscape软件可构建“核心活性成分-核心靶点”的网络图,可发现核心活性成分和核心靶点之间是紧密相连,这些与关键靶点有相互作用关系的药物成分可能是药物活性成分发挥抗癌作用的重要物质基础。
通过网络分析并获得度值(Degree)排名前10的核心靶点,其中RB1和CCND1度值相同,均被选入。见Tab 2。

Tab 2 Key targets
2.4 构建蛋白质网络PPI通过将这113个核心靶点导入String数据库得到蛋白质互作网络数据,用Cytoscape3.7.2软件得到这些靶点的关系网,见Fig 2。设置网络中的节点大小以及颜色深浅反映了Degree值大小,颜色较深、圆圈较大的基因是度值较高的靶点基因,连线较粗、颜色较深表示靶点之间相关性较大。根据度值排名靠前的靶点作为核心靶点,用Cytoscape3.7.2软件得到更清晰简易的关系网,见Fig 3。

Fig 2 Protein interaction network of key targets

Fig 3 Protein interaction network of top key targets
2.5 对靶点进行GO分析,KEGG通路富集通过使用Metascape在线平台(http://metascape.org/)输入核心靶点,设置P<0.01,进行GO富集分析和KEGG分析,按P值升序排列后,再通过OmicShare平台对结果进行可视化分析。
2.5.1GO富集分析 在Metascape数据库以P<0.01对结果进行筛选,对113个核心靶点进行GO功能富集分析。将P值按照升序排列后可以发现:药物抗肿瘤的作用靶点是涉及大量不同的生物学过程,共有2 236个GO术语条目,其中CC为66个,MF为132个,BP为2 038个,以校正后P为标准升序选取BP前20条作图,图左侧为富集名称,气泡颜色由红到蓝代表 neg.Log10(P)值由小到大,气泡越大代表该通路的基因计数越多,横轴代表输入基因占该通路基因的比率,导入OmicShare平台处理,见Fig 4-6。

Fig 4 GO-biological process analysis of key targets
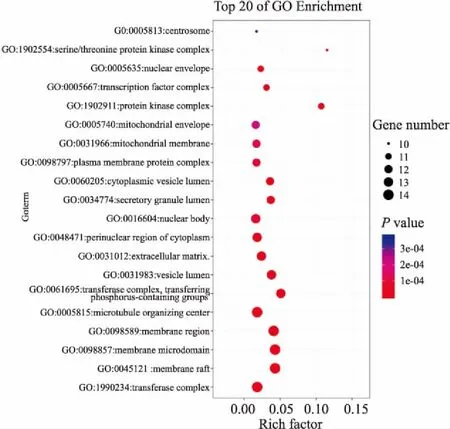
Fig 5 GO-cellular component analysis of key targets
2.5.2KEGG分析 这5味中药对作用于肿瘤的PPI网络中的核心靶点主要涉及影响肿瘤细胞增殖和凋亡的信号通路如MAPK信号通路、PI3K/Akt信号通路以及TNF信号通路等,前列腺癌和膀胱癌发生和发展相关的通路,糖尿病并发症中的AGE-RAGE信号通路、肺结核信号通路和病毒感染的信号通路等方面。根据气泡图可得知这5味中药对于肿瘤的干预,涉及了多个生物过程,见Fig 7。
2.6 绘制“靶点-通路”网络图将双黄杞贞克瘤方中前20条KEGG富集通路和其对应的核心靶点导入Cytoscape3.7.2,绘制出“靶点-通路”网络图,网络图可反映出该组方抗肿瘤具有“多靶点、多通路”的调控特点。
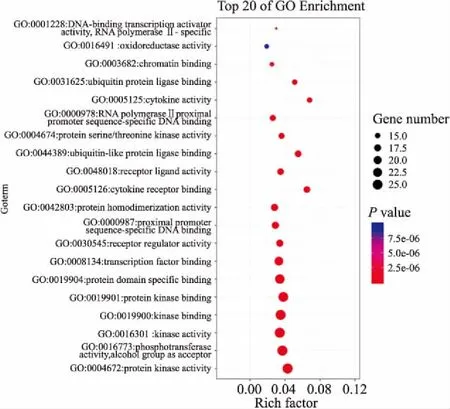
Fig 6 GO-molecular function analysis of key targets

Fig 7 KEGG pathway analysis of key targets
3 讨论
本研究分析了双黄杞贞克瘤方的5种成分:黄精、灵芝、黄芪、枸杞子和女贞子,从中得到的145个有效活性成分,通过网络图分析预测出5个潜在的活性成分:槲皮素、山奈酚、木犀草素、7-O-甲基-异微凸剑叶莎醇、β-谷甾醇。槲皮素是广泛的存在于多种药物中的多醇羟基黄酮类化合物,有研究表明它能通过诱导凋亡、抑制迁移来抑制宫颈癌细胞的生长[5]。山奈酚是一种黄酮类化合物,报道显示其可以抑制多种肿瘤细胞周期进程,诱导细胞凋亡,从而抑制肿瘤的迁徙和转移[6-8]。β-谷甾醇可以有效的抑制结肠癌、前列腺癌和乳腺癌等癌症细胞的增殖和迁移[9]。这几种潜在的活性成分在双黄杞贞克瘤方抗肿瘤活性中发挥重要作用。
通过蛋白质互作网络图分析并预测,本研究获得的与通路密切相关的核心靶点是TP53、AKT1、JUN、MAPK1、TNF、RELA、IL-6、MAPK8、MAPK14、RB1、CCND1,该结果与之前预测的靶点基本相同。TNF又称肿瘤坏死因子,参与肿瘤细胞的凋亡过程、影响肿瘤血管系统和增强宿主的免疫力等。AKT1为一种蛋白激酶,参与了乳腺癌、前列腺癌等多种癌症的发生、发展、转移和复发的多个环节[10]。AKT1可以作为肺癌的早期诊断标志物,成为抗肺癌新药研发的靶点之一[11]。TP53是重要的抗癌基因之一,通过在细胞核中的转录依赖功能调节基因转录,参与细胞周期进程。TP53还可以通过非转录依赖功能诱导细胞凋亡和自吞噬[12]。TP53可作为很多肿瘤的检测指标,比如:淋巴瘤、胃癌、血液病和结肠癌、乳腺癌、食管癌、卵巢癌、肺癌等[13]。c-Jun是JUN基因中的一种,研究证明,c-Jun可以作为乳腺癌的预后指标,也参与结直肠癌的发生和发展[14]。MAPK1、MAPK8和MAPK14均为丝裂原活化蛋白激酶,在多种肿瘤组织中呈现高表达,如胃癌、肝癌和胰腺癌等[15]。原癌基因CCND1(细胞周期蛋白D1)的表达异常在乳腺癌、胃癌和膀胱癌等肿瘤细胞的迁移和侵袭过程中有着重要作用[16]。RB1(视网膜母细胞瘤蛋白1)对视网膜母细胞瘤、胰腺癌、乳腺癌和肺癌等都有抑制作用。IL-6是由多种细胞产生的多功能细胞因子,在T淋巴细胞、B淋巴细胞和造血干细胞的增殖,自身免疫性疾病发生、肿瘤细胞生长等方面都有重要作用[17]。RELA能激活癌细胞的增殖或迁移以促使食管癌进展。提示我们,预测出的潜在核心靶点均与抗肿瘤机制有关,都在药物治疗过程中靶向性发挥抗肿瘤作用。
结合GO生物过程分析和KEGG富集分析的结果,得到有关该组方抗肿瘤机制的信息如下:① 结果中显示有P13K-Akt、MAPK和TNF信号通路以及Apoptosis(细胞凋亡)等。这些通路都是影响肿瘤细胞增殖和凋亡的信号通路。肿瘤是由于基因变异导致的,由于基因转录翻译出现异常、细胞的信号传递出现失误,就可能引起细胞的增殖异常表达,增殖过度和凋亡减少都是肿瘤细胞的基本特征。② 通路的富集结果除了以上肿瘤相关信号通路、前列腺癌和膀胱癌等具体癌症类型发生与发展相关的通路,也发现了糖尿病、肺结核以及病毒感染相关的信号通路,这可以解释为这些疾病相关的某些信号通路可能与肿瘤是共通的,同时也提示我们在研究其抗肿瘤作用的同时需要留意可能产生的副作用。
综上所述,本研究基于网络药理学方法分析了双黄杞贞克瘤方的多成分-多靶点-多途径抗肿瘤机制。结果显示,槲皮素、山奈酚、β-谷甾醇等主要活性成分作用于TP53、AKT1、JUN、MAPK1、TNF、RELA、IL-6等靶点,通过抑制肿瘤细胞的增殖、迁移,诱导凋亡,影响肿瘤血管系统和增强宿主免疫力等来发挥抗肿瘤作用。

