磷酸二酯酶8型抑制剂PF-04957325对大鼠心脏正性肌力作用及其机理
肖钰洁,高倩雯,王羽维,朱晓佳,陈可塑,刘福明,王荣荣,陈 龙,
(1. 南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023; 2. 南京大学医学院附属医院,金陵医院门诊部伤口护理中心,江苏 南京 210000;3. 南京中医药大学 附属医院,江苏省中医院, 江苏 南京 210029; 4. 泰州中国医药城中医药研究院,江苏 泰州 225300)
磷酸二酯酶(phosphodiesterase,PDE)有11个家族(PDE1-11),每一个家族有若干个不同基因型及剪接变体,因此有超过100个同工酶。每一个PDE家族呈现在细胞内特定的部位,并表现出独特的调节作用,目前已明确PDE1、 2、 3、 4、 5、 8、 9在心肌细胞内表达。磷酸二酯酶(PDEs)具有水解细胞内cAMP-环磷酸腺苷或/和cGMP-环磷酸鸟苷的功能,降解细胞内cAMP或/和cGMP,从而终结这些第二信使所传导的生化作用。PDEs在人体内分布广泛,生理作用涉及多个研究领域。目前以PDE作为靶点的药物用于抗心衰药物开发越来越受关注,其中,PDE1, 2, 3水解cAMP及cGMP,PDE4及PDE8仅水解cAMP,PDE5及PDE9仅水解cGMP[1-2]。PDE3[3]、PDE4[4]、PDE5[5]、PDE7[6]等药理学作用均有研究报道,而PDE8在体动物研究鲜有报道。
PDE8是对cAMP具有高度的亲和力和特异性,研究表明PDE8抑制剂具有广泛的生理药理作用。PDE8家族由PDE8A和PDE8B基因编码组成,PDE8A是一种PDE亚型,主要与线粒体有关,与cAMP的亲和力是PDE4的40-100倍,PDE8A mRNA和蛋白在心肌细胞中含量丰富。PDE8A在免疫过程中很重要,如T细胞激活、效应器T细胞粘附、趋化作用[7-9]以及乳腺癌细胞的运动[10]。PDE8A在睾丸中含量非常丰富,但也存在于人和小鼠的心脏中[11]。最近对PDE8A基因敲除小鼠的研究表明,PDE8A在小鼠心脏的心室肌细胞中表达[12]。此外,PDE8抑制剂增加细胞内cGMP浓度而舒张气管平滑肌,对哮喘和慢性阻塞性肺等疾病具有潜力。
PDE8B广泛分布于胞质中,据报道,PDE8B在人类甲状腺细胞中含量很高,间接证据表明它在胰腺细胞中表达。由于缺乏选择性的药理抑制剂,磷酸二酯酶8B(PDE8)家族的功能在很大程度上尚不清楚。这些发现进一步表明,PDE8B是治疗几种不同肾上腺疾病的潜在治疗靶点。
PDE8合适的抑制剂相对较少,因此研究其功能的药理学方法一直受到阻碍。PDE8对广谱的甲基黄嘌呤类PDE抑制剂如3-异丁基-1甲基黄嘌呤(IBMX)不敏感。广泛的PDE抑制剂双嘧达莫是唯一已知的抑制PDE8酶的化合物,其对这些酶的抑制作用较弱。但最近发现其抑制剂PF-04957325,有利于寻找新的药物研究突破。来自PDE8 基因敲除心脏的心肌细胞在异丙肾上腺素诱导的[Ca2+]瞬变、L型Ca2+通道电流(ICa)和Ca2+火花活动中引起更大的增加,这表明PDE8A控制cAMP参与心肌细胞的Ca2+处理[8]。有趣的是,PDE8A缺失导致RyR通道泄漏,其表现为肌质网钙离子再充盈的代偿性增加[8]。这些效应的机制目前正在研究中。PDE8A缺乏对慢性病理性心脏重构和心功能不全的影响也值得进一步研究。
虽然PDE8水解cAMP的机理非常明确,但由于PDE8在心肌细胞器内的分布并不均匀,因此PDE8作用下细胞内cAMP的浓度降低也就不均等,呈现出的心肌功能并不等同cAMP的浓度降低的作用。本研究采用PDE8抑制剂,对心脏血流动力学的特点进行研究,间接分析PDE8可能的作用机理。通过本研究为判断PDE8能否作为靶点研发正性肌力的药物用于临床治疗心力衰竭提供理论依据。
1 材料与方法
1.1 实验药品与试剂PDE8抑制剂PF-04957325购于Glpbio,货号GC32701,纯度大于99.94%; Fluo-4AM购于上海东仁化学科技有限公司,货号F312;其它试剂均购于Sigma公司。
1.2 实验仪器多导生理记录仪(PowerLab 8/35,澳大利亚AD Instruments公司);放大器(35-2083 Rev. F Millar)、双压力-容积导管(SPR-901型) (美国MILLAR公司);Langendorff离体心脏灌流装置(M402173,中国西化仪北京科技有限公司);灌流给药系统(美国VC3-8,ALA公司);Olympus IX53倒置显微镜(日本Olympus公司);科研级高灵敏致冷CCD (ZYLA-5.5-CL3,英国ANDOR公司);超高速波长切换装置(Lambda DG-4,美国Sutter)。
1.3 实验动物8周龄的成年SD大鼠,♂,体质量250 g,购于南京中医药大学实验动物中心,实验动物使用许可证:SCXK(浙)2019-0002;动物实验伦理批准号:202005A045;饲养室内12 h明暗周期,温度(21-26)℃,湿度40%-70%,自由进食和饮水。
1.4 浓度设计经大鼠在体预实验,选择PF-04957325剂量能够引起最大药效的最低剂量(大约),最终选择剂量为0.5 mg·kg-1的PF-04957325进行在体实验。离体心脏收缩力实验PF-04957325浓度为0.001、 0.01、 0.1和1 μmol·L-1。心肌细胞钙释放实验在室温条件下进行,为了实验功能变化最大化并分析其机理,PF-04957325浓度选择为1 μmol·L-1。
1.5 在体大鼠压力-容积环分析按照本实验室之前方法[1, 13-14],用20%乌拉坦(5 mL·kg-1)腹腔注射麻醉。Millar双压力导管经右侧位的颈总动脉插入到大鼠体内,一个压力感受器及一个测量血液容积的电导探测器放置于左心室,另一个压力感受器放置于主动脉。记录左心室压力-容积环以及主动脉压力。将PF-04957325溶于DMSO (0.3 mL)后腹腔注射,待药效稳定后记录大鼠加药后各血流动力学参数。实验结束后,自颈静脉推注30%高渗盐水20-50 μL并取自身血液进行容积定标。
1.6 离体大鼠心脏左心室收缩力测定大鼠麻醉方法同在体实验,迅速取心脏置于(0-4) ℃无钙台氏灌流液中,使其停搏。离体大鼠心脏挂于已充满灌流液的Langendorff装置上,在充氧(95% O2+5% CO2),温度为(37.5±0.5) ℃条件下,经主动脉逆行灌流,灌流压为90 cm H2O(1 cmH2O=0.098 kPa)。将充满灌流液并排空气泡的压力换能器插管,经由左心房插入左心室,连接RM6240型多道生理信号采集处理系统用以记录左心室收缩曲线。将刺激强度约5 V的一对刺激电极加于离体心脏心房两侧,刺激心脏以4 Hz固定频率(即心率240)进行起搏。PF-04957325溶于20 mL含钙灌流液中配制成相应浓度(0.001, 0.01, 0.1, 1 μmol·L-1),灌流给药。灌流液的组成(mmol·L-1):NaCl 135,KCl 5.4,NaH2PO40.33,HEPES 5,Glucose 10,MgCl21,CaCl21.8,NaOH调pH至7.3-7.4。
1.7 大鼠左心室心肌细胞场刺激诱导的钙释放首先用含2 g·L-1胶原酶Ⅱ消化心脏获得单个大鼠心室肌细胞[14]。细胞悬液加入钙荧光指示剂Fluo-4 AM (5 μmol·L-1)于37 ℃避光孵育30 min。使用激光共聚焦显微镜激发细胞中的Fluo-4发出荧光,采用空气冷却CCD相机采集并记录荧光信号。由刺激器通过一对电极将频率为1 Hz,强度为15 V的刺激加于心肌细胞两侧,刺激细胞收缩并记录钙释放。记录其曲线作为空白对照,随后灌流含PF-04957325 (1 μmol·L-1)的灌流液约5 min,再次刺激细胞并记录钙释放,当钙释放曲线稳定后记录其曲线作为PF-04957325的效应。
1.8 大鼠左心室心肌细胞咖啡因诱导的钙释放分析Na+-Ca2+交换体(Na+-Ca2+exchanger, NCX)及质膜Ca2+泵(plasma membrane Ca2+-ATPase, PMCA)作用加载钙荧光指示剂Fluo-4 AM的大鼠左心室肌细胞,用含有1.8 mmol·L-1Ca2+的台氏液作为细胞外液灌流,用1 Hz场刺激至少20次,确保肌浆网中Ca2+含量稳定。结束刺激后,喷射咖啡因(Caffeine,20 mmol·L-1)于细胞表面,诱导出完全的钙瞬变,此时的钙瞬变的下降相主要由NCX和PMCA介导,其Ca2+释放下降相经拟合获得的衰退常数即为rNCX+PMCA,该常数反映NCX和PMCA外排钙于细胞外的功能。
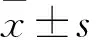
2 结果
2.1 PF-04957325对在体大鼠血流动力学的作用与正常组相比,PF-04957325 (0.5 mg·kg-1,ip)显著增加左心室搏出功(stroke work,SW)、心输出量(cardiac output,CO)、每搏输出量(stroke volume,SV)、收缩末期压(end-systolic pressure,Pes)、心率 (heart rate,HR)、射血分数(ejection fraction,EF)、动脉收缩压(systolic pressure,SBP);降低收缩末期的容积(end-systolic volume,Ves)、舒张末期的容积(end-diastolic volume,Ved)、动脉舒张压(diastolic blood pressure,DBP)、外周血管阻抗(arterial elastance,Ea)。其中,Ea=Pes/SV,即外周动脉系统中单位容量变化带来的压力变化,其值越大血管阻力越大。实验结果及代表性P-V loop见Tab 1, Fig 1及Fig 2。
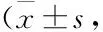
Tab 1 Effects of PF-04957325 (0.5 mg·kg-1, ip) on left ventricular and aortic hemodynamic parameters of anesthetized normal rats n=5)
2.2 PF-04957325对大鼠离体心脏收缩力的作用为了排除神经体液因素的影响,大鼠离体心脏灌流实验被用于分析PF-04957325对心脏的直接作用。离体心脏实验除采用心脏自发节律(non-pacing)外,还采用固定频率刺激法(pacing)触发离体心脏产生恒定频率收缩,排除心率对收缩力的影响。Pacing法采用4 Hz刺激频率,该频率形成的心率为240次/min,与Non-pacing法的心率相近。结果表明:PF-04957325 (0.001、 0.01、 0.1、 1 μmol·L-1)浓度依赖性地增加大鼠左心室non-pacing及pacing法的左心室发展压(left ventricular developed pressure,LVDP)及左心室压力上升最大速率(+dp/dtmax);在non-pacing状态下,心率出现浓度依赖性降低。见Tab 2及Fig 3。

Fig 1 Representative simultaneously recorded curves of rat left ventricular pressure, volume and aortic blood pressure (A), and derived left ventricular pressure-volume relationship (B) before and after administration of PF-04957325 (0.5 mg·kg-1, ip)
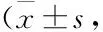
Tab 2 Effects of PF-04957325 on left ventricular contractility and heart rate in isolated rat hearts in non-pacing and pacing modes n=5)

Fig 2 Simultaneously recorded curves of rat left ventricular pressures (A) and aortic blood pressures (B) before and after administration of PF-04957325 (0.5 mg·kg-1, ip)
2.3 PF-04957325对大鼠左心室心肌细胞钙释放的作用钙释放曲线分为快速上升相及下降相,上升相主要由RyR2通道开放引起肌浆网钙释放至胞质,其幅值的大小本质上取决于肌浆网与胞质之间Ca2+浓度梯度。下降相主要由肌浆网钙泵2a (sarcoplasmic reticulum Ca2+-ATPase-2a, SERCA2a)回吸收钙至肌浆网,以及通过膜NCX及PMCA外排至细胞外引起的。其中SERCA2a的回吸收介导了快速下降相,其回吸收钙的速率常数为α,NCX和PMCA外排钙于细胞外介导了缓慢下降相,速率常数为β。实验结果表明:PF-04957325(1 μmol·L-1)增加大鼠左心室钙释放幅值从正常对照组的100.00±63.01增加到PF-04957325组的119.01±79.87

Fig 3 Representative left ventricular developed pressure curves from isolated rat hearts in non-pacing and pacing modes before and after perfusion of PF-04957325 (0.001, 0.01, 0.1, 1 μmol·L-1)
2.4 PF-04957325对大鼠左心室心肌细胞NCX及PMCA的作用本实验在场刺激诱导钙释放的基础上,结合高浓度咖啡因诱导的肌浆网RyR2完全开放,使肌浆网与胞质之间的钙浓度梯度消失,从而间接废除肌浆网SERCA2a的功能,实现胞质钙浓度下降由NCX及PMCA外排细胞外所介导。实验结果表明,PF-04957325 (1 μmol·L-1)未明显改变NCX及PMCA联合活性速率常数(rNCX+PMCA)[从对照组的0.144±0.064到PF-04957325组的0.143±0.081, 两组均为n=12)。线见Fig 5。

Fig 4 Representative curves of field stimulation induced Ca2+ transients and representative curve fittings by two exponential equation

Fig 5 Effect of PF-04957325 (1 μmol·L-1) on decaying rate constant of Ca2+ extrusion by NCX plus PMCA (rNCX+PMCA)
2.5 PF-04957325 增加了p-PLB Ser-16和p-PLB Thr-17磷酸化,而对RyR2磷酸化没有明显影响PF-04957325(1 μmol·L-1)明显增加p-PLB Ser-16 [从对照组的(100±45.8)% 增加到PF-04957325组的(345±112.5)% ,P<0.05,n=6] 和p-PLB Thr-17[从对照组的(100±16.3)% 增加到PF-04957325组的(165±39.3)%,P<0.05,n=6]的磷酸化水平。总的PLB 水平[从对照组的(100±59.7)% 到PF-04957325组的(89±41.8)%,P>0.05,n=6] 没有明显影响。然而,PF-04957325 (1 μmol·L-1)对p-RyR2Ser2808 [从对照组的(100±44.7)%到PF-04957325组的(116± 53.8)%,P>0.05,n=6]和p-RyR2Ser-2814 [从对照组的(100±29.53)%到PF-04957325组的(114±16.9)%,P>0.05,n=6] 以及总的RyR2 水平[从对照组的(100±56.0)%到PF-04957325组的(116±48.4)%,P>0.05,n=6]没有明显影响。见Fig 6。
3 讨论
本研究从整体、离体心脏及细胞水平阐明了PDE8抑制剂PF-04957325对正常大鼠血流动力学作用及其细胞的作用机理,虽然没有研究其心脏病理模型条件下的作用,但为病理模型研究提供了理论基础。同时也间接提供了PDE8对血流动力学的作用及其机理。
双压力-容积环实验表明,PDE8抑制剂PF-04957325具有正性肌力作用,其主要收缩力指标如搏出功、每搏输出量及射血分数等显著增加。而涉及到压力-容积环的左心室血流量与外周血管的回心血量有关,回心血量与外周血管的扩张程度外周阻力有关,结果PF-04957325表明增加收缩压、降低舒张压及血管外周阻力。此外,离体心脏实验同样表明PF-04957325具有正性肌力作用,表明PF-04957325的这种作用是不依赖于神经体液。然而,PF-04957325对心率的作用,在体与离体表现相反的作用,PF-04957325对心脏的直接作用(离体心脏实验)是减慢心率;而在体实验条件下,PF-04957325显著增加心率。在体实验条件下,PF-04957325增加心率可能是降低血管外周阻力导致的交感神经活性增强,但这需要进一步实验确认。
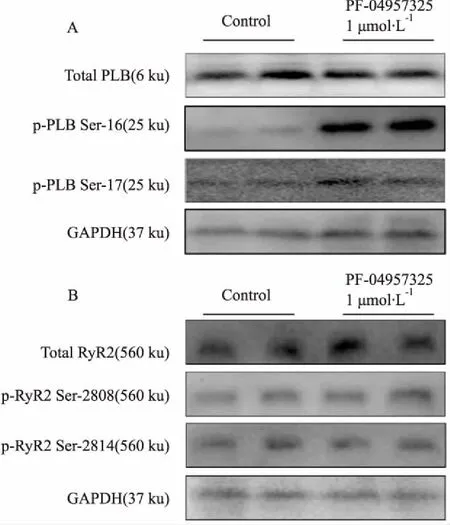
Fig 6 Representative Western blot of phosphorylated expressions of PLB (A) and RyR2(B) induced by PF-04957325 (1 μmol·L-1)
基于正性肌力作用与胞质钙释放有着密切关联,本研究采用钙释放实验探讨PF-04957325正性肌力的作用机理。钙释放直接影响心肌的收缩与舒张,受到多种因子和酶的调控。钙从肌浆网中释放到胞质,必须具备两个条件,一是肌浆网钙浓度高于胞质,二是钙释放的通道RyR2受体通道突然开放。随后舒张期钙被肌浆网SERCA2a逆浓度耗能回吸收到肌浆网,还有少量钙经过细胞膜上NCX及PMCA外排出细胞。RyR2受体及SERCA2a功能受多种酶的调控,其中包括蛋白激酶A (protein kinase A,PKA)[15]及钙/钙调蛋白依赖性蛋白激酶II (Ca2+/calmodulin-dependent protein kinase II,CaMKII)[16]。在场刺激诱导的钙释放实验中,PF-04957325增加肌浆网的钙释放幅值,该作用是肌浆网SERCA2a活性增加而导致肌浆网内钙浓度梯度增加。
Western blot实验表明PF-04957325增加受磷蛋白(PLB)的16位丝氨酸及17位苏氨酸磷酸化水平,对兰尼碱受体(RyR2)的2808位丝氨酸及2814位丝氨酸磷酸化水平无显著性变化。PDE8对cAMP具有高度的亲和力和特异性,PF-04957325作为PDE8的抑制剂,导致cAMP胞内浓度增加。理论上应该导致PLB的16位丝氨酸及RyR2的2808位丝氨酸磷酸化水平增加,而PLB 17位苏氨酸是由CaMKII介导的,增加cAMP并不能够导致PLB 17位苏氨酸直接磷酸化。这些与实验结果相矛盾,可能的解释是胞内的PDE8的分布并不均匀,表现出使用PF-04957325后,胞内的cAMP并非在每一个细胞器内浓度均增加。其外,PF-04957325也可能抑制其它蛋白酶。
综上所述,PDE8抑制剂PF-04957325通过增加PLB磷酸化水平提高SERCA2a活性,发挥其对大鼠心脏正性肌力作用,降低外周血管阻力,从而导致舒张压降低。

