理中汤调控Raf/MEK/ERK信号通路抗大鼠胃溃疡的效应与机制
宋厚盼,陈小娟,曾梅艳,陈新怡,仇婧玥,吴嫚婷,彭清华
(湖南中医药大学 1. 中医诊断学湖南省重点实验室、2. 中医心肺病证辨证与药膳食疗重点研究室、 3. 中医药防治眼耳鼻咽喉疾病湖南省重点实验室、4. 中医方证研究转化医学湖南省重点实验室,湖南 长沙 410208)
胃溃疡(gastric ulcer,GU)是一种困扰全世界的发病率和复发率均较高的消化系统疾病。GU多发生于胃窦小弯和胃角,临床主要表现为规律性的上腹疼痛、烧心、反酸、恶心、呕吐、腹胀、黑便等[1-2]。胃黏膜上皮细胞损伤及其诱导的炎症反应是GU发病的重要病理环节。有丝分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是存在于真核细胞内的一组丝氨酸/苏氨酸蛋白激酶,细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路是最经典的MAPK信号转导途径,丝氨酸/苏氨酸蛋白激酶Raf通过激活有丝分裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)介导的ERK磷酸化是GU发病过程中最具特征的信号途径变化。Raf/MEK/ERK信号通路的异常改变可对溃疡过程胃黏膜上皮细胞的迁移、增殖、凋亡产生明显影响[3]。
近年来,GU的中医学病因病机、辨证治疗方法、证候规律等方面的研究均取得了较大进展[4]。脾胃虚寒为GU病理过程胃黏膜上皮损伤的发病基础,脾胃虚寒始终贯穿于胃黏膜上皮损伤的病理环节。采用温中益气健脾为主的治疗方法是促进GU修复的基本法则[5]。理中汤是温中益气健脾治法的基础方和代表方,是临床治疗GU气虚里寒、腹中拘急疼痛的重要方剂,具有较好的临床疗效,但有关本方抗溃疡效应的分子机制有待进一步阐明。本研究通过构建脾胃虚寒型GU病证结合动物模型,基于Raf/MEK/ERK信号通路探讨理中汤治疗GU的效应及可能的分子机制,旨在将理中汤推广运用于胃溃疡的临床治疗提供理论依据和实验基础。
1 材料与方法
1.1 实验动物60只体质量(180±20)g 的SPF级雄性Sprague Dawley(SD)大鼠,购自湖南长沙斯莱克景达实验动物有限公司,于湖南中医药大学实验动物中心,许可证编号:SCXK(湘)2016-0002饲养,动物质量合格证编号:43004700050332。动物房环境温度(24±1)℃,湿度(50±5)%,采用12 h(光)/12 h(暗)循环周期饲养。适应性喂养3 d后开始正式实验,期间给予大鼠自由摄食与饮水。
1.2 试剂50×通用型蛋白酶磷酸酶抑制剂(051419191101)购自碧云天生物技术有限公司;大鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA试剂盒(CRE0003)购于北京四正柏生物科技有限公司;大鼠前列腺素E2(prostaglandin E2,PGE2)ELISA试剂盒(N01608)购于上海纪宁实业有限公司;超氧化物歧化酶(superoxide dismutase,SOD)(BC0170)活性检测试剂盒购于北京索莱宝科技有限公司;胃蛋白酶活性检测试剂盒(20190309)购于北京索莱宝科技有限公司;自发荧光淬灭剂(G1221),柠檬酸抗原修复液(G1202),牛血清白蛋白(G5001),HE染色套装试剂(G1003),EDTA抗原修复液(G1206)均购于武汉Servicebio生物科技有限公司;磷酸化B-Raf(Ser446)一抗(AF10183263),磷酸化MEK1/2(Ser222)一抗(AA12194578),磷酸化ERK1(Thr197 + Thr202)一抗(AF07183473)均购于北京Bioss生物技术有限公司;FITC山羊抗兔二抗(GB25303),CY3标记山羊抗兔二抗(GB21303),DAPI染色试剂盒(G1012-100)均购于武汉Servicebio生物科技有限公司;酚酞(F318BA0010)购于上海生工生物工程股份有限公司。
1.3 药物阿司匹林(BJ38595)(aspirin, ASP)购于拜耳医药保健有限公司;番泻叶购自长沙含浦老百姓大药房;埃索美拉唑肠溶胶囊(esomeprazole,ESO)(G170815)购于重庆莱美药业股份有限公司;理中汤(Li-Zhong-Tang,LZT)组方药物:白术9 g,党参9 g,干姜9 g,甘草9 g购于湖南中医药大学第一附属医院中药房。理中汤药液制备方法如下:将所有组方药材混合置于1 L烧杯,以288 mL蒸馏水充分浸泡30 min后,于100 ℃水浴锅提取40 min,过滤并收集药液。以相同体积蒸馏水对药物残渣重复提取一次,收集滤液后将两次药液合并,减压浓缩至每毫升LZT药液含生药1 g,于4 ℃冰箱保存备用。依据人和动物体表面积折算系数计算,理中汤低剂量组和高剂量组的给药剂量分别为1.88 g·kg-1和3.75 g·kg-1。
1.4 仪器高速组织匀浆机(德国IKA仪器设备公司,T10);高速冷冻离心机(德国Eppendorf,5810R);落地式全自动冷冻切片机(德国SLEE公司,MNT);包埋机(武汉俊杰电子有限公司,JB-P5);脱水机(武汉俊杰电子有限公司,JJ-12J);组织摊片机(金华科迪仪器设备有限公司,KD-P);正置光学显微镜(厦门麦克奥迪医疗诊断系统有限公司,Pro 205A);双光束紫外可见分光光度计(上海光谱仪器有限公司,SP-1900);多功能酶标仪(美国博腾仪器有限公司,CytationTM3);倒置荧光显微镜(日本Nikon仪器公司,TE2000-E)。
1.5 脾胃虚寒型胃溃疡大鼠模型构建及实验分组采用中医学“苦寒泻下+劳倦过度”法与阿司匹林、无水乙醇联合建立胃溃疡(脾胃虚寒证)动物模型[5]。造模及给药过程如下:灌胃给予每只大鼠2 mL,1 mg·L-1番泻叶水煎液,随后将大鼠放入装满自来水的水桶中(水温维持在10 ℃左右)游泳使其力竭,鼻唇部没于水面后立即捞起,连续造模7 d以构建脾胃虚寒模型。d 8起,连续4 d,运用1 mL 40 g·L-1ASP + 2 mL无水乙醇灌胃以构建GU模型,并在GU造模后4 h给予相应药物治疗。将60只SD大鼠随机分为正常组、模型组、ESO组、理中汤低剂量组、理中汤高剂量组。正常组实验全程不做任何造模处理;模型组在脾胃虚寒型GU造模后给予蒸馏水灌胃;药物治疗组在脾胃虚寒型GU造模后分别给予4.17 mg·kg-1ESO、1.88 g·kg-1LZT和3.75 g·kg-1LZT灌胃治疗,连续给药4 d。
1.6 标本采集末次给药后对大鼠禁食、禁水12 h,采用脱颈椎法将大鼠处死,沿腹正中线将腹壁剖开,在幽门部位剪断以分离胃和小肠并收集胃液,随后在贲门部位剪断将胃脏分离。沿胃大弯将胃剪开,清除胃内容物,生理盐水漂洗后观察胃黏膜溃疡情况并拍照;剪取部分胃组织置于4%多聚甲醛溶液固定,用于病理形态学检测和免疫荧光染色实验;剩余胃组织置于-80 ℃低温冰箱保存。
1.7 胃黏膜溃疡指数(ulcer index,UI)和治疗指数(therapeutic index,TI)测定参照文献方法采用0-4分评分体系对胃黏膜损伤情况进行评分[6]。正常黏膜计0分;溃疡(出血)长度≤1 mm计1分;溃疡(出血)长度1-2 mm计2分;溃疡(出血)长度2-3 mm计3分;溃疡(出血)长度3-4 mm计4分;溃疡(出血)长度>4 mm则分段计分并求和。当溃疡宽度>2 mm时,每段计分乘以2。胃黏膜UI等于各组大鼠溃疡病灶积分的平均值;TI/%=(模型组UI-治疗组UI)/模型组UI×100%。
1.8 胃液酸度测定将采集的胃液置于离心机,以4 000 r·min-1离心10 min,收集上清液。吸取1 mL胃液上清液于离心管,加入一滴2%酚酞指示剂,以0.01 mmol·L-1氢氧化钠溶液滴定,至胃液颜色变为微红色且颜色保持不变为止。胃液总酸度(mEq·L-1)=消耗的氢氧化钠溶液体积×浓度[7]。
1.9 胃蛋白酶活性测定根据试剂盒说明书,首先制备粗酶液。将0.1 mL胃液与0.9 mL提取液混合,震荡混匀即得粗酶液。设置空白管、标准管、测定管、对照管开展显色反应,空白管在加试剂三、试剂四的基础上加入0.3 mL标准品稀释液,标准管在加试剂三、试剂四的基础上入0.3 mL标准应用液,测定管和对照管在加试剂三、试剂四的基础上各加入0.3 mL粗酶液。充分混匀后置于37 ℃水浴锅中孵育15 min,将混悬液吸入石英比色皿中,采用紫外可见分光光度计于660 nm下检测吸光度。胃蛋白酶活性kU·L-1=[(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)]×800。
1.10 胃黏膜组织病理形态学检测对固定的胃组织进行修剪、脱水、透明处理后运用石蜡包埋。将包埋胃组织的蜡块切成5 μm厚度切片,于热水中烫平,装于载玻片后烘干。采用二甲苯、无水乙醇、75%酒精、自来水依次对切片进行处理。随后采用苏木素对切片进行染色,梯度酒精脱水后运用伊红染液对切片进行染色。进一步采用无水乙醇脱水,二甲苯透明,运用中性树胶封片,光学显微镜放大200倍观察胃黏膜组织病理形态学改变,每组采集6个视野的图片。
1.11 胃黏膜PGE2、TNF-α及SOD含量测定采用4 ℃生理盐水清洗胃黏膜组织以去除滞留的黏液和血液,采用电子天平对滤纸吸干后的黏膜组织称重。以含有蛋白酶抑制剂的PBS溶液按质量-体积比1比9浸泡胃组织,组织匀浆机匀碎后置于高速冷冻离心机,4 000 r·min-1离心5 min,吸取上清液,-20 ℃保存备用。按照试剂盒说明书设置标准品孔与样品孔,绘制标准曲线图,通过各样品孔OD值和标准曲线方程分别计算胃黏膜PGE2[6]和TNF-α含量[8]。按照试剂盒操作指南设置测定管、对照管、空白管1和空白管2,将各试剂漩涡混匀,于37 ℃水浴锅孵育30 min后采用1 mL玻璃比色皿于560 nm处测定吸光度,SOD活性=11.4×抑制百分率÷(1-抑制百分率)÷样本质量[9]。
1.12 免疫荧光法检测胃黏膜磷酸化Raf、MEK、ERK蛋白表达胃组织切片脱蜡至水后采用EDTA抗原修复液对切片进行抗原修复,5%牛血清白蛋白室温封闭30 min,TBST漂洗后分别滴加磷酸化Raf兔多克隆抗体(1 ∶500)、磷酸化MEK1/2兔多克隆抗体(1 ∶500)和磷酸化ERK1兔多克隆抗体(1 ∶500)一抗,4 ℃孵育24 h。TBST漂洗后加入FITC(1 ∶400)或CY3(1 ∶300)山羊抗兔荧光标记二抗。随后运用DAPI试剂室温避光孵育10 min, TBST漂洗,甩干,以抗荧光淬灭剂封片。阴性对照组采用一抗稀释液代替一抗。通过荧光显微镜观察胃黏膜p-Raf、p-MEK1/2、p-ERK1蛋白表达并采集图像。FITC(绿色荧光)激发波长470 nm,发射波长545 nm;CY3(红色荧光)激发波长520 nm,发射波长590 nm;DAPI(蓝色荧光)激发波长340 nm,发射波长420 nm。胃黏膜红色或绿色荧光显示部位即p-Raf、p-MEK1/2、p-ERK1蛋白阳性表达部位。于200倍镜下对每张切片随机选取2个视野进行拍摄,统计每张图片中蛋白表达部位的荧光强度并求平均值[10]。
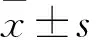
2 结果
2.1 理中汤对大鼠胃黏膜UI及TI的影响Fig 1结果显示,模型大鼠胃黏膜可见许多明显的溃疡性出血点。给予理中汤或埃索美拉唑(ESO,阳性对照药)治疗后,胃黏膜溃疡明显减少,肉眼几乎不能看到明显的溃疡性出血点。Tab 1结果显示,模型组(Model)大鼠胃黏膜溃疡指数明显高于正常对照组(Control)(P<0.01)。经低剂量和高剂量的理中汤治疗后,大鼠胃黏膜溃疡指数明显下降,与模型组比较均P<0.01。进一步研究发现,理中汤低剂量组和高剂量组的治疗指数分别达82.16%和93.94%。以上结果提示,理中汤具有较好的治疗大鼠胃溃疡(脾胃虚寒证)的效果。
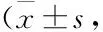
Tab 1 Effects of LZT on UI and TI of GU rats n=12)
2.2 HE染色检测理中汤对GU大鼠胃黏膜组织病理形态改变的影响Fig 2结果显示,正常大鼠胃黏膜层结构完好,胃黏膜上皮细胞整齐地以单层柱状排列,未见上皮细胞丢失、脱落,无黏膜缺损,未见黏膜水肿,无炎性细胞浸润,未见毛细血管充血扩张等。模型组大鼠胃黏膜出现明显损伤,可见大量的胃黏膜上皮细胞丢失、脱落,黏膜出现明显缺损,缺损处可见大量出血和炎性细胞,提示溃疡病灶的存在。给予埃索美拉唑、理中汤治疗后,大鼠胃黏膜形态得到明显改善。尽管埃索美拉唑组胃黏膜上皮细胞可见少量丢失,胃黏膜上皮可见水肿和少量炎性细胞,但总体而言,胃黏膜形态结构完整,无溃疡病灶存在。理中汤低剂量组和高剂量组胃黏膜亦可见少量上皮细胞脱落、出血、炎性细胞浸润,但总体而言,胃黏膜形态均较完整,胃黏膜细胞排列规整,未见明显的溃疡病灶,提示理中汤具有较好的治疗大鼠脾胃虚寒型GU的效应。

Fig 1 Visual observation of effect of LZT on changes of gastric mucosa in GU rats

Fig 2 Effect of LZT on pathological changes of gastric mucosa in GU rats (× 200)
2.3 理中汤对GU大鼠胃液pH、总酸度及胃蛋白酶活性的影响Tab 2结果显示,模型大鼠胃液呈强酸性,胃液pH值明显低于正常大鼠(P<0.01);给予低剂量和高剂量理中汤治疗后,两个组胃液pH值均明显升高,与模型组比较,差异具有统计学意义,提示理中汤可使GU大鼠胃液酸性减弱。胃液酸度检测结果显示,模型大鼠胃液酸度明显高于正常大鼠(P<0.01),表明模型大鼠胃黏膜释放的H+含量明显增加;给予低剂量和高剂量理中汤治疗后,大鼠胃液总酸度明显降低,与模型组比较,差异具有统计学意义,提示理中汤可使胃黏膜H+释放减少,从而保护胃黏膜使其不受侵蚀。胃蛋白酶检测结果显示,与正常组相比,模型大鼠胃液中胃蛋白酶活性明显增加(P<0.01);给予低剂量和高剂量理中汤治疗后,大鼠胃液中胃蛋白酶活性明显降低,与模型组比较均差异具有统计学意义,提示理中汤可通过降低胃液中胃蛋白酶活性而保护胃黏膜。
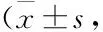
Tab 2 Effect of LZT on pH, total acidity, and pepsin activity of gastric juice in GU rats n=6)
2.4 理中汤对GU大鼠胃黏膜PGE2、SOD及TNF-α含量的影响PGE2、SOD及TNF-α均是与溃疡发生发展密切相关的炎性介质。Tab 3结果显示,与正常组比较,模型组大鼠胃黏膜PGE2和SOD含量明显降低(均P<0.01);给予理中汤治疗后,模型组大鼠胃黏膜PGE2和SOD含量明显增加。与模型组比较,理中汤低剂量组PGE2和SOD含量分别增加33.81%和30.30%(均P<0.01),理中汤高剂量组PGE2和SOD含量分别增加49.82%和34.42%(均P<0.01)。
Tab 3结果还显示,与正常组比较,模型组大鼠胃黏膜TNF-α含量明显增加(P<0.01);给予理中汤治疗后,大鼠胃黏膜TNF-α含量明显降低,低剂量和高剂量理中汤可使大鼠胃黏膜TNF-α含量分别下降28.63%和43.71%,与模型组比较均差异具有统计学意义。以上结果提示,理中汤治疗大鼠脾胃虚寒型胃溃疡可能与调节胃黏膜PGE2、SOD及TNF-α含量密切相关。
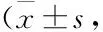
Tab 3 Effect of LZT on contents of PGE2, SOD, and TNF-α in gastric mucosa of GU rats n=6)
2.5 理中汤对GU大鼠胃黏膜磷酸化Raf蛋白表达的影响Fig 3为各组大鼠胃黏膜免疫荧光染色结果,其中蓝色荧光表示DAPI染色,绿色荧光表示磷酸化Raf蛋白表达。Tab 4结果显示,脾胃虚寒型GU大鼠胃黏膜p-Raf蛋白表达明显增加,与正常组比较,差异有统计学意义。给予低剂量和高剂量理中汤治疗后,大鼠胃黏膜p-Raf蛋白表达明显降低,几乎接近正常水平,与模型组比较,差异有统计学意义。

Fig 3 Immunofluorescence detection of effect of LZT on expression of phosphorylated Raf protein in gastric mucosa of GU rats (× 200)
2.6 理中汤对GU大鼠胃黏膜磷酸化MEK1/2蛋白表达的影响Fig 4为各组大鼠胃黏膜免疫荧光染色图片,其中蓝色荧光表示DAPI染色,绿色荧光表示磷酸化MEK1/2蛋白表达。Tab 4结果显示,与正常组比较,脾胃虚寒型GU大鼠胃黏膜p-MEK1/2蛋白表达明显上调(P<0.01)。给予理中汤治疗后,大鼠胃黏膜p-MEK1/2蛋白表达明显下调,低剂量和高剂量理中汤组p-MEK1/2蛋白表达分别下降316.20%和358.44%,与模型组相比,差异具有统计学意义。
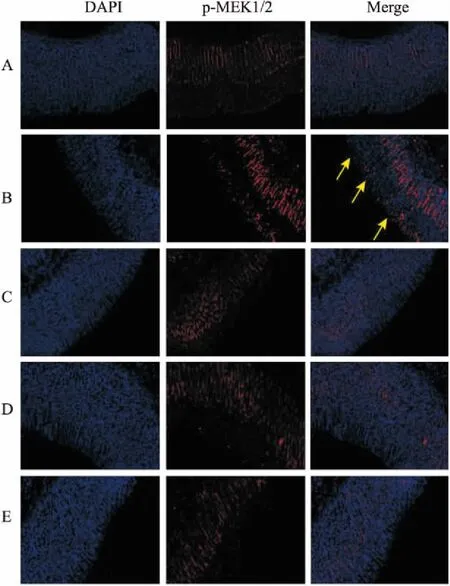
Fig 4 Immunofluorescence detection of effect of LZT on expression of phosphorylated MEK1/2 protein in gastric mucosa of GU rats (× 200)
2.7 理中汤对GU大鼠胃黏膜磷酸化ERK1蛋白表达的影响Fig 5为各组大鼠胃黏膜免疫荧光染色图片,其中蓝色荧光表示DAPI染色,绿色荧光表示磷酸化Raf蛋白表达。Tab 4结果表明,与正常组相比,脾胃虚寒型GU大鼠胃黏膜p-ERK1蛋白表达明显增加(P<0.01)。给予理中汤治疗后,大鼠胃黏膜p-ERK1蛋白表达明显下调,低剂量和高剂量理中汤组p-ERK1蛋白表达分别下降494.56%和586.84%,与模型组相比,差异具有统计学意义。
3 讨论
GU是消化系统的常见病和多发病,尽管现代医学对GU发病机制和治疗策略的认识均取得了明显进展,但依然存在药物不良反应、患者依从性差、治愈后易复发等问题[11]。中医药治疗GU具有一定的特色和优势,中医学温中益气健脾法是治疗脾胃虚寒型GU、抑制溃疡复发的常用治法。理中汤是温中益气健脾治法的基础方和代表方。本文通过苦寒泻下法+劳倦过度法+阿司匹林+无水乙醇联合构建脾胃虚寒型大鼠GU模型,并在此基础上考察理中汤对GU的治疗效应及其可能作用的分子机制。

Fig 5 Immunofluorescence detection of effect of LZT on expression of phosphorylated ERK1 protein in gastric mucosa of GU rats (× 200)
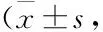
Tab 4 Effect of LZT on p-Raf, p-MEK1/2, and p-ERK1 protein expression in gastric mucosa of GU rats n=6)
研究结果表明,模型组大鼠胃黏膜暗淡无光泽,且出现明显的溃疡损伤。给予理中汤治疗后,模型大鼠胃黏膜溃疡损伤得到明显改善,溃疡指数明显降低,理中汤低剂量和高剂量组的治疗指数分别达到82.16%和93.94%。大鼠胃组织HE染色实验进一步验证了上述肉眼观察的黏膜形态结果改变。HE染色结果显示,正常大鼠胃黏膜完好无损,模型组大鼠胃黏膜可见明显的溃疡病灶,另可见黏膜上皮细胞脱落及黏膜出血和炎性细胞浸润,给予低剂量和高剂量的理中汤治疗后,黏膜形态得到有效改善,溃疡病灶基本消除,理中汤高剂量组大鼠胃黏膜形态与正常大鼠胃黏膜形态接近,提示理中汤具有良好的治疗脾胃虚寒型GU的效果。这些结果与本课题组前期的研究结果相吻合,本团队前期研究发现,温中益气健脾治法常用方黄芪建中汤可有效治疗大鼠脾胃虚寒型胃溃疡和十二指肠溃疡,其效应的分子机制与调节TLR-2/MyD88信号通路、抑制炎症介质释放有关[12]。本团队前期研究还表明,理中汤可有效治疗大鼠脾胃虚寒型十二指肠溃疡,其作用机制与调控TLR-2/MyD88信号通路,增强肠黏膜免疫屏障功能有关[9]。这些研究结果均提示,温中益气健脾治法方药对脾胃虚寒型胃肠道溃疡具有较好的治疗效果。
SOD是人体抗氧化系统的关键成分,它可清除氧自由基,从而抑制自由基对人体的损害。当胃组织遭受溃疡损伤时,血液及胃黏膜中氧自由基含量明显增加,致使机体SOD被大量耗竭。SOD含量的降低可反向促进氧自由基在胃黏膜中进一步聚集,从而加重胃黏膜损伤,诱发溃疡形成[13]。胃组织中花生四烯酸和亚油酸在环氧酶催化下可合成PGE2,PGE2对胃黏膜上皮黏液及碳酸氢盐的分泌、胃黏膜血液循环的调节、胃黏膜完整性的维持、胃酸的分泌都具有重要作用,PGE2可保护胃黏膜避免受溃疡损伤[14]。TNF-α是一类具有细胞毒作用的促炎细胞因子,它的释放可诱发炎症、细胞坏死等,从而导致胃黏膜细胞损伤,胃组织产生溃疡。TNF-α还可通过诱导单核细胞或巨噬细胞促进IL-8等炎症因子的释放,参与免疫炎症反应的调控[15]。本文研究结果显示,脾胃虚寒型GU模型大鼠胃黏膜PGE2和SOD含量明显低于正常组,而TNF-α含量明显高于正常组;理中汤在明显增加模型大鼠胃黏膜PGE2和SOD含量的同时,还可明显降低TNF-α含量。提示理中汤抗大鼠脾胃虚寒型胃溃疡可能与提升胃黏膜PGE2和SOD含量、降低炎性因子TNF-α含量有关。本文研究结果亦与胃溃疡发病机制的“天平学说”理论相吻合,该理论认为,胃黏膜完整性受黏膜攻击因子和保护因子共同主宰,当黏膜攻击因子增强或保护因子减弱时,胃黏膜便发生损伤。PGE2和SOD是常见的胃黏膜保护因子,胃酸、胃蛋白酶、TNF-α是常见的胃黏膜攻击因子。本研究结果从另一方面提示理中汤治疗大鼠脾胃虚寒型胃溃疡可能与增强黏膜保护因子含量、降低黏膜攻击因子含量有关[16]。
丝裂原活化蛋白激酶(MAPK)是广泛存在于真核生物的一类丝氨酸/苏氨酸蛋白激酶,胞外信号调控激酶(ERK)是最经典的MAPK之一,Raf/MEK/ERK通路是最主要的ERK信号途径之一。Raf属于MAP3K家族成员,其分子量为40-75 ku;MEK属于MAP2K家族成员,分子量为45 ku;ERK分子量为42 ku。MEK通过磷酸化酪氨酸/苏氨酸残基而进一步活化ERK。Raf/MEK/ERK信号通路可调节胃肠黏膜上皮细胞迁移、增殖(凋亡)、分化等多种生物学反应,Raf/MEK/ERK信号通路异常活化可诱导多种疾病如消化性溃疡、溃疡性结肠炎、克罗恩病、消化道肿瘤等[17- 18]。本文研究结果显示,脾胃虚寒型GU模型大鼠胃黏膜p-Raf、p-MEK、p-ERK蛋白表达均明显上调,提示GU病变过程存在Raf/MEK/ERK信号通路的激活;给予高剂量和低剂量的理中汤治疗后,模型大鼠胃黏膜p-Raf、p-MEK、p-ERK蛋白表达均明显下调,提示理中汤可能直接作用于Raf/MEK/ERK信号通路,发挥治疗脾胃虚寒型大鼠胃溃疡的效应。
综上所述,理中汤具有良好的治疗大鼠脾胃虚寒型GU的作用,其机制可能与干预Raf/MEK/ERK信号通路,调控胃黏膜炎性介质释放和抗氧化作用有关。本文研究结果可为临床采用温中益气健脾治法方药治疗脾胃虚寒型胃肠道疾病提供科学依据。

