鼠源胰岛素降解酶的原核表达及活性检测
彭彦皓,肖 树,陈 丽,姚昱祺,张云龙,陆昌瑞,陈 婷
(东华大学化学化工与生物工程学院,中国上海 201620)
胰岛素降解酶(insulin degrading enzyme,IDE)是一种高度保守并且广泛表达的锌离子金属蛋白酶,因可以快速降解胰岛素而被发现[1]。IDE在人、鼠、果蝇、细菌等多种生物体内都有表达,并具有较高的同源性[2]。不仅如此,IDE在机体中的分布也十分广泛,包括肝、胰腺、肾、脾、肺、心、肌肉、脑、睾丸、卵巢、脂肪等组织[3]。其中,肝内IDE的活性最高,肾、大脑和肌肉组织中的IDE活性次之。在亚细胞层面,尽管IDE一直被认为是细胞溶质蛋白[4],但后续研究表明它在几乎所有亚细胞区室中都有表达[5]。另外,IDE虽然被称为胰岛素降解酶,但其还拥有降解胰高血糖素、胰岛淀粉素、β 淀粉样蛋白(amyloid β-protein,Aβ)、α-突触核蛋白、HIV-1 p6蛋白以及胰岛素样生长因子Ⅱ(insulin-like growth factor-Ⅱ,IGF-Ⅱ)和转化生长因子-α (transforming growth factor-α,TGF-α)等众多底物的能力[6~7]。这表明IDE在机体内参与了多种生物功能的调节,具有极为重要的生理意义。
经全基因组关联分析(genome-wide association study,GWAS)及生物信息学分析,IDE被证明与2型糖尿病(type 2 diabetes mellitus,T2DM)和阿尔茨海默病(Alzheimer’s disease,AD)有关[8~11],虽然其中的作用机理尚不清晰,但这预示了一个可以治疗AD与T2DM的全新潜在途径。这足以激起学者们对IDE在生物体内的作用及其机理研究的兴趣,目前众多针对IDE结构的研究集中于其对底物的降解机理[12~17]和二聚化、多聚化等变构现象[18~22],并期望于通过了解IDE的结构及机理,发现影响IDE活性的途径,从而达到治疗或预防AD与T2DM的目的。
随着针对IDE研究的深入,学者们逐渐集中于研究如何调节IDE降解其两个主要底物Aβ和胰岛素的活性来治疗或改善AD和T2DM[23~25],与此同时,众多通过抑制剂或激活剂来改变IDE活性的研究被报道[26~35],并成功证明通过抑制IDE对胰岛素的降解可改善小鼠的糖耐受性,这为日后针对IDE降解活性的特异性调节剂的开发研究奠定了基础。
本研究成功构建了野生型鼠源胰岛素降解酶(mouse insulin degrading enzyme,mIDE)的体外表达系统,并对mIDE体外表达及纯化条件进行了摸索。实验选用了具有增加外源蛋白质可溶性表达特点的ppSUMO载体,减少了mIDE不溶包涵体的出现;同时,利用His-SUMO标签可以被特异性切除的优势,使纯化得到的mIDE不残留任何人工插入的氨基酸序列。所表达的mIDE经已发表的相关实验中用于酶活性测定的特异性荧光底物 Mca-RPPGFSAFK(Dnp)[32~33]检测,具有 mIDE正常酶活性;经已报道的IDE抑制剂杨梅素(myricetin)[26]检测,其对抑制剂的响应与该报道中所示基本一致。该方法的建立为后续mIDE的靶向分子研究及机制研究提供了实验基础。
1 材料与方法
1.1 材料
ppSUMO质粒、大肠杆菌DH5α、大肠杆菌BL21(DE3)、mIDE基因均为实验室自有;质粒抽提试剂盒、DNA胶回收试剂盒、PCR产物纯化试剂盒、镍柱、硝酸纤维素膜、Pfu DNA聚合酶、DNA分子量标准、TureColor三色预染蛋白质分子量标准、T4 DNA连接酶、PCR引物、DNA测序服务等均购于上海生工生物工程股份有限公司;限制性内切酶BamHⅠ、XhoⅠ购于New England Biolabs公司(美国);6*His标签单克隆抗体购于Proteintech 公司(美国);PageRulerTMUnstained Broad Range Protein Ladder购于ThermoFisher公司(美国);Hitrap Q FF 5 mL离子交换柱、HiLoad 16/60 Superdex 200 pg凝胶层析柱购于GE Healthcare公司(美国);Mca-RPPGFSAFK(Dnp)荧光底物购于Sigma公司(美国);杨梅素购于Aladin公司(美国)。
1.2 溶液的配制
mIDE蛋白缓冲液:称取3.05 g Tris base和29.5 g NaCl于超纯水中,加入50 mL丙三醇,调节pH至8.0,而后定容至1 L,过滤除菌后4℃贮存备用。
mIDE酶活反应缓冲液:称取3.05 g Tris base和29.5 g NaCl于超纯水中,加入50 mL丙三醇,调节pH至7.3,而后定容至1 L,过滤除菌后放于4℃备用。
荧光底物溶液:将1 mg Mca-RPPGFSAFK(Dnp)加入0.16 mL的DMSO,溶解后置于-20℃避光保存。
1.3 ppSUMO-mIDE全长基因片段重组质粒的克隆构建
以mIDE的cDNA全长序列为模板、mIDE-F和mIDE-R为前后引物(表1),利用Pfu DNA聚合酶在特定PCR反应条件(表2)下进行扩增。对所得PCR产物及抽提所得的ppSUMO质粒进行纯化,而后使用BamHⅠ和XhoⅠ限制性内切酶进行双酶切,再利用T4 DNA连接酶连接酶切产物,完成质粒构建。获得的重组质粒经测序鉴定后,用于蛋白质诱导表达。

表1 引物序列Table 1 Primer sequences

表2 PCR反应条件Table 2 PCR reaction conditions
1.4 mIDE的表达与纯化
融合蛋白His-SUMO-mIDE的表达:将测序正确的ppSUMO-mIDE全长基因片段重组质粒转化入大肠杆菌BL21(DE3)中,37℃培养过夜。挑取单克隆接种于含5 mL LB培养液的摇菌管中,加入5 μL卡那霉素(50 mg/mL),放于37℃、225 r/min摇床中过夜培养。次日,将摇床培养的菌液按1︰1 000的比例接种于含有终质量浓度为50 μg/mL的卡那霉素的LB培养液(1 L)摇瓶中,放入37℃、225 r/min的摇床中培养,直至OD600达到0.5~0.8后取出。向其中加入异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside,IPTG;终浓度为0.5 mmol/L),而后在16℃、225 r/min的摇床中过夜诱导表达。次日,在4℃条件下4 000 r/min离心30 min,收集菌体,用mIDE蛋白缓冲液按1 g/10 mL的比例重悬菌体,并按照1︰100的体积比加入100 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF),而后通过高压细胞破碎仪将细胞在1 300 bar、4℃条件下破碎。将破碎后的悬浊液置于高速低温离心机中,于4℃条件下14 000 r/min离心1 h,获得含有融合蛋白的上清液。
镍柱亲和纯化:向预先用mIDE蛋白缓冲液平衡过的镍柱中加入含有融合蛋白的上清液样品,收集穿出液并重复上柱1~2次;依次用至少5~10倍柱床体积的含20 mmol/L、30 mmol/L咪唑的蛋白缓冲液对杂蛋白进行漂洗;而后依次用至少5~10倍柱床体积的含250 mmol/L、500 mmol/L咪唑的蛋白缓冲液对融合蛋白进行洗脱。将含有目标融合蛋白的样品进行浓缩,采用30 kD的超滤管进行缓冲液的置换,去除咪唑并浓缩至5 mL左右。加入1 μL的ULP1酶,4℃过夜切除标签。次日,将酶切后的样品加入预先用不含咪唑的蛋白缓冲液平衡后的镍柱中,进行二次过柱,以便吸附ULP1酶及其切割下来的His-SUMO标签,收集穿出液,再次利用30 kD的超滤管对无标签的mIDE蛋白进行浓缩(浓缩至250 μL),随后用液氮冻存于-80℃,以备后续实验。利用SDS-PAGE和Western-blot检测并鉴定诱导表达及亲和纯化过程中的蛋白质样品。
离子交换层析纯化:采用AKTA FPLC系统,选取Hitrap Q FF 5 mL离子交换柱,以连续洗脱方式进一步纯化无标签的mIDE蛋白。A泵为不含NaCl的蛋白缓冲液,B泵为含1 mol/L NaCl的蛋白缓冲液。洗脱程序为B泵混合浓度从0%~80%线性增长,流速为0.5 mL/min,按每管1 mL进行样品收集。采用SDS-PAGE检测洗脱样品,并对含有mIDE蛋白的样品进行低温超滤管(30 kD)浓缩,浓缩样品用液氮冻存于-80℃冰箱中以备后用。
凝胶过滤层析纯化:采用AKTA FPLC系统,选取HiLoad 16/60 Superdex 200 pg柱,程序设定为0.5 mL/min,用蛋白缓冲液进行洗脱。收集的蛋白质样品用SDS-PAGE进行检测。对含有mIDE蛋白的样品进行低温超滤管(30 kD)浓缩,并用液氮冻存于-80℃冰箱中以备后用。采用Image Lab软件检测蛋白质纯度,利用Bradford法测定蛋白质浓度。
1.5 目的蛋白检测
按1︰4的体积比将收集的蛋白质样品与上样缓冲液混合,而后95℃加热3 min。用12%的SDS-PAGE及Western-blot检测目的蛋白的表达及纯化效果,利用Image Lab软件测定蛋白质纯度,采用Bradford法测定蛋白质浓度。SDS-PAGE的条件为190 V、45 min,采用考马斯亮蓝R-250染色;Western-blot的条件为80 mA、90 min,转膜后用脱脂奶粉在4℃条件下封闭1 h,而后用6*His标签单克隆抗体孵育1 h,经PBST冲去多余抗体后,ECL发光检测。
1.6 mIDE的活性测定
Mca-RPPGFSAFK(Dnp)是IDE的一种荧光底物,在被IDE酶解后可经320 nm光激发,发射出405 nm荧光,利用酶标仪测量荧光强度,即可反映IDE的酶活性。酶活反应体系:mIDE 1 μL(4nmol/L)、Mca-RPPGFSAFK(Dnp)1μL(5 μmol/L)、酶活反应缓冲液补至100 μL。将配好的酶活反应体系对应加入Corning 96孔板,振荡摇匀后迅速放入Molecular Devices公司所产的FlexStationⅡ多功能酶标仪,在37℃条件下读取酶活反应体系荧光信号1 h左右,读取速度为fast,sensitivity为1。观察结果并记录数据。
1.7 质粒抽提、PCR产物纯化以及DNA胶回收与样品检测
质粒抽提、PCR产物纯化与DNA胶回收均参照上海生工生物工程股份有限公司所提供试剂盒的操作步骤进行。
将纯化所得样品按1︰4的体积比与试剂盒中所提供上样缓冲液相混合,而后通过琼脂糖凝胶电泳法检测抽提质粒或PCR产物,电泳条件为140 V、20 min,在成像仪中观察结果。
2 结果
2.1 ppSUMO-mIDE全长基因片段重组质粒的克隆构建
以已知的mIDE蛋白的cDNA全长序列为模板,利用合成的mIDE-F和mIDE-R为引物,成功扩增出大小为3 060 bp的mIDE全长基因片段(图中简写为mide)(图1A),其条带较为明显,进行DNA胶回收后即可进行质粒构建。图1B为抽提的ppSUMO质粒,条带清晰且单一,可直接用于质粒构建。图1 C是目的基因片段与ppSUMO质粒重组后的检测结果,可以看出ppSUMO-mIDE全长基因片段重组质粒条带清晰,经测序检测,序列完全正确,可进行后续表达实验。
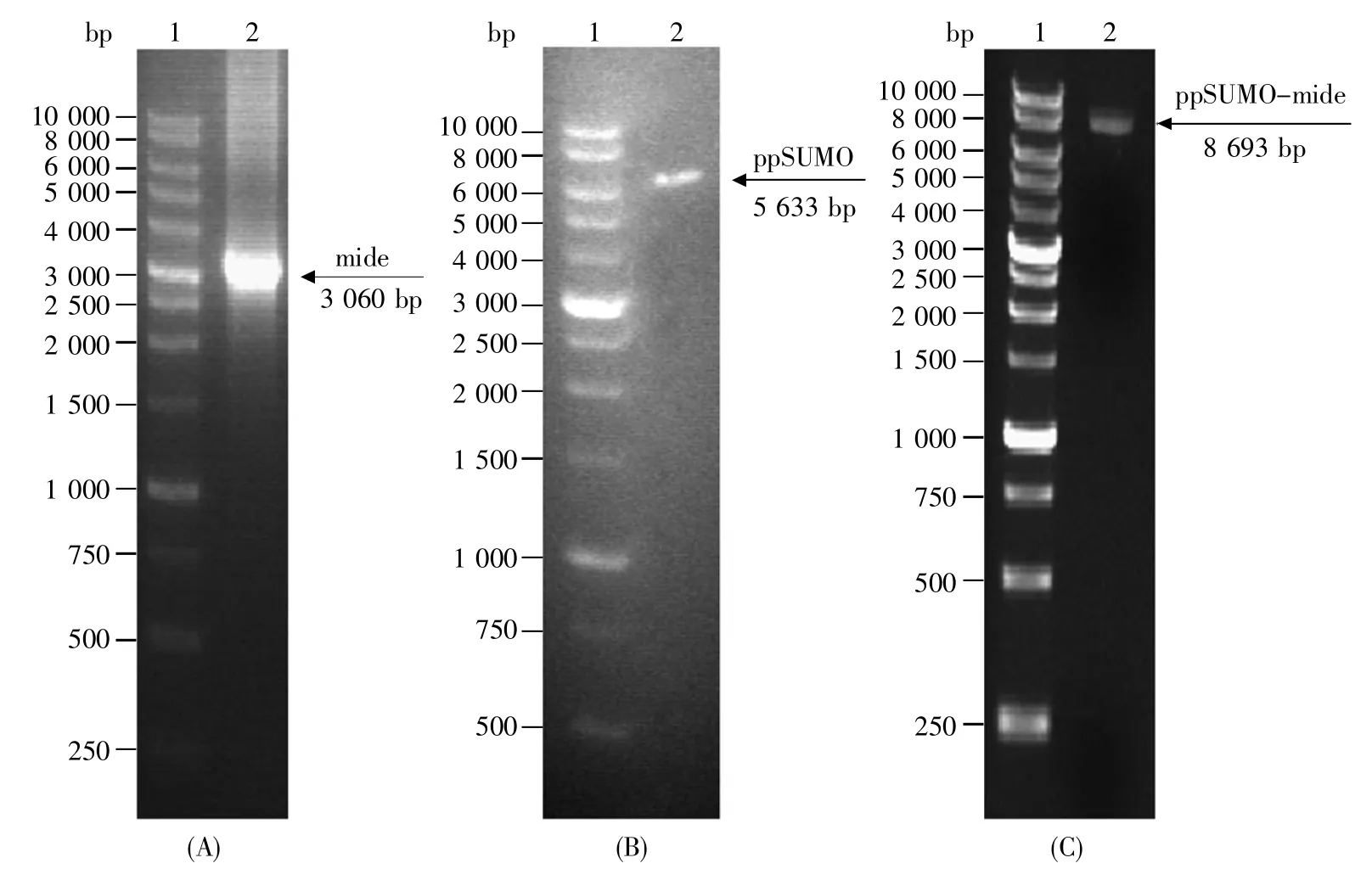
图1 mIDE全长基因片段的获取与重组质粒构建(A)mIDE蛋白全长基因片段的PCR扩增。1:DNA分子量标准,2:mIDE全长基因片段(mide);(B)ppSUMO质粒抽提检测。1:DNA分子量标准,2:ppSUMO质粒;(C)ppSUMO-mIDE全长基因片段重组质粒抽提检测。1:DNA分子量标准,2:pp-SUMO-mIDE全长基因片段重组质粒。Fig.1 Acquisition of the mIDE full-length gene and plasmid construction(A)PCR amplification of mIDE target fragment.1:DNA marker,2:mIDE full-length gene fragment;(B)ppSUMO plasmid extraction and detection.1:DNA marker,2:ppSUMO plasmid;(C)ppSUMO-mIDE plasmid extraction and detection.1:DNA marker,2:ppSUMO-mIDE plasmid.
2.2 mIDE的表达与纯化
在 16℃、225 r/min、0.5 mmol/L IPTG 的条件下,过夜诱导表达融合蛋白His-SUMO-mIDE。从图2A的结果可知,在该诱导表达条件下,融合蛋白表达较好,且多为可溶性表达。进一步对诱导表达产物进行Western-blot检测,结果显示,融合蛋白产生了多条降解条带(大小约为20 kD、50 kD和70 kD),推测目的蛋白容易在结构域N和C之间发生断裂,或发生His-SUMO标签的脱落(图2B)。
利用His-SUMO标签进行融合蛋白的镍柱亲和纯化。先将含有融合蛋白的上清液样品重复上柱1~2次,随后依次使用含20 mmol/L、30 mmol/L咪唑的蛋白缓冲液对杂蛋白进行漂洗,最后依次用含250 mmol/L、500 mmol/L咪唑的蛋白缓冲液对融合蛋白进行洗脱。尽管破菌上清液样品中的融合蛋白含量不高,但镍柱纯化仍得到了较多目标融合蛋白(图3)。结合图2B结果可知,大部分的杂蛋白在20 mmol/L咪唑洗涤的条件下被除去,在250 mmol/L咪唑条件下,目标融合蛋白被洗脱下来。浓缩后,融合蛋白量可以接近50%。

图2 融合蛋白的诱导表达(A)融合蛋白初步诱导表达的12%SDS-PAGE检测。1:蛋白质分子量标准,2:诱导表达前的样品,3:诱导表达后的样品;(B)融合蛋白初步诱导表达的Western-blot检测。1:蛋白质分子量标准,2:诱导表达前的样品,3:诱导表达后的样品。Fig.2 The results of induced expression of mIDE fusion protein(A)12%SDS-PAGE detection of preliminary induced expression of mIDE fusion protein.1:Protein marker,2:Sample before induction,3:Sample after induction;(B)Western-blot detection of preliminary induced expression of mIDE fusion protein.1:Protein marker,2:Sample before induction,3:Sample after induction.

图3 融合蛋白的镍柱亲和纯化(A)镍柱亲和纯化的12%SDS-PAGE检测。1:蛋白质分子量标准,2:诱导前的样品,3:诱导后的样品,4:破菌离心后的上清液样品,5:破菌离心后的沉淀样品,6:上柱后穿出样品,7:20 mmol/L咪唑洗涤样品,8:30 mmol/L咪唑洗涤样品,9:250 mmol/L咪唑洗脱样品,10:500 mmol/L咪唑洗脱样品,11:浓缩样品;(B)镍柱亲和纯化的Western-blot检测。1:蛋白质分子量标准,2:诱导前的样品,3:诱导后的样品,4:破菌离心后的上清液样品,5:破菌离心后的沉淀样品,6:上柱后穿出样品,7:20 mmol/L咪唑洗涤样品,8:30 mmol/L咪唑洗涤样品,9:250 mmol/L咪唑洗脱样品。Fig.3 The results of affinity purification of the fusion protein on nickel column(A)12%SDS-PAGE detection after nickel column affinity purification.1:Protein marker,2:Sample before induction,3:Sample after induction,4:Supernatant after bacteriostasis and centrifugation,5:Precipitation after bacteriostasis and centrifugation,6:Sample passing through the column,7:20 mmol/L imidazole washing sample,8:30 mmol/L imidazole washing sample,9:250 mmol/L imidazole eluent sample,10:500 mmol/L imidazole eluent sample,11:Concentrated sample;(B)Western-blot detection after nickel column affinity purification.1:Protein marker,2:Sample before induction,3:Sample after induction,4:Supernatant after bacteriostasis and centrifugation,5:Precipitation after bacteriostasis and centrifugation,6:Sample passing through the column,7:20 mmol/L imidazole washing sample,8:30 mmol/L imidazole washing sample,9:250 mmol/L imidazole eluent sample.
融合蛋白的His-SUMO标签有ULP1酶识别位点,因此可以用ULP1酶切除His-SUMO标签,得到无标签的mIDE蛋白。由图4A可以看出,经过4℃过夜的ULP1酶酶切,大部分融合蛋白已被切除His-SUMO标签。将经ULP1酶降解后的样品再次通过镍柱,除去ULP1酶和His-SUMO标签。从图4B可知,纯化后mIDE与标签His-SUMO、未完全酶切的融合蛋白及ULP1分离。将包含目标蛋白质的样品进行浓缩用于后续纯化。浓缩样品中蛋白质的质量浓度约为3.2 mg/mL。

图4 融合蛋白的ULP1酶切结果(A)融合蛋白经ULP1酶切和镍柱亲和纯化后的12%SDS-PAGE检测。1:蛋白质分子量标准,2:酶切前的样品,3:酶切后的样品;(B)融合蛋白经ULP1酶切和镍柱亲和纯化后的Western-blot检测。1:蛋白质分子量标准,2:酶切前的样品,3:酶切后的样品。Fig.4 ULP1 digestion of mIDE fusion protein(A)12%SDS-PAGE detection of affinity purification of mIDE on nickel column after fusion protease digestion.1:Protein marker,2:Sample before digestion,3:Sample after digestion;(B)Western-blot detection of affinity purification of mIDE on nickel column after fusion protease digestion.1:Protein marker,2:Sample before digestion,3:Sample after digestion.
野生型mIDE的等电点(pI)为6.08,当蛋白质所在缓冲液pH为8.0时,mIDE整体带负电,利用这种性质,可以采用离子交换层析法对前述纯化的mIDE进行进一步的纯化。文中选用GE Healthcare的Hitrap Q FF强阴离子交换柱进行纯化,通过NaCl梯度洗脱,将目的蛋白与杂蛋白进行分离纯化。层析过程如图5A所示。采用SDSPAGE检测洗脱样品,图5B中的泳道2~15对应图5A中20~90 mL收集的等间隔样品,其中2~10号泳道对应20~60 mL样品,11~15号泳道对应60~90 mL样品。从电泳结果(图5B)可知,在第4~10泳道,大量相对分子质量约50 kD的杂蛋白被洗脱下来;在第9~15泳道,大量目的蛋白mIDE(117 kD)被洗脱,但同时,部分70 kD的杂蛋白也随之被洗脱下来,收集此部分样品以备后续纯化使用。离子交换层析法所得样品的纯度在75%左右,质量浓度为340 μg/mL。

图5 mIDE离子交换层析结果(A)离子交换层析图谱(GE Healthcare Hitrap Q FF 5 mL强阴离子交换柱,25 mmol/L Tris,5%甘油,pH 8.0,0.5 mL/min,0~800 mmol/L NaCl梯度洗脱);(B)离子交换层析样品的12%SDS-PAGE检测。1:蛋白质分子量标准,2~15:离子交换层析中收集的样品(收集自20~90 mL洗脱样品)。Fig.5 The results of mIDE ion exchange chromatography(A)Ion exchange chromatogram(GE Healthcare Hitrap Q FF 5 mL strong anion exchange column,25 mmol/L Tris,5%glycerol,pH 8.0,0.5 mL/min,0~800 mmol/L NaCl gradient elution);(B)12%SDS-PAGE detection of ion exchange chromatography samples.1:Protein marker,2~15:Samples collected by ion exchange chromatography(collected from 20~90 mL elution samples).
因离子交换层析法得到的目标蛋白质中依然混有大量70 kD杂蛋白,所以利用凝胶过滤层析进一步纯化。凝胶过滤层析主要利用不同蛋白质的相对分子质量差异对其进行分离纯化。离子交换层析纯化所得mIDE的大小为117 kD,与70 kD杂蛋白的相对分子质量差异较大,故进一步选用HiLoad 16/60 Superdex 200 pg凝胶过滤层析柱对目标蛋白质进行分离纯化。该层析柱的分离范围为10~600 kD,柱床体积为120 mL,纯化过程中选用0.5 mL/min的流速进行洗脱。层析结果如图6A所示,间隔收集图中60 mL至90 mL的样品,进行SDS-PAGE检测。从图6B可以看出,mIDE在第2~8泳道(对应洗脱体积为65~74 mL)被洗脱下来,随后70 kD的杂蛋白在第9~14泳道(对应洗脱体积为75~90 mL)被洗脱下来;二者相差较近,仍有部分条带重合。收集1~6号样品进行浓缩,以备后续活性检测;浓缩后目标蛋白质的质量浓度为84 μg/mL,纯度约为90%。
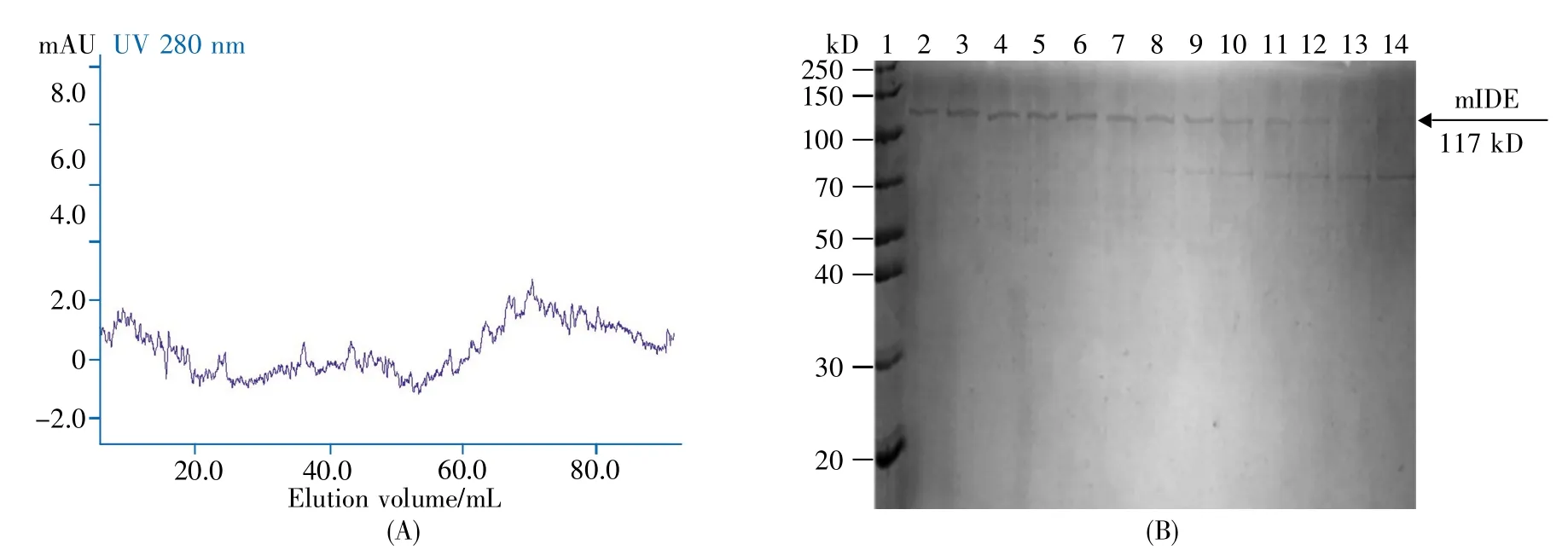
图6 mIDE凝胶过滤层析结果(A)凝胶过滤层析图谱(HiLoad 16/60 Superdex 200 pg 120 mL凝胶过滤柱,25 mmol/L Tris,500 mmol/L NaCl,5%甘油,pH 8.0,0.5 mL/min);(B)凝胶过滤层析样品的12%SDS-PAGE检测。1:蛋白质分子量标准,2~14:凝胶过滤样品(收集自60~90 mL洗脱样品)。Fig.6 The results of mIDE gel filtration chromatography(A)Gel filtration chromatogram(HiLoad 16/60 Superdex 200 pg 120 mL gel filtration column,25 mmol/L Tris,500 mmol/L NaCl,5%glycerol,pH 8.0,0.5 mL/min);(B)12%SDS-PAGE detection of gel filtration chromatography.1:Protein marker,2~14:Gel filtration samples(collected from 60~90 mL elution samples).
2.3 mIDE的活性测定
酶活反应体系为100 μL,mIDE加入体系后终浓度为4 nmol/L,Mca-RPPGFSAFK(Dnp)底物浓度为5 μmol/L,37℃反应50 min后,检测荧光强度的变化,激发光为320 nm,发射光为405 nm。图7A结果显示,野生型mIDE在30 min内的荧光强度快速上升,而后逐渐趋于平缓,在66 min左右达到最高点。采用双倒数作图法估算mIDE的最大反应速度vmax为1 111.111 RFU/min,Km值为6.222 μmol/L(图7B),这与文献报道的体外活性[26]较为接近,说明该体外表达纯化体系得到的mIDE具有良好的生物活性。
经查阅mIDE抑制剂相关文献[26~35],选用其中已报道的mIDE小分子抑制剂杨梅素[26],检测本文方法所制备的mIDE对抑制剂的响应情况,结果如图7 C所示,从中可以明显看出,在30 μmol/L杨梅素存在下,mIDE对荧光底物的降解效率明显降低。随后,保持mIDE浓度与底物浓度不变,梯度增加杨梅素的浓度,观察mIDE随抑制剂浓度增加的底物降解效率的改变,并利用Origin软件中的logistic函数进行非线性拟合,得到杨梅素的IC50值约为24 μmol/L(图7 D)。上述结果显示,杨梅素对mIDE展现出了较高的抑制效果,与文献报道结果[26]相符,这从另一方向印证了本方法获得的mIDE具有正常的生理活性并可用于后续的结构功能检测。

图7 mIDE活性检测结果(A)mIDE的活性检测图。数据均为3次实验所得平均值;(B)mIDE酶活反应米氏方程双倒数图。mIDE与1 μmol/L、3 μmol/L、6 μmol/L、9 μmol/L的荧光底物分别混合,用终点法测量并绘制mIDE速率与底物浓度的双倒数图;(C)杨梅素对mIDE酶活的抑制效果。数据均为3次实验所得平均值;(D)杨梅素对mIDE的IC50值测定。mIDE与不同浓度的杨梅素抑制剂分别混合,用终点法测量并绘制mIDE活性与抑制剂浓度的非线性拟合图。Fig.7 The results of mIDE activity test(A)The activity detection of mIDE.The data are the average values of 3 experiments;(B)The double reciprocal graph of mIDE rate and substrate concentration.mIDE and 1 μmol/L,3 μmol/L,6 μmol/L,9 μmol/L fluorescent substrates were separately mixed and measured,using the endpoint method;(C)The myricetin inhibitory activity detection of mIDE.The data are the average values of 3 experiments;(D)The nonlinear fit graph of mIDE activity and inhibitor concentration.mIDE and different concentrations of myricetin inhibitor were mixed and determined separately,using the endpoint method.
3 讨论
AD是一种以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性疾病,是一种在中老年中极为常见的疾病。针对AD的研究在百余年间从未间断,但其发病机制仍不清楚。同样,T2DM的相关研究也面临着类似的科学困难,其作为一种常见的激素失调型疾病,目前的发病机制仍不清晰,治疗途径亦不明朗。随着近些年来的研究发展,IDE在机体糖代谢调节与有毒物质清除方面的能力吸引了众多学者的目光。其在体内所承担的功能对AD和T2DM的发病及治疗过程均有着极为重要的作用,并有着潜在的疾病治疗靶点的重要价值。
本实验通过获取mIDE蛋白的全长基因片段序列,构建了大肠杆菌ppSUMO体外表达系统(图1);通过其高效可溶的特点,进行了野生型mIDE的体外表达及纯化。实验中,利用His-SUMO标签的优势,在ULP1酶和镍柱亲和纯化之后,成功获取到不含外源标签的野生型mIDE(图3~4),排除了残留标签对mIDE可能存在的影响。但由于样品中的蛋白质较为复杂多样,且根据图4B可以看出mIDE在表达过程中存在不同程度的降解,所以需要结合离子交换层析与分子筛层析对样品开展进一步的纯化。为确定后续纯化方法,通过ExPASy网站对融合蛋白进行了蛋白质性质预测,根据其等电点和预实验,选用Hitrap Q FF强阴离子交换柱进行纯化(图5)。根据离子交换层析结果可以看出,目标蛋白质的分离效果较好,但仍存在一定的优化空间,可以更进一步对梯度洗脱策略进行调整,从而加大分离效果,在离子交换层析部分得到更好的纯化效果。在分子筛层析中,利用HiLoad 16/60 Superdex 200 pg对mIDE和杂蛋白进行最终的分离纯化。从图6中可以看出,通过本实验方案,目的蛋白与70 kD左右的杂蛋白得到良好的分离,且最终可以得到纯度在90%以上的样品,为继续进行更深层次的mIDE研究奠定了基础。此外,本次实验还以Mca-RPPGFSAFK(Dnp)为反应底物,通过构建体外荧光酶活检测体系,建立了验证mIDE活性的方法,为mIDE的蛋白质工程改造或者后续抑制剂、激活剂的寻找和对比提供了实用的检测方案。
综上可知,本实验基于IDE已知的结构与功能,根据其理化性质,运用亲和层析、离子交换层析、凝胶过滤层析等方法成功分离纯化出野生型mIDE;同时,利用特异荧光底物和IDE已知抑制剂对分离纯化的mIDE进行了活性检测,结果显示采用该方法制备的mIDE具有较好的活性。本研究所建立的方法,为IDE小分子化合物的有目的筛选、IDE有效调控分子的获取提供了基础,对研究AD或糖尿病的新型疗法具有重要意义。在后续的工作中,课题组将进一步尝试使用X晶体衍射技术或小角散射技术对获得的蛋白质或蛋白质-药物分子复合物进行结构分析,以期获得更多结构信息,为IDE的蛋白质工程改造及小分子化合物筛选提供更多信息。

