下调Drp1对高糖条件下肾小管上皮细胞凋亡、氧化应激及炎症因子表达的影响
李曾一,王 松,高 宛,林玉玲
1)南阳市中心医院内分泌科 河南南阳 473000 2)郑州大学第一附属医院泌尿外科 郑州 450052
糖尿病肾病是一种临床上常见的糖尿病并发症,遗传学因素、氧化应激等是诱发糖尿病肾病的主要因素[1]。有研究[2]表明,肾小管上皮细胞损伤是糖尿病肾病进展的关键,高血糖能够诱导肾小管上皮细胞凋亡,促进细胞氧化损伤,进而造成肾小管组织功能异常。线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)是一种与线粒体分裂相关的蛋白,在人类新生儿发育中具有重要作用[3-4]。有研究[5-6]显示,糖尿病肾病中Drp1表达水平异常升高,Drp1参与阿德福韦诱发的肾小管上皮细胞功能损伤。本次实验以肾小管上皮细胞HK-2为研究对象,探讨Drp1在高糖诱导的肾小管上皮细胞损伤中的作用。
1 材料与方法
1.1 材料HK-2细胞购自美国ATCC公司。丙二醛(malonaldehyde,MDA)含量检测试剂盒购自北京索莱宝科技有限公司,超氧化物歧化酶(superoxide dismutase,SOD)含量检测试剂盒购自上海联迈生物工程有限公司,乳酸脱氢酶(lactate dehydrogenase,LDH)含量检测试剂盒购自碧云天生物技术研究所,炎性小体NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)抗体、白细胞介素-1β(interleukin-1β,IL-1β)检测试剂盒购自上海一研生物科技有限公司,Drp1抗体购自美国Abcam公司,活化型Caspase-3(Cleaved Caspase-3)抗体购自美国CTS公司,SYBR Green PCR试剂盒购自德国QIAGEN公司,Trizol试剂购自上海将来实业股份有限公司,Drp1 siRNA慢病毒和阴性对照慢病毒由山东解螺旋生物科技有限公司构建。
1.2 高糖对肾小管上皮细胞中Drp1表达的影响HK-2细胞分别培养于葡萄糖浓度为5.5、30.0 mmol/L的培养液中,记为正常对照组、高糖组,培养24 h后使用Real-time PCR和Western blot法检测细胞中Drp1 mRNA和蛋白的表达水平。
Real-time PCR:用Trizol法提取细胞总RNA。取5 μg总RNA样品,反转录合成cDNA,-80 ℃保存。PCR引物由南京金斯瑞公司合成,引物序列:GAPDH上游引物5’-GGTCACCAGGGCTGCTTTT-3’,下游引物 5’-ATCGCCCCACTTGATTTTG-3’;Drp1上游引物 5’-TGCTGTGGACTTGAGTTGGG-3’,下游引物5’-GGCTGGGTTTGTCGGTGTT-3’。按照SYBR Green PCR试剂盒说明步骤进行扩增。反应体系:2.0 μL cDNA,上、下游引物各1.0 μL,12.5 μL SYBR Green PCR Master Mix,8.5 μL dH2O。反应程序:90 ℃ 30 s;95 ℃3 min,95 ℃ 10 s,60 ℃ 30 s,共40个循环。读取Ct值,以GAPDH为内参,结果用2-ΔΔCt法计算。实验重复3次。
Western blot:在细胞中分别添加含PMSF的RIPA裂解液,振荡混匀,在冰上充分裂解,4 ℃12 000 ×g离心10 min,用移液枪把上清液转移到EP管中,-20 ℃保存。采用BCA法对蛋白样品进行定量检测。蛋白样品中添加上样缓冲液并煮沸变性,每个泳道上样30 μg,转膜后将PVDF膜以50 g/L脱脂奶粉溶液室温封闭2 h,加Drp1抗体(1∶600稀释),室温下反应2 h,加1∶3 000稀释的二抗,室温结合2 h,ECL法发光。Image J分析条带的灰度值,以目的蛋白与GAPDH条带灰度值的比值表示目的蛋白的相对表达量。实验重复3次。
1.3 Drp1 siRNA干扰效果检测将HK-2细胞接种于24孔板,每孔接种2×105个细胞。显微镜下观察细胞汇合度为40%~50%时,每孔添加1 mL Drp1 siRNA慢病毒液或阴性对照慢病毒液(MOI=20),孵育12 h后取出培养板,加入新的培养液。3 d后,用Puromycin筛选3周,挑选抗性细胞扩大培养。分别将稳定感染Drp1 siRNA慢病毒、阴性对照慢病毒的细胞置于高糖(葡萄糖浓度为30.0 mmol/L)细胞培养液内培养,记为Lv-si Drp1+高糖组和Lv-NC+高糖组,未感染仅以高糖细胞培养液培养的细胞为高糖组。用Real-time PCR和Western blot法检测细胞中Drp1 mRNA和蛋白的表达,以验证干扰效果,步骤同1.2。
1.4 Drp1 siRNA干扰对高糖环境下HK-2细胞凋亡和氧化应激、凋亡及炎症因子表达的影响将稳定感染Drp1 siRNA慢病毒或阴性对照慢病毒的HK-2细胞用高糖(葡萄糖浓度30.0 mmol/L)培养液培养,分别记为Lv-si Drp1+高糖组和Lv-NC+高糖组;未感染细胞分别用葡萄糖浓度为5.5、30.0 mmol/L的培养液培养,分别记为正常对照组、高糖组。
培养24 h后,收集上述4组细胞,用1×PBS洗涤2次,添加150 μL缓冲液后先加10 μL Annexin V-FITC,再加5 μL PI,混匀,室温、避光反应15 min,上流式细胞仪检测细胞凋亡。实验重复3次。
收集上述4组细胞培养24 h后的培养液上清,按照硫代巴比妥酸法检测MDA水平,用黄嘌呤氧化法检测SOD活性,用二硝基苯肼比色法检测LDH水平,用ELISA法检测IL-1β水平,步骤均参照试剂盒操作说明进行。 实验重复3次。
培养24 h后收集上述4组细胞,用Western blot法检测细胞中Cleaved Caspase-3和NLRP3蛋白的表达水平,步骤同1.2,一抗稀释度均为1∶600。实验重复3次。
1.5 统计学处理采用SPSS 21.0处理数据。采用两独立样本t检验比较正常对照组与高糖组 Drp1 mRNA和蛋白表达水平的差异;采用单因素方差分析比较高糖组、Lv-NC+高糖组、Lv-si Drp1+高糖组Drp1 mRNA和蛋白表达水平的差异;正常对照组、高糖组、Lv-NC+高糖组、Lv-si Drp1+高糖组细胞凋亡率,SOD、MDA、LDH及IL-1β分泌量,以及细胞中Cleaved Caspase-3和NLRP3蛋白表达水平的比较采用单因素方差分析,两两比较采用LSD-t检验;检验水准α=0.05。
2 结果
2.1 高糖对HK-2细胞中Drp1表达的影响结果见图1和表1。与正常对照组比较,高糖组细胞中Drp1 mRNA和蛋白表达水平升高。

1:正常对照组;2:高糖组

表1 2组细胞中Drp1 mRNA和蛋白表达水平的比较(n=3)
2.2 Drp1 siRNA的干扰效果结果见图2和表2。与其他2组比较,Lv-si Drp1+高糖组细胞中Drp1 mRNA和蛋白表达水平降低。

1~3:分别为高糖组、Lv-NC+高糖组、Lv-si Drp1+高糖组

表2 3组细胞中Drp1 mRNA和蛋白表达水平的比较(n=3)
2.3 4组HK-2细胞凋亡和氧化应激、凋亡及炎症因子表达的比较结果见图3,表3、4。与正常对照组比较,高糖组和Lv-NC+高糖组细胞凋亡率升高,Cleaved Caspase-3蛋白表达水平升高(图3A),MDA、LDH分泌增加,SOD分泌减少,IL-1β分泌增加,细胞中NLRP3蛋白表达水平升高;与高糖组和Lv-NC+高糖组比较,Lv-si Drp1+高糖组细胞凋亡率降低,Cleaved Caspase-3蛋白表达水平降低,MDA、LDH分泌减少,SOD分泌增加,细胞中NLRP3蛋白表达水平降低(图3B),IL-1β分泌减少。

1~4:分别为正常对照组、高糖组、Lv-NC+高糖组、Lv-si Drp1+高糖组
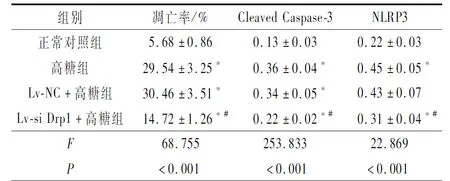
表3 4组细胞的凋亡率及Cleaved Caspase-3、NLRP3蛋白表达水平的比较(n=3)

表4 4组细胞SOD、MDA、LDH、IL-1β分泌量的比较(n=3)
3 讨论
高糖诱导的肾小管上皮细胞损伤模型是十分常见的糖尿病肾病细胞体外模型[7-9]。Caspase-3是Caspase凋亡反应的下游执行因子,其只有被活化后才可以发挥促进细胞凋亡的作用[10]。本实验表明,高糖刺激后肾小管上皮细胞凋亡率升高,细胞中活化的Caspase-3蛋白表达水平升高,说明构建了高糖肾小管上皮细胞损伤体外模型。
Drp1在多种生物体中存在且高度保守。人类Drp1基因定位在12号染色体上。Drp1蛋白由699个氨基酸组成,含有保守的中间结构域、装配域及含GTP酶结构的N端,多以多聚体的形式存在于胞浆中,参与细胞运输、细胞凋亡等过程[11-13]。野生型Drp1可以促进高糖条件下胰岛β细胞凋亡,诱导细胞氧化损伤;高糖刺激后人动脉内皮细胞中Drp1表达上调,Drp1沉默可以改善高糖环境下内皮细胞线粒体网络结构,提高一氧化氮利用度[14-15]。研究[5,16]显示,Drp1在糖尿病肾病小鼠肾组织内表达上调,白藜芦醇干预可以降低肾组织内Drp1的表达,改善糖尿病肾病肾组织损伤。本实验表明,高糖刺激后肾小管上皮细胞Drp1表达增强,说明Drp1有可能与高糖诱导的肾小管上皮细胞损伤有关。
高糖刺激后的肾小管上皮细胞发生氧化损伤以及炎性损伤是糖尿病肾病发生的重要机制;正常情况下细胞中氧化还原平衡的维持与细胞内抗氧化酶的活性有关,SOD是氧自由基清除剂,其活性降低能够直接导致细胞中氧自由基的积累,引起细胞内的脂质过氧化,生成MDA。由于脂质是细胞膜的主要组成部分,过量的氧自由基通过这种作用破坏细胞膜结构,促使细胞释放LDH等物质至细胞外[17-20]。此外,氧化应激往往伴随有炎症反应,NLRP3是广泛存在于细胞内的炎性小体,可被细胞内氧自由基激活,促进炎症因子IL-1β的表达,从而诱导细胞炎性损伤[21-22]。本实验结果表明,下调Drp1可以抑制高糖刺激的肾小管上皮细胞凋亡,提高SOD的分泌,减少MDA、LDH和IL-1β的分泌,下调细胞中NLRP3蛋白表达,说明下调Drp1能够减轻高糖刺激下的肾小管上皮细胞损伤,其作用机制可能与抑制氧化应激和炎症反应有关。
总之,下调Drp1能够减少肾小管上皮细胞凋亡,减轻高糖诱导的氧化应激反应和细胞炎性损伤,这对于研究糖尿病肾病具体的分子机制有重要意义,后续实验会在原代肾小管上皮细胞及体内进行验证。

