二十碳五烯酸对急性脑梗死大鼠梗死体积、神经功能及氧化应激-炎症反应的影响
李 春,赵高峰,薛文华,滕军放
1)郑州大学第一附属医院神经内科 郑州 450052 2)郑州市第三人民医院神经内科 郑州 450001 3)郑州大学第一附属医院药学部 郑州 450052
急性脑梗死(acute cerebral infarction, ACI)是指由于脑动脉血管粥样硬化及血栓形成引起急性脑组织血液供应障碍,而相应供血区脑组织缺血缺氧导致脑组织肿胀、坏死及功能障碍等[1-2]。ACI具有发病率高、致死率高、预后差等特点[3]。脑细胞缺血缺氧常伴随神经系统障碍、炎症反应、氧化应激反应等一系列的病理生理变化[4-5]。
二十碳五烯酸(eicosapentaenoic acid, EPA)是一种来源于深海鱼油、螺旋藻和微藻类的Ω-3不饱和脂肪酸。研究[6-8]表明EPA具有抗氧化、调节血脂、软化血管、减轻炎症、抑制动脉粥样硬化等作用,在心脏、肾脏疾病,糖尿病,免疫系统疾病及恶性肿瘤的治疗中发挥着重要的辅助作用。最近研究[9-10]提示EPA还可发挥神经保护作用。但EPA能否减小ACI患者的梗死体积、减轻神经功能障碍、调节其氧化应激-炎症反应仍不清楚。本研究拟利用大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)大鼠模型探究EPA对ACI所致的神经功能障碍及氧化应激-炎症反应的作用,并初步探讨其作用机制。
1 材料与方法
1.1 材料EPA、水合氯醛购自上海阿拉丁公司,TTC染液、多聚甲醛均购自北京索莱宝科技有限公司,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)检测试剂盒均购自南京建成生物研究所,超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)检测试剂盒及鼠抗人GAPDH抗体均购自武汉博士德生物工程有限公司,鼠抗人血管内皮生长因子(VEGF)抗体购自美国Abcam公司。64只SPF级成年雄性SD大鼠,体重200~220 g,购自北京维通利华技术有限公司,均饲养于河南省实验动物中心。根据《实验动物管理条例》,大鼠的饲养、使用均符合标准。环境适应性饲养7 d后用于实验。本研究中动物实验方案获得郑州大学实验动物管理与使用委员会批准。
1.2 MCAO模型建立根据文献[11-12]报道,采用改良线栓法构建可逆的大鼠左侧MCAO模型(n=52)。大鼠腹腔内注射水合氯醛(3.5 mg/kg)麻醉后仰卧位固定,去除颈部皮毛消毒后于正中纵向切口,钝性分离暴露颈总、内、外动脉。用动脉夹暂时阻塞颈总动脉,结扎颈外动脉以阻止血流。松开动脉夹,从颈外动脉残端插入线栓,深度16~20 mm,遇阻力停止。采用多普勒血流仪检测,大鼠颅内血流值低至基线值30%以下,表示模型制备成功。假手术组(n=12)大鼠进行相同的操作,但仅暴露血管,不栓塞。
1.3 动物分组与给药建模过程中4只造模失败,将建模成功的48只大鼠随机分为模型组及低、中、高剂量(150、300、600 mg/kg)EPA组,每组12只。EPA低、中、高剂量组每天给药1次,连续给药14 d。模型组和假手术组给予等体积的生理盐水。
1.4 神经功能缺损评分(mNSS)评估对造模后第1、3、7、14天的各组大鼠进行mNSS评分,分数越高,代表神经功能损伤越严重,最高分为18分。
1.5 TCC染色测量大鼠脑梗死体积每组6只于造模后第1天,余6只于第14天行mNSS评估后处死。采用水合氯醛麻醉大鼠并处死,快速取出大脑置于-80 ℃冰箱,于鼠脑槽中制备2 mm厚的冠状脑切片,加入预先配制的40 g/L TTC染液并在37 ℃恒温箱中进行孵育,40 g/L多聚甲醛溶液过夜固定。正常脑组织为红色,梗死灶为白色。采用Image J 1.41 图像分析软件进行统计分析。脑梗死体积=梗死面积×厚度/全脑体积×100%。
1.6 ELISA法检测大鼠脑组织中氧化应激-炎症反应因子表达情况取第14天大鼠脑组织,制备脑组织匀浆,采用ELISA法检测氧化应激因子SOD、CAT、MDA和炎症因子hs-CRP、TNF-α及IL-6的水平。
1.7 Western blot法检测大鼠脑组织中VEGF蛋白表达水平取第14天大鼠脑组织匀浆,裂解后提取总蛋白,SDS-PAGE凝胶法电泳,蛋白转至PVDF膜,体积分数5%牛血清白蛋白封闭2 h后加鼠抗人VEGF抗体(1∶600稀释),4 ℃孵育过夜。加二抗,摇床室温孵育2 h。PVDF洗膜3次,每次20 min,加入ECL显色剂。应用凝胶成像系统检测,分析目的条带/内参的相对表达量。
1.8 统计学处理采用SPSS 21.0处理数据。采用重复测量数据的方差分析比较不同时间点各组大鼠mNSS评分的差异,采用2×4析因设计的方差分析比较各组大鼠脑梗死体积的差异,采用单因素方差分析比较各组大鼠氧化应激-炎症反应因子水平及VEGF蛋白表达水平的差异,组间两两比较采用LSD-t检验。 检验水准α=0.05。
2 结果
2.1 不同时间点各组大鼠神经功能缺损评价结果见图1。与假手术组相比,模型组大鼠第3、7、14天的mNSS评分增高(P<0.05),表明其神经功能缺损严重;低、中、高剂量EPA组第7、14天mNSS评分均低于模型组(P<0.05)。
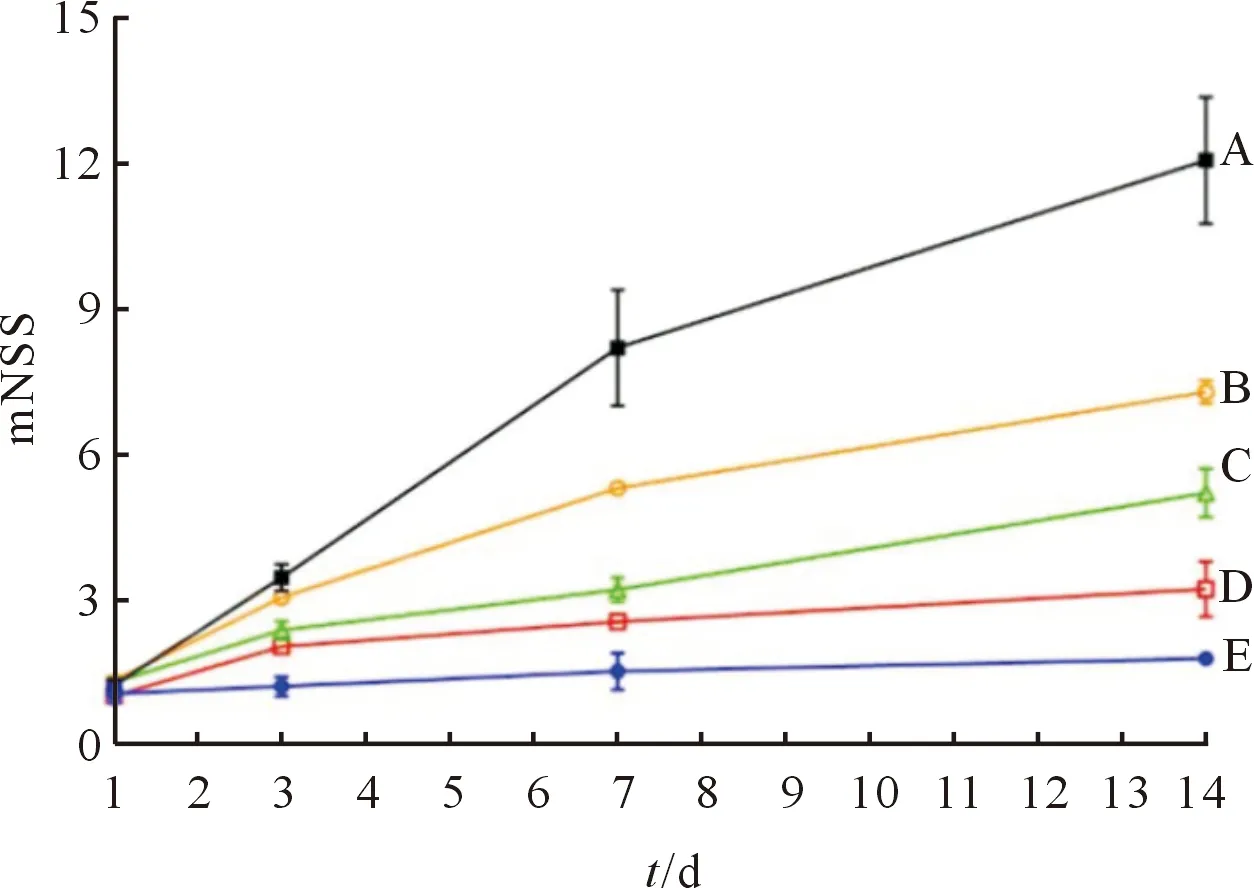
A:模型组;B、C、D:分别为低、中、高剂量EPA组;E:假手术组
2.2 各组大鼠脑梗死体积的比较假手术组未见脑组织梗死区域;模型组大鼠第14天脑梗死体积增大,而与模型组比较,低、中、高剂量EPA组的脑梗死体积缩小(P<0.05),且呈现一定的剂量依赖性(表1)。
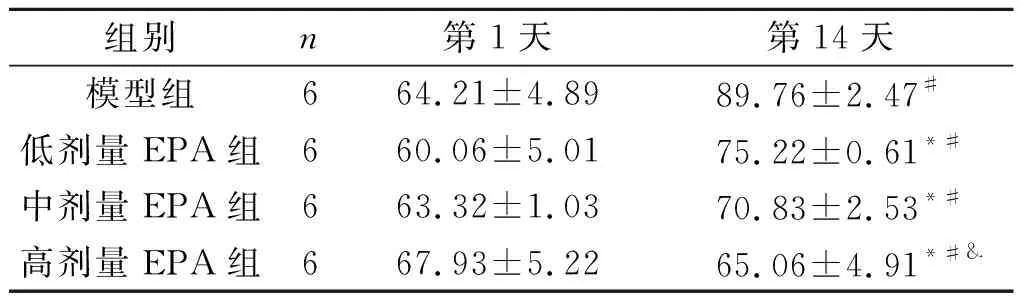
表1 各组大鼠脑梗死体积的比较 %
2.3 各组大鼠脑组织中氧化应激-炎症反应因子水平的比较第14天,与假手术组相比,模型组大鼠脑组织中SOD、CAT水平降低,MDA水平升高;与模型组相比,中、高剂量EPA组SOD、CAT水平升高,MDA水平降低(P<0.05),呈现出一定的剂量依赖性。
与假手术组相比,模型组大鼠脑组织中hs-CRP、TNF-α及IL-6水平均升高;与模型组相比,中、高剂量EPA组hs-CRP、IL-6、TNF-α水平降低(P<0.05),呈现出一定的剂量依赖性(表2)。
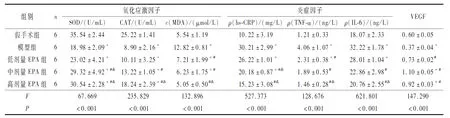
表2 各组大鼠脑组织中氧化应激-炎症反应因子水平及VEGF蛋白表达水平的比较
2.4 各组大鼠脑组织中VEGF蛋白表达水平的比较结果见图2、表2。第14天,与假手术组相比,模型组大鼠脑组织中VEGF蛋白表达水平降低;与模型组相比,低、中、高剂量EPA组VEGF蛋白表达水平升高(P<0.05)。

1~5:分别为假手术组,模型组及低、中、高剂量EPA组
3 讨论
脑卒中是全球第三大死亡因素,绝大多数脑卒中为ACI,具有发病迅速、死亡率高、预后差等特点;脑细胞缺血缺氧后伴随一系列病理生理学变化,如氧化应激反应、炎症反应、脂肪因子异常等,故ACI的发生、发展与脑部血液循环障碍密切相关[13-14]。EPA为Ω-3不饱和脂肪酸的一种。近期研究[8]发现,EPA可通过抗炎、抗氧化应激、改善线粒体功能等机制减轻心肌缺血损伤,治疗冠心病等,且在心脏、肾脏及免疫系统中发挥保护作用。
本研究观察了不同剂量EPA对左侧MCAO模型大鼠神经功能障碍及氧化应激-炎症反应的影响。目前临床已上市药物中多烯酸乙酯软胶囊的主要成分为二十碳五烯酸乙酯,临床剂量为30~90 mg/kg。根据体表面积折算法,推算大鼠的临床等效剂量为150~600 mg/kg,所以本实验设置EPA的低、中、高剂量分别为150、300、600 mg/kg。本研究结果显示,低、中、高剂量EPA连续给药14 d均可显著缩小模型大鼠的脑梗死体积,且呈现一定的剂量依赖性。ACI病灶中心区以神经元坏死为主,周围则是缺血半暗带(存在大量活神经元)[15]。推测EPA可能通过减少缺血半暗带神经细胞凋亡,激活神经细胞,从而减小脑梗死体积。此外,缺血性脑梗死局部血流量显著降低,伴随脑细胞萎缩与死亡,导致神经功能缺损[16]。本实验结果显示,与模型组相比,低、中、高剂量EPA组连续给药7、14 d后mNSS评分降低,表明EPA可在一定的剂量范围内减轻模型大鼠神经功能障碍,改善其神经功能。由于ACI是脑动脉闭塞或栓塞导致脑组织缺血、缺氧的一种急性脑血管病,病理生理过程包括炎性反应、细胞凋亡、神经细胞活动消失、能量代谢障碍、血管再生等,故EPA可能从多种途径发挥神经保护作用。
ACI一般伴有大量氧自由基形成,导致连锁反应,进而诱导氧化应激反应,造成损伤[17]。氧化应激是缺血缺氧状态下神经功能损伤的重要环节。MDA是脂质过氧化物,其表达水平反映氧化损伤的程度。而SOD和CAT是氧自由基清除剂,其活性水平与组织中氧自由基的积累密切相关。SOD、CAT及MDA是氧化应激的经典指标[18]。本研究结果显示,模型组大鼠脑组织中SOD、CAT水平比假手术组降低,而MDA水平升高,与以往研究[19-20]结果一致。而连续给予EPA治疗14 d后,SOD、CAT水平升高,MDA水平降低,表明EPA可减轻ACI大鼠的氧化应激反应。
炎症反应贯穿动脉粥样硬化及脑梗死病程,多种细胞因子与其密切相关。炎症反应激活可致TNF-α、CRP、IL-6等具有神经毒性的细胞因子大量分泌[21]。在脑缺血早期,TNF-α合成大量增多,可显著增加血管内皮细胞通透性,为诱发脑梗死的重要因素。此外,TNF-α可诱导细胞间黏附分子-1的表达,诱导白细胞活化、趋化、黏附、渗出进而诱导炎症反应的发生;CRP是巨噬细胞分泌的细胞因子刺激肝细胞产生的一种急性反应蛋白;IL-6是一种多功能促炎因子,可诱导炎症急性期反应[22]。本实验结果显示,模型组脑组织中hs-CRP、TNF-α及IL-6水平高于假手术组;而中、高剂量EPA给药14 d后均可降低模型大鼠脑组织中hs-CRP、TNF-α及IL-6水平,表明EPA可抑制炎症反应,减轻神经损伤。
脑梗死缺血后神经修复的基础与关键是血管新生,可为神经再生提供重要的营养支撑。VEGF是血管新生的关键调控因子,可通过促进血管内皮细胞增殖、存活和诱导细胞外基质的降解促进新血管形成[23-24]。本实验研究结果发现,模型大鼠脑组织中VEGF表达水平降低,与李磊等[20]研究结果相似;而EPA各治疗组大鼠脑组织中VEGF表达升高,且呈现一定的量效关系,表明EPA可促进局灶性脑梗死大鼠脑血管新生。
综上所述,EPA可降低ACI大鼠的脑梗死体积,改善神经功能,有效缓解氧化应激-炎症反应,其作用机制可能与促进脑血管新生有关。

