TSC1基因一个新的杂合错义突变1例报告
张儒
结节性硬化症(tuberous sclerosis complex,TSC)是一种由外胚层组织和器官发育异常导致的遗传性疾病,可累及全身多个系统和器官,引起皮肤、脑、肾脏等器官病变。该病引起的脑部病变以癫痫发作常见,目前认为脑皮质结节是引起患者癫痫发作的主要原因[1]。临床可见到多种发作类型,常见到癫痫发作。TSC目前的治疗手段一般是以药物治疗为基础的长期综合治疗,长期的治疗给TSC患者带来更多的经济负担[2-3]。而外科治疗为有创治疗,受到病灶的数量、分布、定位的限制,致痫灶结节累及皮层范围小可能有更好的手术预后[4]。而癫痫发作多数需要多种抗癫痫药物联合治疗,容易进展为药物难治性癫痫,进而引起认知和行为功能障碍[5]。在药物治疗中,雷帕霉素作为靶向药物受到重视。该药为亲免素阻断剂,通过与在TSC发病中起到重要作用的雷帕霉素敏感的靶蛋白(mTOR)特异性结合发挥抑制结节生长的作用。但该药为免疫抑制剂,在抑制颅内结节生长的同时也对机体正常免疫系统功能产生干扰,有造成肿瘤发生的风险。因此,有必要对TSC的发病机制、信号传导进行详尽研究以指导优化治疗方案。
目前TSC遗传学特征为常染色体显性遗传,并对信号传导有了一些了解[6-8]。目前已知致病变异基因为TSC1和TSC2。TSC基因变异多样,外显率不一,虽有研究分析对基因突变位点做出统计[9-10],但对热点突变尚无统一结论,且不能根据患儿基因型准确推断其临床表型。本案例的突变位点有助于完善TSC基因变异谱,为寻找其变异规律,明确临床表型与基因型的关系提供证据,有助于早期诊断。
1 病例报告
患儿女性,2岁零4个月。因反复抽搐发作就诊,表现为反复的双眼凝视,伴有口角左歪,呼之不应,每次持续几秒钟到30 s后自行缓解,缓解后如常。每日数次。患儿3个月能抬头,6个月会坐,1岁会走,发病前已入托儿所,已会走、会跑,发育与同龄儿相符。体格检查可见患儿腰背部数枚3 cm×2 cm的色素脱失斑(图1)。患儿母亲有颜面部血管纤维瘤(图2)。患儿外祖父和母亲在外院体检发现头颅和脊柱均有结节,均否认癫痫病史和癫痫发作史。本例患儿单次视频脑电图监测到局灶性发作,伴有同期痫样放电(图3)。

图1 本例患儿背部的色素脱失斑

图2 本例患儿母亲有面部血管纤维瘤
2 治疗经过
结合患儿病史、发作时表现,故诊断为癫痫局灶性发作。予以奥卡西平混悬液口服抗癫痫治疗。为进一步明确病因,行头颅CT检查发现颅内右侧脑室旁可疑孤立钙化影(图4),心脏彩超示横纹肌瘤(图5)。考虑TSC可能性大,在与家人充分沟通病情并征得同意后,对先证者(患儿)及其父母外送全外显子检测(北京智因东方转化医学研究中心,北京全谱医学检验实验室)。采集患儿和其父母的外周血样品送检,全外显子组测序采用IDT The x Gen Exome Research Panel v2.0全外显子捕获芯片捕获并测序完成。对目标序列进行PCR后,经ABI3730测序仪进行Sanger测序验证,并经序列分析软件得到验证结果。检测发现在9号染色体上的TSC1基因存在突变。检索数据库db SNP、千人基因组、千人南方、千人北方、Genome AD、Genome AD东亚均未收录,考虑新发突变。发现患儿及其母亲携带有TSC的TSC1基因突变 c.664-10(IVS7)A> G(图6)。
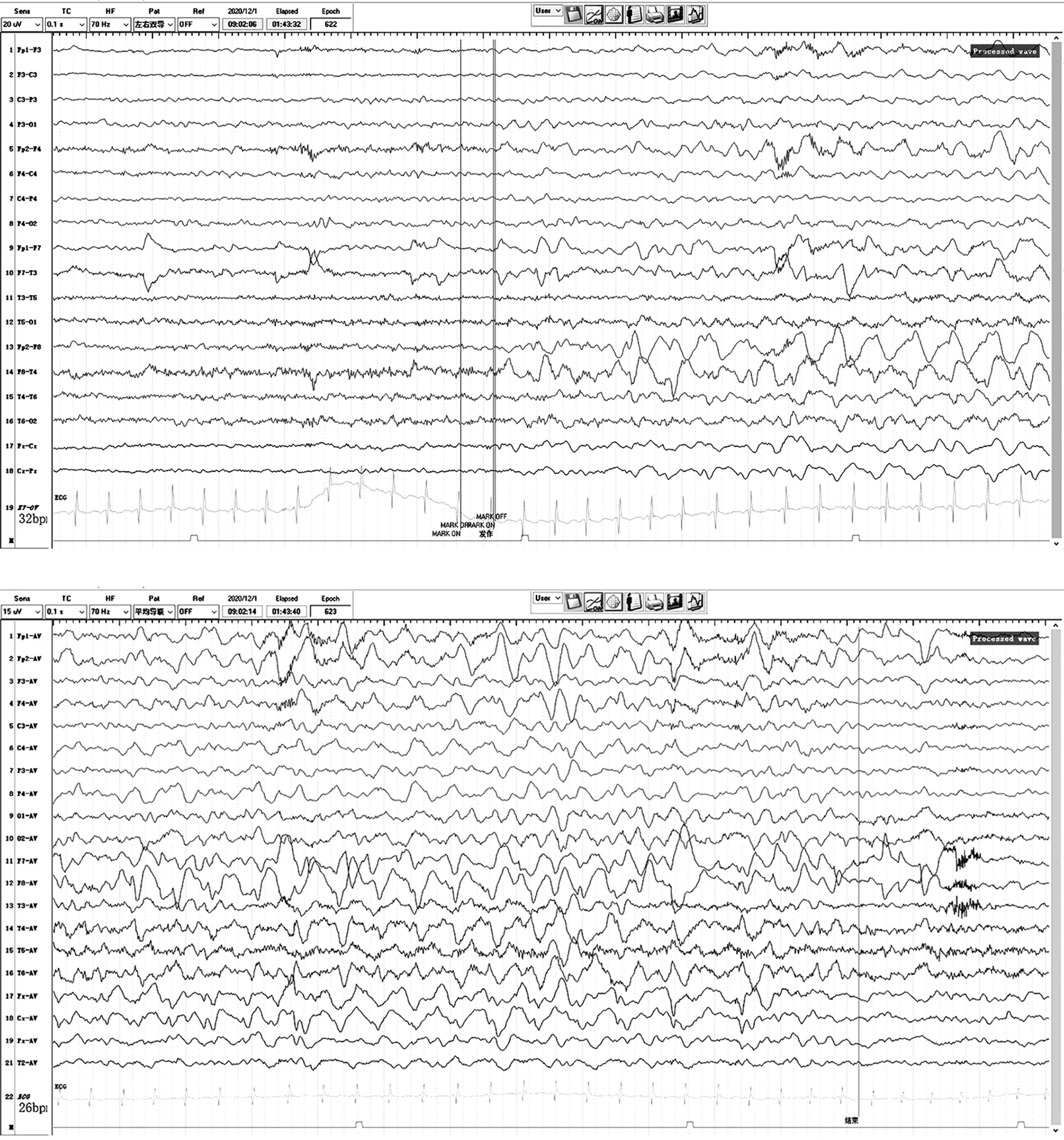
图3 本例患儿的发作期脑电图。右侧颞区示中等波幅慢波→频率渐慢,波幅渐高,插入尖波,波及同侧额区及同侧半球。
根据患儿的癫痫发作类型,予以奥卡西平混悬液口服,3 d后发作次数减少,发作持续时间缩短,予以安排出院,嘱院外奥卡西平混悬液逐渐加量。出院3 d后随访患儿发作已终止。

图4 本例患儿头颅CT 示右侧脑室旁可疑孤立钙化点

图5 本例患儿的心脏彩超示心脏横纹肌瘤

图6 本例患儿及其父母的基因检测结果。A和B:患儿先证者和其母亲可见c.664-10(IVS7)A> G杂合突变(箭头所指);C:在其父亲未见该突变。
3 讨论
TSC是一种较为少见的神经皮肤综合征,全世界约有300万人患病[11]。该病为常染色体显性遗传,目前有TSC1 和 TSC2 两个致病基因。根据LOVD 数据库报告,TSC 2基因突变的频率与TSC1的比值约为7∶3[12]。以往研究[13]认为,TSC1基因突变所致症状较TSC2基因轻。本家系中患儿以局灶性发作为主,到就诊时病程1个月,无明显智力发育落后和倒退。由于患儿病程短,是否出现智力发育落后有待随访观察。
有学者认为,TSC1基因突变大多是由无义突变或移码突变及剪切突变导致蛋白质翻译过程提前终止引起。而TSC2 基因突变多为错义突变、大片段缺失或重组引起[1,14]。TSC1基因突变所致症状较TSC2基因轻[15-17],本例中患儿的临床表现、基因突变位点均与以往的结论相符合。对于该疾病的诊断标准,修订了很多次,随着分子诊断及创新治疗药物的进展,促使于2013年重新修订了诊断标准,增加了基因诊断,基因检测阳性即可诊断TSC[17-18]。此外,在调节细胞增殖的信号通路上,TSC1和TSC2两个蛋白以异二聚体吸附于TBC1D7蛋白,作为一个蛋白复合体通过雷帕霉素敏感的靶蛋白通路来调控细胞生长、细胞大小、细胞周期及细胞增殖[19]。此外Ras同源蛋白也参与到细胞增殖周期的调节中,可推测下游信号转导组件发生改变[20]。该患儿突变靶点虽然不在外显子序列中,但位置靠近外显子终点,可能对核内不均一RNA(heterogeneous nuclear RNA,hnRNA)转录产生影响,或患儿存在其他信号通路突变。总之,该病例突变基因位点的发现有助于提高对TSC致病机理和突变位点的认识,为临床和科研中认识突变规律提供依据。
皮肤症状是TSC临床最容易注意的特点。临床注意查体,根据皮肤改变易作出正确诊断,即使是刚出生的婴儿。皮肤改变包括色素脱失斑、面部血管纤维瘤(错构瘤结节)、前额纤维性斑块、鲨鱼皮样斑、甲周纤维瘤等。与TSC相关的癫痫常常发生于1岁内的患儿,多为局灶性发作,可发展成为婴儿痉挛症。本例患儿查体有皮肤色素脱失斑,但无其他皮肤损害,在脑CT检查时仅发现孤立侧脑室旁小钙化点,易漏诊。患儿母亲因无癫痫发作,故未作进一步检查和治疗。患儿家庭中不同成员临床表现症状差异大的原因:①基因表达在不同细胞间存在差异,部分患者的神经细胞阈值较高,不易发生癫痫;②由于致病基因来源不同,存在基因印记,可能存在基因的沉默。这说明TSC临床表现的异质性。患儿发病前其母亲未到医院就诊,本次基因检测才最终明确TSC诊断和致病基因遗传方式。主要原因是患儿家长对疾病缺乏认识。这提醒临床工作中需要对无癫痫发作和不典型的疑似TSC患者及时予以明确诊断,对成年患者应加强优生优育的宣教,阻断致病基因的下传,减轻家庭和社会医疗负担。

