UPLC-MS/MS 法测定注射用伏立康唑产品工艺组件中2,5-二甲基-2,5-己二醇
汪 辉,邵红霞,秦秋明
(上海微谱化工技术服务有限公司,上海 200438)
随着医药行业的迅猛发展,公众对药品安全的要求也越来越高,这种要求不仅仅限于药品本身的质量,也逐渐扩展到药品的辅料及其包装材料的质量。人们讨论药品包装材料的质量时,往往想到的是包装材料本身的质量,药品生产工艺中直接接触的工艺组件却容易被忽视,工艺组件与工艺液体的相容性问题也成为目前药品研发过程中需要解决的问题。与成品包装材料一样,工艺组件也会有浸出物浸出的风险,一些浸出物会在生产过程中造成杂质和不溶性微粒增多,影响产品质量;一些浸出物会随着生产过程进入成品,最终被患者摄入而产生安全隐患。
业界为鼓励企业开展科学有效的可提取物和浸出物研究,自2010 年起,生物工艺系统联盟(BPSA)[1-2]和生物医药联盟(BPOG)发布了一系列白皮书[3];国家药品监督管理局(NMPA)分别在2018 年和2019 年发布了《除菌过滤技术及应用指南》[4]和《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》[5];美国药典也发布USP<665>和<1665>两个指导原则的征求意见稿,分别关于药品生产过程中用到的聚合物部件或系统,旨在指导企业对生产工艺中使用到的工艺组件进行有效的风险控制。
伏立康唑是一种三唑类抗真菌药物,为氟康唑衍生物,具有抗菌谱广、毒性低及抗菌效力强的特点[6-7]。国内生产企业A 厂生产注射用伏立康唑的过程中要接触不锈钢、陶瓷泵、硅胶管道、垫片等工艺组件。硅胶管道、垫片通常以高分子材料为主体,配合其他添加剂经过一系列工艺制成。在与工艺组件和工艺液体的接触过程中,这些添加剂往往容易形成单体或者降解产物,这些产物均有可能浸出到工艺液体中,影响工艺液体的质量,或者最终进入药品对患者直接产生安全隐患。经对国内生产企业A 厂的一批工艺组件(硅胶管道和垫片)进行提取研究后,在4 种提取溶剂(酸性水相溶液、碱性水相溶液、药液模拟液和乙醇水溶液)中,均发现2,5-二甲基-2,5-己二醇、4-甲基-3-戊烯酸、六甲基环三硅氧烷类似物等半挥发性有机物,检出结果超过分析评价阈值(AET,analytical evaluation threshold)[8]。因2,5-二甲基-2,5-己二醇在所有超出AET 的化合物中安全边界(MOS,margin of safety)值最小,相对风险最大,故选取其作为目标物进行浸出物方法学研究。
2,5-二甲基-2,5-己二醇(2,5-Dimethyl-2,5-hexanediol,DHD)极性强,没有紫外吸收基团,不适合液相分析。目前,关于DHD 检测的相关研究未见报道。本文通过探索研究,采用超高液相色谱-电喷雾电离源-三重四极杆质谱法(UPLCESI-MS/MS),优化前处理方法及定量方法后,建立了测定注射用伏立康唑产品工艺组件中DHD浸出量的方法。
1 仪器与试药
1.1 仪器
ACQUITY I CLASS&QTRAP 6500 超高效液相色谱三重四级杆质谱联用仪,含有超高效液相色谱仪(Waters 公司)、大气压化学电离源和三重四级杆质量分析器(AB SCIEX 公司);XW-80A旋涡混合器(常州阿米勒仪器科技有限公司);XPR206DR/A 型十万分之一电子天平(METTLER TOLEDO 公司);Direct 8 超纯水仪(密理博公司)。
1.2 试剂和试药
2,5-二甲基-2,5-己二醇对照品(批号T3924),购自Adamas-beta,含量为99.00%;2-甲基-2,4-戊二醇对照品(批号L0130005),购自CNW,含量为99.9%;甲醇和乙腈,购自SIGMAALDRICH,均为色谱纯;氨水,购自CNW,质谱纯;甲酸铵,购自罗恩试剂,色谱纯;氯化钠,购自GENERAL-REAGENT,分析纯;水为Direct 8 超纯水仪制备的超纯水。注射用伏立康唑样品(批号为2006051、2006052、2006053),来自于国内生产企业A。
2 方法与结果
2.1 色谱-质谱条件
2.1.1 色谱条件
色谱柱:ACQUITY UPLC BEH PHENYL(2.1 mm×50 mm,1.7 μm);流动相:甲醇(A),氨水-纯化水(0.1:100)(B)。梯度洗脱程序见表1,流速:0.3 mL/min,柱温:35 ℃,样品室温度:15 ℃,进样量:10 μL。

表1 梯度洗脱程序Tab.1 Gradient elution procedure
2.1.2 质谱条件
离子源:ESI(电喷雾电离源);离子模式:负离子模式;气帘气(CUR):276 kPa;碰撞气(CAD):Medium;离子喷雾电压(IS):-4500 V;雾化温度(TEM):500 ℃;雾化气(GS1):345 kPa;辅助加热气(GS2):345 kPa。扫描方式:多反应监测模式(MRM),监测离子参数见表2。

表2 2,5-二甲基-2,5-己二醇(DHD)和2-甲基戊烷-2,4-二醇(MPD)的质谱参数Tab.2 Mass spectrometric parameters for 2,5-dimethyl-2,5-hexanediol (DHD) and 2-methylpentane-2,4-diol (MPD)
2.2 溶液的制备
2.2.1 对照品溶液
称取DHD 标准物质31.710 mg 置于10 mL量瓶中,用乙腈溶解后稀释至刻度,摇匀;量取该溶液32.0 μL 置于10 mL 量瓶中,用乙腈稀释至刻度,摇匀,得到浓度为10.0 μg·mL-1的DHD 标准物质溶液A。
称取MPD 标准物质40.105 mg 置于10 mL量瓶中,用乙腈溶解后稀释至刻度,摇匀;量取上述溶液25.0 μL 置于10 mL 量瓶中,用乙腈稀释至刻度,摇匀,得到浓度为10.0 μg·mL-1的MPD标准物质溶液B。
量取DHD 标准物质溶液A 和MPD 标准物质溶液B 各170 μL,置于10 mL 量瓶中,即得对照品溶液(DHD:34.0 μg·L-1,MPD:34.0 μg·L-1)。
2.2.2 样品溶液
样品母液:取注射用伏立康唑样品1 瓶,加入纯化水19.00 mL 复溶。
样品溶液:量取样品母液5.000mL 置于20mL 样品瓶中,加入内标MPD 标准物质溶液B 170.0 μL和萃取剂乙腈2.500 mL,再加入氯化钠摇动,直至瓶底出现流沙状,涡旋0.5 min,静置10 min,量取上层清液1.000 mL 置于10 mL 量瓶中,用纯化水稀释至刻度,摇匀。平行制备2 份溶液,依次得到样品溶液1 和样品溶液2。
2.3 线性关系考察
分别量取纯化水5.000 mL 置于若干20 mL样品瓶中,依次加入DHD 标准物质溶液A 50 μL、100 μL、170 μL、255 μL、340 μL 以及内标MPD标准物质溶液B 170 μL,各加入萃取剂乙腈2.500 mL,再加入氯化钠摇动,直至瓶底出现流沙状,涡旋0.5 min,静置10 min,量取上层清液1.000 mL 置于10 mL 量瓶中,用纯化水稀释至刻度,摇匀,配制成一系列梯度浓度的标准曲线溶液,具体质量浓度分别为:DHD:10.0 μg·L-1、20.0 μg·L-1、34.0 μg·L-1、51.0 μg·L-1、68.0 μg·L-1;MPD:34.0 μg·L-1。分别精密吸取系列标准曲线溶液10 μL,按2.1 项下试验条件测定,以DHD与内标物MPD 的峰面积比值Y 为纵坐标,以DHD 与内标物MPD 标准曲线的质量浓度比值X为横坐标,得回归方程:Y=0.0626X+0.0749,r=0.9990,表明DHD 在10.0~68.0 μg·L-1的范围内呈良好的线性关系(见图1)。
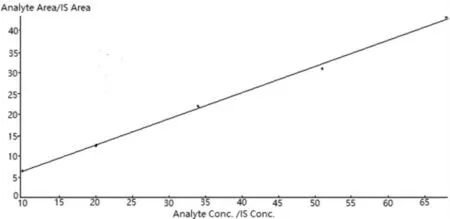
图1 DHD/MPD 线性关系图谱Fig.1 Linear graph for DHD/MPD
2.4 定量限和检测限测定
将对照品溶液按照2.3 项下的方法逐级稀释制备,按2.1 项下试验条件测定,以信噪比(S/N)确定DHD 的检测下限为3.0 μg·L-1(S/N≈3),定量下限为10.0 μg·L-1(S/N≈10)。
2.5 重复性试验
量取样品母液5.000 mL 置于20 mL 样品瓶中,分别加入DHD 标准物质溶液A 170.0 μL 以及MPD 标准物质溶液B 170.0 μL,加入萃取剂乙腈2.500 mL,再加入氯化钠摇动,直至瓶底出现流沙状,涡旋0.5 min,静置10 min,量取上层清液1.000 mL 置于10 mL 量瓶中,用纯化水稀释至刻度,摇匀。平行制备6 份,按内标法定量,计算6份重复性溶液DHD 的平均含量,RSD 为1%,表明本方法的重复性良好。重复性溶液定量离子谱图见图2。
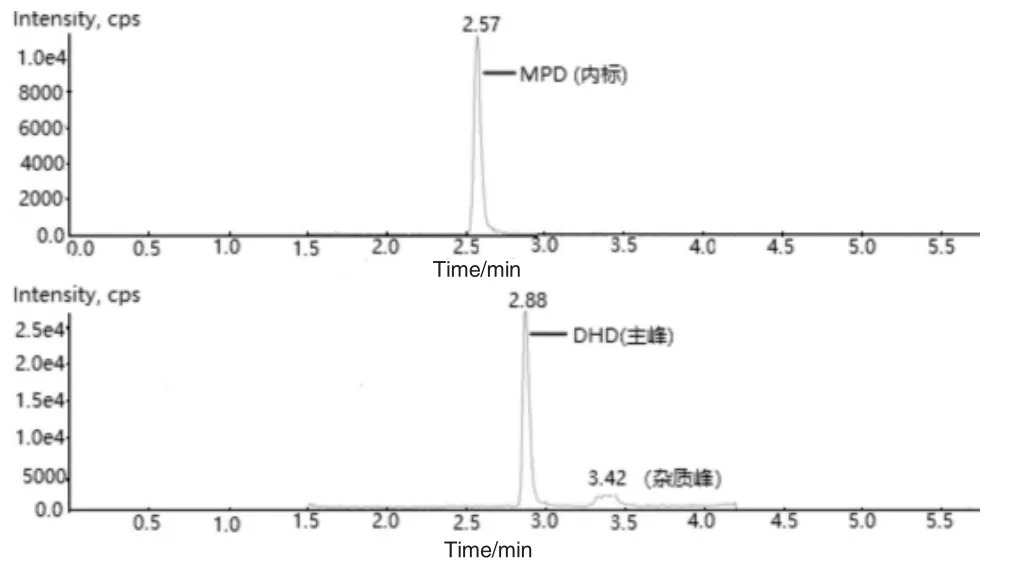
图2 DHD/MPD 重复性图谱Fig.2 Repeatability graph for DHD/MPD
2.6 稳定性试验
取2.5 中的1 份重复性溶液,分别在室温下放置0 h、6 h、12 h、18 h、24 h 时,按2.1 项下试验条件测定,按内标法定量。结果:各稳定性考察点结果与0 点的峰面积RSD 小于8%,供试品溶液在24 h 内稳定。
2.7 回收率试验
按照2.4 项下的方法,分别加入DHD 标准物质溶液A 50.0 μL、170 μL 及255 μL,各加入内标MPD 170.0 μL,平行制备3 份低浓度水平、3 份中浓度水平、3 份高浓度水平供试品溶液。按2.1 项下试验条件测定,按内标法定量。回收率结果见表3。

表3 加标回收率试验结果(n=9)Tab.3 Results of recovery tests (n=9)
2.8 样品检测
取国内生产企业A 厂的三批注射用伏立康唑样品(批号为2006051、2006052、2006053),每批取1 瓶,按2.2.2 项方法制备样品溶液,取10 μL 注入超高效液相-串联质谱仪,记录质谱峰峰面积,内标法计算DHD 浓度,结合工艺液体信息,计算出每平方厘米工艺组件中DHD 的浸出量,计算公式见式(1),测定结果见表4。


表4 三批注射用伏立康唑产品工艺组件中DHD浸出量Tab.4 Extraction amount of DHD in voriconazole for injection in process components
3 讨论
3.1 DHD 浸出量的安全性评估
通过查阅文献及毒性数据库的相关资料,DHD 被归类为Cramer III 类物质[9]。根据对Cramer III 类物质的重新评估得到的毒理学关注阈值(threshold of toxicological concern,TTC)表明,可以将非有机磷酸酯、非氨基甲酸酯或非有机卤素化合物的阈值调整至4 μg/(kg·d)[10],按成年人50 kg/人计算[11],每日允许最大暴露量(permitted daily exposure,PDE)为200 μg/d。由于TTC 阈值是通过口服给药数据而不是肠道给药数据获得的,因此,根据欧洲化学品局ECHA 关于化学安全性评估的指南[12]以及FDA 文件,口服至肠道外途径的转换因子设为10[13],因此该DHD 的PDE 确定为20 μg/d。由药品说明书可知,注射用伏立康唑每日最大使用量(acceptable daily intake,ADI)为120 mL(6 瓶,19 mL/瓶),根据样品中检出浓度,结合工艺液体信息计算出工艺组件每平方厘米可能迁移入药品的量,将其与限值进行比较,以评估迁移入药品的DHD 是否会为患者带来安全性风险。

式(2)中:PDE 为20 μg/d;ADI 为6 瓶/d;实际灌装成品数量为2000 瓶;总接触面积为4008 cm2。由此计算得到限值为1.6 μg/cm2。
表4 中DHD 的浸出量均低于其限值,表明注射用伏立康唑由工艺组件(硅胶管道、垫片)中DHD 迁移带来的安全风险较低。但不同工艺组件(硅胶管道、垫片)厂家的生产工艺不一样,仍需注意DHD 在工艺组件中的浸出量。
3.2 仪器的选择
因DHD 极性强、没有紫外吸收基团,不适合液相分析,故最初尝试用气相色谱-质谱联用仪进行分析方法开发。但试验发现气质联用法在稀释剂乙腈、甲醇、乙酸乙酯、正己烷等多种溶剂中均检出DHD,干扰较大,无法进行方法学开发。尝试以超高效液相-串联质谱法进行方法开发后,发现空白稀释剂(水)及过程空白无干扰,故最终确定以超高效液相-串联质谱法作为试验方法。
3.3 色谱柱的选择
用BEH C18 色谱柱分离时,发现供试品加标溶液中目标物DHD 附近有干扰峰,不能完全分离。考虑到伏立康唑带有氟苯基基团,该杂质干扰峰可能由伏立康唑的工艺杂质引入,也可能具有类似苯环结构,故将色谱柱更换为Phenyl 柱以增加该杂质在色谱柱中的保留。结果表明,在BEH Phenyl 柱上,该杂质干扰峰保留确实得到了加强,出峰时间由DHD 延至DHD 出峰后(见图2中RT=3.42 min 的杂质峰),与DHD 间分离度大大提高。故选用BEH Phenyl 柱为分析柱。
3.4 流动相的选择
实验过程中,分别考察了甲醇-0.05%氨水体系、甲醇-0.1%氨水体系、甲醇-0.1%甲酸铵水体系,发现甲醇-0.1%氨水体系能得到良好的峰形及更高的峰响应值。故选择甲醇-0.1%氨水体系作为流动相进行梯度洗脱。
3.5 外标、内标定量方法的选择
尝试多种前处理方式:采用直接用水稀释后进样,外标法测定,回收率小于50%;改用乙腈萃取后进样,外标法测定回收率有所改善,但仍偏低,约在60%~70%之间。查询该生产企业A 厂注射用伏立康唑的工艺液体配方,其中含有较大浓度的倍他环糊精钠为辅料以增加药物的溶解性[14-15],怀疑倍他环糊精钠基质干扰回收率。为抵消样品基质的影响,选择另一二醇类化合物2-甲基戊烷-2,4-二醇(MPD)为内标,DHD 回收率显著改善。故选用内标法为定量方法。
3.6 质谱参数的考察
对质量浓度为1 mg·L-1的DHD 和MPD 在电喷雾离子源(ESI)+/-和大气压化学电离源(APCI)+/-的4 种方式下进行一级质谱母离子扫描。结果表明,在ESI 负离子模式下DHD 和MPD中目标物有更好的响应,基峰均为[M-H]-。选定[M-H]-为母离子后,进行二级质谱扫描,寻找子离子碎片,确定丰度最高的子离子为定量离子(碎片图见图3 和图4),最终确定响应丰度最高的70.9 为DHD 定量离子,57.0 为MPD 的定量离子。确定定量离子之后,继续在多反应监测模式(MRM)下优化最佳去簇电压(DP)和最佳碰撞能量(CE),以达到最佳的检测灵敏度。

图3 DHD 二级离子图Fig.3 Secondary Ion Mass Spectrogram of DHD

图4 MPD 二级离子图Fig.4 Secondary Ion Mass Spectrogram of MPD
4 结论
本文建立了用超高效液相-串联质谱法(UPLC-MS/MS)内标法测定注射用伏立康唑产品工艺组件中2,5-二甲基-2,5-己二醇的方法,对检测器、色谱柱、流动相、定量方法、离子对等进行了研究,最终确立的方法具有专属性强、灵敏度高、准确度高、抗干扰能力强的特点,可用于注射用伏立康唑中2,5-二甲基-2,5-己二醇的风险监测,也可为其他类产品中DHD 的检测提供参考。

