氨缓冲体系电子级四氧化三锰的制备
李玉婷, 莫燕娇, 甘永兰, 张 帆, 杨雄强
(广西锰华新能源科技发展有限公司,广西 钦州 535000)
随着经济的不断发展,我国对新能源材料的需求也在不断地上升,为了降低能耗,减少污染,动力锂离子电池也得到了快速的发展[1]。尖晶石锰酸锂(LiMn2O4)因其具有能量容量大、充放电能力好、安全无毒等优点被广泛用作锂离子动力电池的正极材料[2]。传统工艺上制备LiMn2O4的方法主要是通过锂盐和电解MnO2焙烧制成。最新研究表明,相比于MnO2,Mn3O4是一种更佳的制备LiMn2O4的优质原料,这是因为Mn3O4和LiMn2O4在结构上有着相同的尖晶石结构,且利用Mn3O4制备LiMn2O4的过程中不会引起Mn3O4结构发生变化[3]。随着Mn3O4制备工艺的不断进步,利用高比重、类球形的Mn3O4制备的LiMn2O4更能达到电池容量大、循环充放电性能好和安全性能高的条件。因此,制备高品质、精细化、满足制备高端锰酸锂原料要求的Mn3O4具有极其重要的意义。
目前,Mn3O4的制备方法可根据原材料的不同分为以下几种:电解金属锰片悬浮液催化氧化法[4]、还原法[5]、焙烧法[6]和锰盐水热氧化法[7]等。目前在工业上制备 Mn3O4的方法广泛使用电解金属锰片悬浮液催化氧化法[8],主要是通过电解金属锰片得到锰粉,将其分散在铵盐溶液中制成悬浮溶液后在一定的温度和pH条件下进行催化氧化可得到Mn3O4。虽然该工艺的条件成熟,但缺点明显,主要体现为产品中铁、硒、硫等杂质含量高,产品的球形度不够等,难以制备高端锰酸锂产品。焙烧法[9]通过高温焙烧锰的氧化物、硫酸盐、碳酸盐等分解得到Mn3O4,但产品中Ca、Mg等杂质含量高,且有SOx尾气产生,环境风险高、能耗大。还原法[9]则通过 MnO2、Mn2O3焙烧的过程中加通入氢气、一氧化碳、甲烷等还原性气体进行固相转换生成Mn3O4,但该法成本较高,仅限实验室研究,难于实现产业化,且存在着一定的安全隐患。锰盐水热氧化法[10]则是直接以氧化锰矿或碳酸锰矿为原料直接制备纯净的硫酸锰溶液制备Mn3O4,此过程不需电解,操作简单,能耗少,但硫酸锰溶液除杂成本高,水热法工艺设备控制复杂,因此没有实现产业化。在陈南雄等[11]研究中利用了氨缓冲体系制备碳酸锰焙烧后得到高纯、高密度的四氧化三锰。该法制备的四氧化三锰结合了传统重结晶工艺,在减少药品剂量的基础上,通过氨化沉淀去除钙镁钾钠,效果显著。邹兴等[12]利用硫酸锰在氨性条件下制备四氧化三锰,在温度为30℃,pH为10.4的条件下,Mn2+的沉淀率仅有87.3%;而本研究制备的四氧化三锰的Mn2+的沉淀率可达99.78%,有效提高Mn2+的利用率。
本研究以软锰矿还原焙烧得到MnO,将MnO加酸浸出制备 MnSO4溶液,在氨缓冲体系下,探究不同氨锰溶液比例、溶液滴加速率以及空气流量等参数直接控制球型Mn3O4晶体的生长。通过优化制备条件,得到符合且杂质含量极低的类球型Mn3O4,即满足YB/T4736-2019《锂电池用四氧化三锰》标准中Mn含量高于70%,S含量低于0.05%,振实密度高于2.0 g/cm3,中位粒径D50在2.0~25.0 μm[13]。本研究利用了 X-射线粉末衍射仪、扫描电子显微镜、粒度分析仪、振实密度仪等对 Mn3O4样品进行表征。利用本法制备的四氧化三锰具有生产成本低廉、耗能低、效率高、生产节能环保、水的利用做到体系完全内循环使用等优点,在未来实现产业化具有重大的指导意义。
1 实验
1.1 仪器和药品
仪器:超纯水制造系统(UPTA-20,上海力辰邦西仪器科技有限公司),数显恒温磁力加热搅拌器(HJ-4A,常州市金坛晨阳电子仪器厂),自动加液反应釜(20 L,FCH-20,威海环宇化工机械有限公司),蠕动泵(BT100-2J,保定格兰恒流泵有限公司),电热恒温鼓风干燥(101-1BS,上海力辰邦西仪器科技有限公司),无油空气压缩机(OTS-550,台州市奥突斯工贸有限公司)。本研究的关键设备是自动加液反应釜,其合成反应及沉淀结晶都在自动加液反应釜中进行。
药品:软锰矿(国外某矿山进口),硫酸(95%~98%,成都市科隆化学品有限公司,分析纯),氨水(25%~28%,重庆川东化工有限公司,分析纯),超纯水(自制)。
1.2 实验方法
配液:配置不同浓度的MnSO4和氨水溶液。
合成反应:向容积为20 L的反应釜中加入纯净水3.7 L作为底液(纯水液面刚好没过搅拌叶轮),缓慢开启搅拌至转速达到500 r/min,开始加热至体系温度达到60℃。打开空气压缩机向反应釜中通入空气(10 L/min),利用两台蠕动泵将配置好的硫酸锰溶液和氨水溶液导入反应釜中,分别控制硫酸锰溶液和氨水溶液的进料速度为3.7 mL/min和5.5 mL/min(20 h完成加料),反应pH持续在8.5~9之间。
沉淀结晶:加料完成后继续搅拌8 h,充分将Mn2+氧化生成Mn3O4晶体。Mn3O4晶核在运动中吸附新生晶核及微晶形成Mn3O4粒子沉入底部。
陈化:将有沉淀的溶液静置,使沉淀中的分子等有规律的紧密排列,同时使沉淀聚沉,颗粒变大,陈化时间为2 h。
洗涤过滤:将陈化后的沉淀过滤,按沉淀和纯净水的比例为1∶3进行混合洗涤,在温度60℃的环境下搅拌漂洗2 h后过滤出固体沉淀。
干燥:干燥温度105℃,时间3 h。
筛选:用微波振动筛进行筛选。
检测:对样品进行XRD、中位粒度D50、振实密度TD以及扫描电镜SEM的表征。
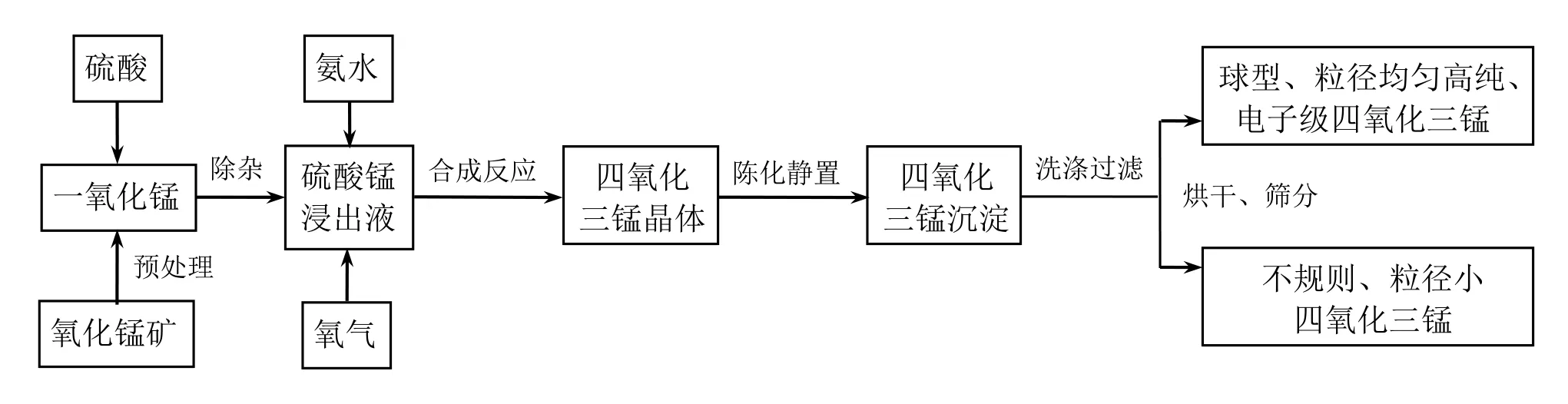
图1 反应工艺流程图
1.3 分析方法
表征方法:粉体振实密度仪(FT-100A,山东恒美电子科技有限公司),电感耦合等离子发射光谱(ICAP7000, Thermo Fisher, China),扫描电子显微镜(SEM, EVO18, ZEISS),X-射线粉末衍射仪(X-ray diffraction XRD, D8 advance, bruker, Germany),激光粒度分析仪(Marvin, MS2000, Malvern Instruments),比表面积及孔径分布分析(BET, MASAP2460, Micromeritics, America)。
2 结果与讨论
2.1 条件实验的结果
考察了不同的氨锰溶液比例、溶液滴加速率、空气流量、反应温度、pH、反应时间等条件对产品Mn3O4的锰含量、振实密度、中位粒度和纯度的影响[14],从而确定制备Mn含量高、振实密度大、颗粒均匀的球型Mn3O4的最优条件。根据不同的实验条件对其进行编号为1、2、3、4、5、6、7、8、9,具体的Mn3O4数据分析如表1所示。
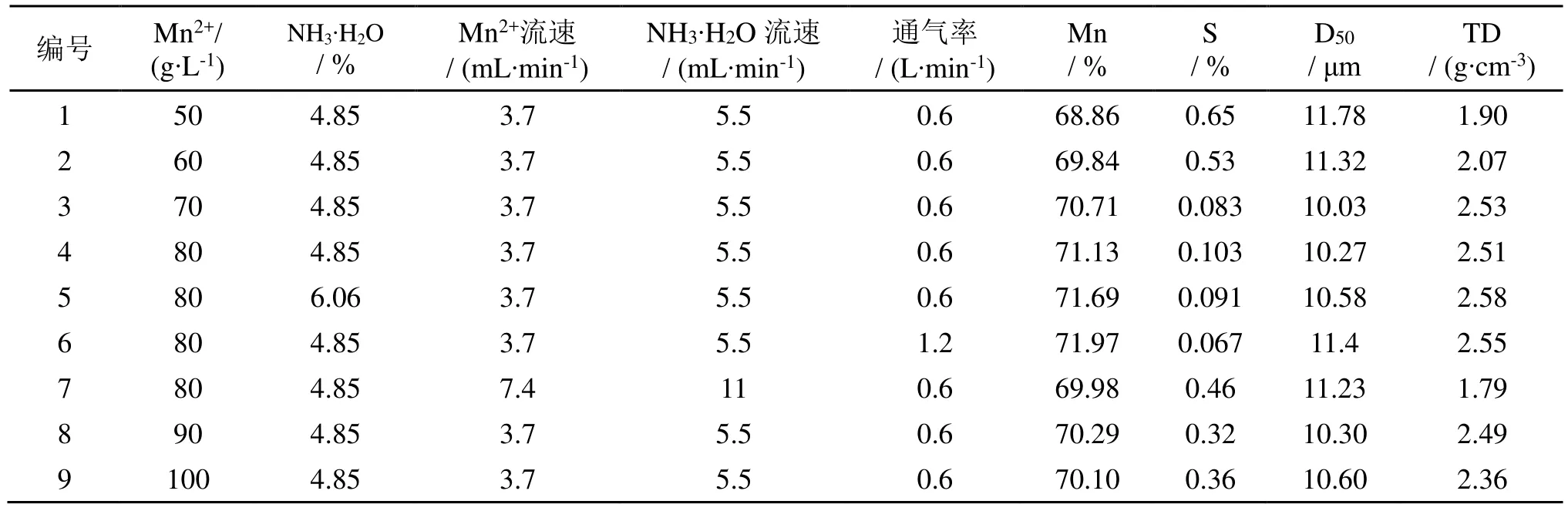
表1 不同反应条件制备的Mn3O4的数据
2.1.1 不同比例的氨锰溶液对制备Mn3O4的影响
由表1可知,在相同的反应温度、pH和反应时间下,随着Mn2+浓度的增加(50~100 g/L),得到的Mn3O4样品中Mn含量增加,S含量降低,其振实密度也越大,中位粒度范围落在10.30~11.78 μm之间。根据化学热力学平衡的原理,当反应物 MnSO4的初始浓度增大,平衡正向移动,氧化速率加快,生成的Mn3O4越多;当初始MnSO4浓度继续增加到90、100 g/L时,所得沉淀中带有SO42-也越多则越难洗涤,得到的Mn3O4产品含S量越大,Mn得含量就有所下降。这是因为在碱性的条件下,初始Mn2+浓度过大时,Mn2+容易发生水解或络合反应,生成相应的Mn(OH)2或Mn2(OH)2SO4[15],氧化程度不够,不利于Mn3O4沉淀析出。由图2可知,Mn3O4产品的振实密度与MnSO4的初始浓度相关;当浓度从50 g/L升高到70 g/L时,振实密度也从1.90 g/cm3增大到2.53 g/cm3;继续增大Mn2+浓度到100 g/L,Mn3O4产品的振实密度均达到1.85 g/cm3以上。因此,制备Mn含量高于71%,S含量低于0.15%,振实密度大于2.5 g/cm3,中位粒度在8~13 μm之间的电子级Mn3O4产品,工业生产的初始MnSO4浓度应控制在80 g/L,氨水的含量控制在4.85%~6.06%之间。所以,本研究中4、5、6号Mn3O4产品更适合应用于锂电池正极材料的生产。
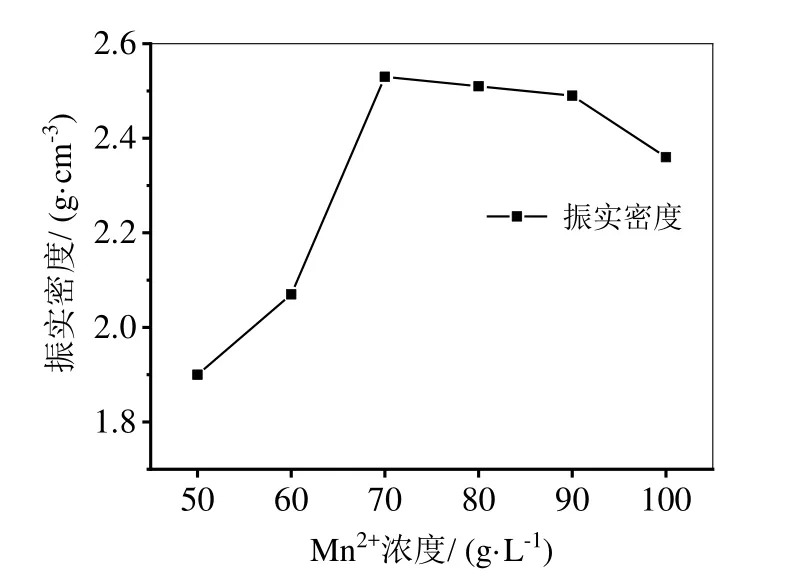
图2 Mn2+初始浓度与振实密度的关系
2.1.3 氨锰溶液流速对制备Mn3O4的影响
对比表1中实验4号、7号数据可知,在相同的反应环境、反应时间、pH和反应浓度,将氨锰溶液的滴加速度增加到原来的2倍,所得7号Mn3O4产品的Mn含量低于71%,S含量高于0.15%,振实密度低于2.5 g/cm3。这是由于氨锰溶液的滴加速度过快,体系中Mn2+和氨水的浓度过高,在溶液中单位体积内形成Mn3O4晶核过快,得不到充分氧化,致使Mn3O4晶体生长不均匀,容易团聚,且沉淀的Mn3O4颗粒内含有大量的SO42-[16]。可见,氨锰溶液的滴加速度过快制备的7号Mn3O4产品未能满足锂电池正极材料的要求。
2.1.4 空气流量对制备Mn3O4的影响
由表1中实验4号、6号数据可知,在相同的反应环境、反应时间、pH和反应浓度,将通气速度增加到原来的2倍,所得6号Mn3O4产品比4号的Mn含量升高,S含量下降。可见,当通气量增大时,空气中带入反应界面的氧气就越多,Mn(OH)2得到充分氧化,生成的Mn3O4产品纯度越高[17]。
2.2 Mn3O4产品分析
2.2.1 Mn3O4的XRD表征分析
将满足锂电池正极材料应用要求的4、5、6号Mn3O4产品进行XRD表征,所得图谱如图3。由图3可以看出,制备的Mn3O4产品对应上标准图谱(PDF#24-0734),且具有尖晶石结构,衍射峰明显,基线平稳,Mn3O4的结晶度高。对比三个产品发现,6号产品的XRD衍射峰明显强于4号和5号,可见在6号实验条件制备的Mn3O4产品纯度更高。
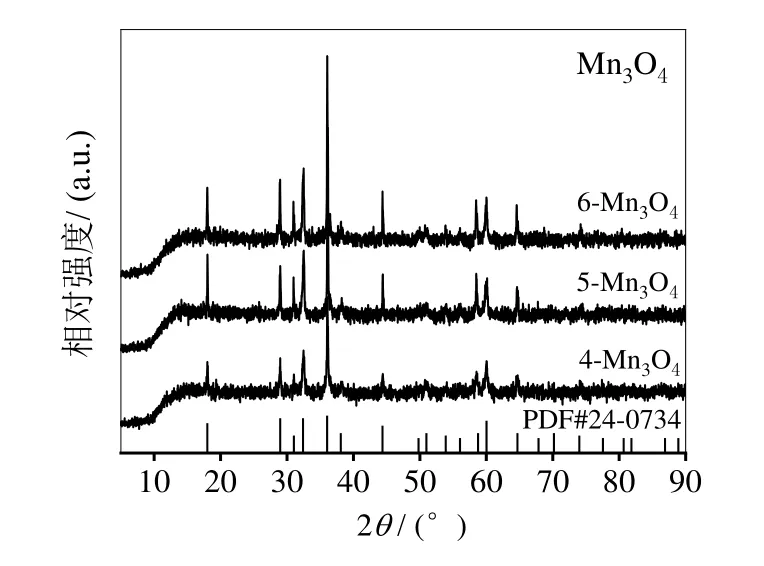
图3 不同条件下制备Mn3O4的XRD图谱
2.2.2 Mn3O4的SEM表征分析
将4、5、6号Mn3O4产品进行SEM表征,有图4可知所得的三个产品具有类球形形貌,形貌规整,其比表面积大小分别为4<5<6(5.10 m2/g<5.80 m2/g<6.94 m2/g)。且对比三个产品可以发现,4号产品有一定的团聚现象,颗粒表面不规则,分散性较差;主要是Mn3O4颗粒生成的过程中受到范德华力的作用容易聚集在一起。而5号、6号产品呈现明显的球型,其表面均匀单一,形貌小,比表面积大。其中5号产品在氨水充足的情况下,pH值稳定,溶液中Mn2+得到充分沉淀,形貌规整;6号产品在氧气充足的条件下(通空气),带入反应界面的氧气就越多,溶液中Mn2+得到充分氧化,生成的Mn3O4颗粒团聚少,能均匀分散沉淀。可见,在80 g/L的Mn2+溶液中,适当地提高氨水的浓度或增大通氧量能有效减少Mn3O4颗粒的团聚现象,且生成Mn3O4表面更光滑、颗粒更均匀单一。

图4 不同条件下制备Mn3O4的SEM
图5 氨缓冲体系制备的Mn3O4产品
2.3 合成机理探究
一般工艺上直接利用锰系高价氧化物的固相焙烧分解得到Mn3O4。该法虽简单,但要较好的控制锰氧比、温度、电位等条件,且能耗较大。本研究利用氨缓冲体系条件下制备 Mn3O4过程简便,产品均匀,Mn含量高于71%,S含量低于0.15%,振实密度高于2.5 g/cm3,符合锂二次电池正极材料用四氧化三锰的要求[12],即Mn含量高于70.5%,S含量低于0.15%,振实密度高于1.85 g/cm3。在反应体系中匀速地滴加MnSO4溶液和氨水溶液,使得Mn2+和氨水在碱性条件下形成Mn2(OH)2SO4缓冲体系和Mn(OH)2,通入空气充分将其氧化可得到Mn3O4产品,原理图如5所示。
3 结论
1)在反应温度位60℃、反应时间为30 h、pH在8.5~9之间,氨水的浓度固定为4.85%时,溶液中Mn2+的浓度增大能有效提高Mn3O4产品中Mn含量,降低S含量,Mn2+的沉淀率达99.78%以上。
2)在反应温度位60℃、反应时间为30 h、pH在8.5~9之间,Mn2+的浓度固定是80 g/L时,氨水的浓度在4.85%~6.06%,硫酸锰滴加速度3.7 mL/min,氨水滴加速度为5.5 mL/min,空气流量为0.6~1.2 L/min,搅拌速度500 r/min条件下,得到的Mn3O4产品Mn含量高于71%,S含量低于0.15%,中位粒度在10.03~10.58 μm,振实密度高于2.5 g/cm3,且Mn2+的沉淀率达99.90%以上。

