磷酯酰肌醇3-激酶/蛋白激酶B信号通路介导葛根素改善缺氧复氧损伤的作用及机制
杨学攀,朱明明,余曦,贺稳,陈晗,施洪飞
急性心肌梗死(AMI)已成为危害人类生命的重要疾病之一[1-2]。黄丽等[3]研究表明,在我国AMI发病率为45/10 万~55/10 万,而急性期死亡率高达30%。经皮冠状动脉介入治疗(PCI)是治疗AMI 主要方法之一[4],但在有效救助的同时对已受损的心肌细胞会造成二次损伤,称为心肌缺血再灌注损伤(MIRI)[5]。因此,如何避免MIRI 是目前亟待解决的问题。
MIRI 的病理机制复杂,防治方式多样,但均有一定缺陷[6-7]。MIRI 在中医领域内属于“胸痹”的范畴,其病位在心,与肝、脾、肾相关,属本虚标实、虚实夹杂之证[8]。气血阴阳的亏虚、痰浊、血瘀等阻滞于心脉是MIRI 的主要发病机制。现代人生活节奏快、工作压力大、饮食不节及缺乏锻炼,头晕、失眠、五心烦热成为大多数人具有的症状,是阴液亏虚导致。肾为水脏,主阴,肾阴不足,久则及心,心阴虚损,可引起胸阳失运,心阳不足,进而导致心脉痹阻,发为胸痹。在治疗上应以养阴为主,兼以活血化淤或通络止痛[9]。因此,滋阴是治疗MIRI的重要方法。中药葛根,具有解肌退热、透疹、生津止渴等功效[10]。研究表明[11],其有效成分葛根素可保护血管内皮细胞,并促进血管软化和降低动脉粥样硬化,但其潜在机制需进一步研究。本课题组在前期已明确缺氧复氧模型对人脐静脉内皮细胞EA.hy926 增殖的显著抑制作用[12],本研究旨在探讨葛根素对缺氧复氧后EA.hy926 细胞凋亡的影响,同时探究磷酯酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路在EA.hy926 细胞凋亡中的调节机制,为葛根对MIRI 的临床治疗提供科学依据。
1 材料与方法
1.1 细胞与仪器
CO2细胞培养箱(日本三洋公司,型号HERAcell);酶标仪(美 国Thermo Scientific,型号Synergy2);实时荧光定量PCR 仪、垂直电泳仪、凝胶成像系统(美国Bio-rad 公司,型号7500、125-BR、ChemiDocTMRS+);台式离心机(德国Eppendorf,型号5415C);倒置荧光显微镜、倒置光学显微镜(日本尼康公司,型号IX-70、CK40)。
1.2 药物与试剂
葛根素(南京迈博生物科技有限公司);PI3K抑制剂LY294002(南京迅贝生物科技有限公司);DMEM 培养基(江苏凯基生物技术股份有限公司);Gibco 胎牛血清(南京金益柏生物科技有限公司);逆转录试剂盒、扩增试剂盒(南京诺唯赞生物科技有限公司);Hoechest 染色试剂盒(南京良纬生物科技有限公司);抗人Bax 抗体(美国Cell Signaling Technology 公司);活化天冬氨酸蛋白水解酶-9(cleaved caspase-9)、活化天冬氨酸蛋白水解酶-3(cleaved caspase-3)、B 细胞淋巴瘤/白血病-2(Bcl-2)抗体(中国proteintech 公司);β 肌动蛋白(β-actin)抗体(上海碧云天生物技术有限公司);蛋白激酶B(Akt)、磷酸化的蛋白激酶B(p-Akt)抗体(Affinity 公司);二抗:山羊抗兔(中国proteintech 公司)、山羊抗鼠(中国博奥森公司)。
1.3 细胞培养
EA.hy926 细胞(购自中国科学院上海细胞库)培养在含10%胎牛血清,不完全高糖的DMEM 培养基中,条件设置为5%CO2,37℃,隔天换液1 次,取对数期细胞进行实验。
缺氧实验时,将培养液替换为磷酸盐缓冲液(PBS),放入94%N2、5%CO2、1%O2的缺氧培养箱中,缺氧12 h 后,将PBS 替换为培养液,在5% CO2、37℃培养箱中复氧8 h。
在使用葛根素或LY294002 预处理时,待细胞生长至80%,加入葛根素、LY294002,24 h 后弃去培养液加入等量PBS 进行缺氧12 h 处理,缺氧结束后将PBS 替换为培养液复氧8 h。
1.4 噻唑蓝法检测细胞活力
将对数期细胞种于96 孔板中,治疗组使用葛根素预处理,其预处理浓度分别为0 mol/L、10-7mol/L、10-6mol/L、10-5mol/L、10-4mol/L,24 h 后将模型组及治疗组培养液替换为PBS 并放入缺氧培养箱中,对照组换液后维持原条件培养。12 h 后,将模型组PBS 替换为培养基,复氧8 h,对照组换液后继续维持原条件培养。培养结束后全部组别各加10 μl 噻唑蓝,4 h 后弃去培养液加二甲基亚砜(DMSO)200 μl,于490 nm、10 min、间隔震荡条件下测量吸光度(A)值。公式为所有组别与对照组平均值的比值×100%。
1.5 Hoechest 实验
将清洗后的盖玻片置于培养皿内并加入细胞混悬液,分为对照组、缺氧复氧组、缺氧复氧+葛根素组(葛根素组)、缺氧复氧+葛根素+LY294002处理组(葛根素+抑制剂组),每组均设3 个复孔。待培养结束后吸尽培养液,加入0.5 ml 固定液至盖玻片上,10 min 后 PBS 清洗2 次,随后加入0.5 ml Hoechest33258 染料以覆盖盖玻片[12],5 min 后PBS清洗2 次,抗荧光淬灭剂封片,并迅速置于荧光显微镜下检测。
1.6 蛋白免疫印迹法(Western blot)
培养细胞,分组同上,培养结束后取出细胞,提取蛋白,BCA 法测蛋白浓度[13],上样,设置电泳条件为105 V,15 min,结束后转膜,条件设置为15 V、10 min。转膜结束后,牛奶封闭1 h,随后一抗(1:1 000)封闭过夜,洗涤后二抗(1:10 000)孵育1 h,曝光,保存条带。
1.7 实时荧光定量PCR
培养细胞,分组同上,培养结束后取出细胞,Trizol 提取RNA,蛋白核酸测定仪检测RNA 浓度。使用逆转录试剂盒进行逆转录,反应体系为50℃,15 min;85℃,2 min。按实时荧光定量PCR 试剂盒说明书配置反应体系:预变性过程:95℃,30 s;扩增过程:95℃,10 s;60℃,30 s,共40 个循环;延伸过程95℃,15 s;60℃,60 s;95℃,15 s。引物Bcl-2:上游5'-GTGGGGTC -ATGTGTGTGGAGAG-3',下游5'-CAGAGACAGCCAGGAGAAATCAA-3';caspase-3:上游5'-GTAGAAGTCTAACTGGAAAACCCAA-3',下游5'-CATGTCATCATCAACACCACTGTCT-3';以β-actin 为内参:上游 5'-CTACCTCATGAAGAT -CCTCACCGA-3',下游5'-TTCTCCTTAATGTCACGCACGATT-3'。最终结果采用2-ΔΔCT进行数据分析。
1.8 统计学方法
实验所得数据以GraphPad Prism 6 统计软件处理分析,数据均以表示。两组数据用t检验分析,多组数据用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度葛根素对EA.hy926 细胞活力的影响(图1)
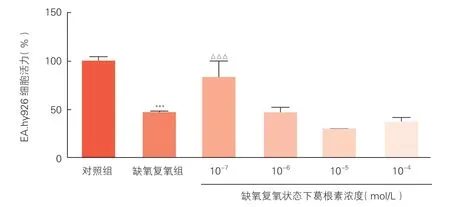
图1 噻唑蓝法比较不同浓度葛根素对EA.hy926 细胞活力的影响(n=3,)
噻唑蓝法检测结果显示,与缺氧复氧组比较,葛根素10-7mol/L 预处理细胞可明显提高缺氧复氧后EA.hy926 细胞活力(P<0.001),其余组别EA.hy926 细胞活力均降低且差异无统计学意义(P均>0.05)。
2.2 葛根素预处理对EA.hy926 细胞缺氧复氧后细胞凋亡的影响(图2A、2B)
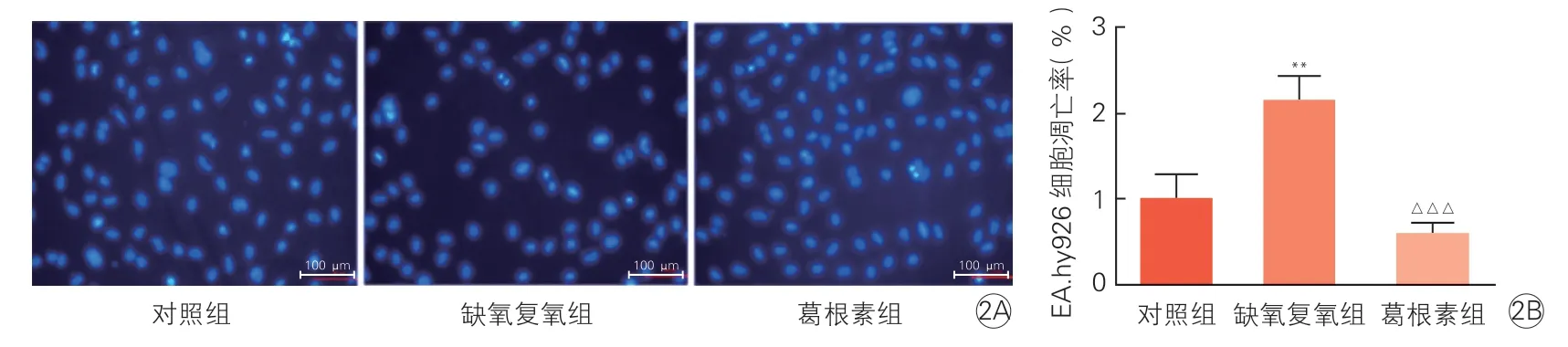
图2 Hoechest 染色检测葛根素预处理对EA.hy926 细胞缺氧复氧后凋亡的影响(n=3,)
Hoechest 染色中,与缺氧复氧组比,葛根素组中EA.hy926 细胞核深染形态明显减少,细胞调亡率明显下降(P<0.001)。
2.3 葛根素预处理对EA.hy926 细胞缺氧复氧后凋亡相关基因表达的影响
Western blot 结果示,与缺氧复氧组相比,葛根素组促凋亡蛋白Bax、cleaved caspase-9、cleaved caspase-3表达水平明显下调,抗凋亡蛋白Bcl-2 表达水平明显上调(P均<0.01,图3A、3B)。实时荧光定量PCR 结果示,与缺氧复氧组相比,葛根素组降低了天冬氨酸蛋白水解酶-3(caspase-3)mRNA 表达(P<0.01),增加了Bcl-2 mRNA 表达(P<0.001),见图4A、4B。

图3 蛋白免疫印迹法分析葛根素预处理对EA.hy926 细胞缺氧复氧后凋亡相关蛋白水平的影响(n=3,)
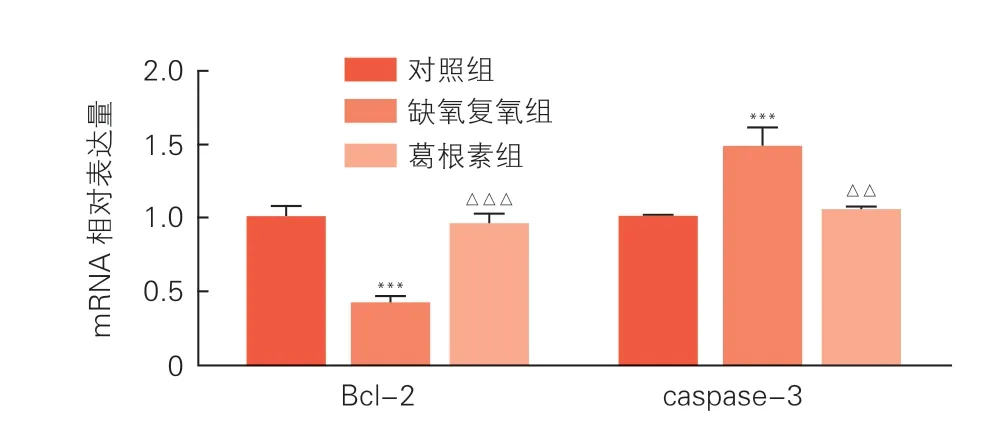
图4 实时荧光定量PCR分析葛根素预处理对EA.hy926 细胞缺氧复氧后caspase-3 和Bcl-2 mRNA 表达的影响(n=3,)
2.4 LY294002 对EA.hy926 细胞凋亡率的影响
噻唑蓝法检测结果显示与对照组相比,LY294002 浓度为10 μmol/L 时EA.hy926 细胞活力无明显变化,LY294002 浓度为15 μmol/L、20 μmol/L时EA.hy926 细胞活力均明显下降(P<0.001),因此10 μmol/L 可作为LY294002 干预EA.hy926 细胞的浓度(图5)。
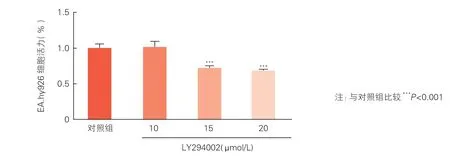
图5 噻唑蓝法比较不同浓度LY294002 对EA.hy926 细胞活力的影响(n=3,)
将细胞分为四组,分别为对照组、缺氧复氧组、葛根素组、葛根素+抑制剂组进行Hoechest 染色法检测,结果显示,与对照组相比,缺氧复氧组EA.hy926 细胞凋亡率明显上升(P<0.05)。与缺氧复氧组相比,葛根素组EA.hy926 细胞凋亡率下降(P<0.01)。与葛根素组相比,葛根素+抑制剂组EA.hy926 细胞凋亡率上升(P<0.01)。(图6A、6B)
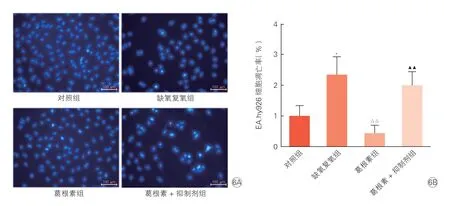
图6 Hoechest 染色法检测LY294002 对EA.hy926 细胞凋亡的影响(n=3,)
2.5 葛根素对p-Akt、Akt 蛋白水平的影响(图7A、7B)
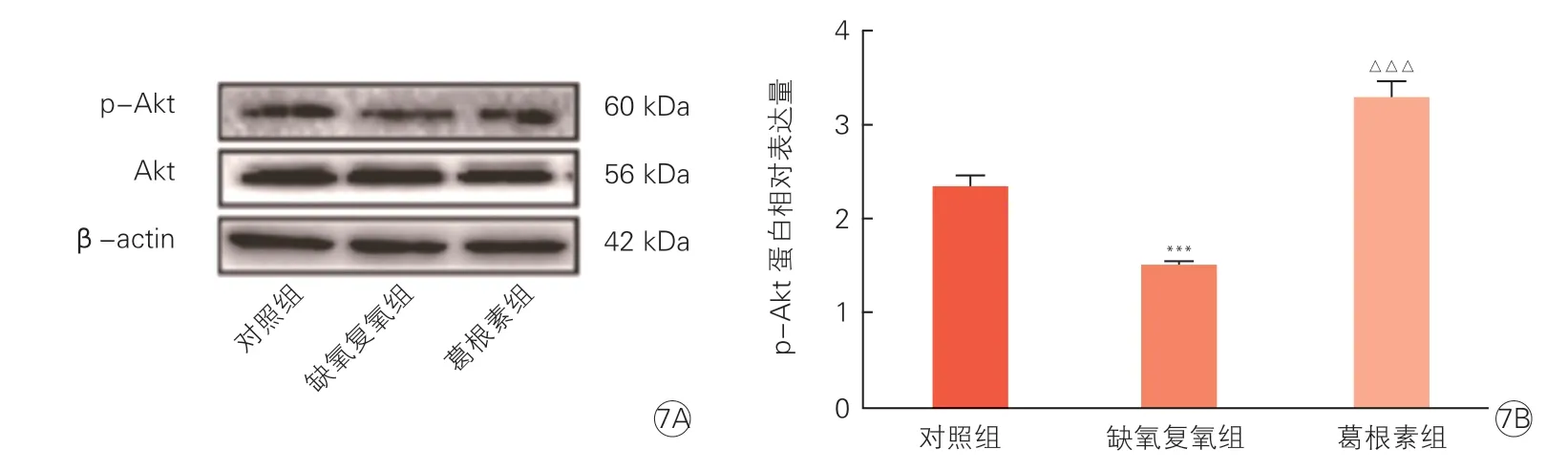
图7 蛋白免疫印迹法分析葛根素预处理后EA.hy926 细胞对p-Akt、Akt 蛋白水平的影响(n=3,)
Western blot 检测结果显示,与缺氧复氧组相比,葛根素组上调了p-Akt 蛋白的表达水平(P<0.001)。
2.6 LY294002 对葛根素激活的p-Akt、Akt 蛋白水平以及凋亡蛋白的影响
Western blot 结果显示,与葛根素组相比,葛根素+抑制剂组p-Akt 蛋白表达水平明显下降(P<0.001,图8A、8B);抗凋亡蛋白Bcl-2 表达水平下降(P<0.001),cleaved caspase-3、cleaved caspase-9、Bax的表达水平上升(P<0.01,P<0.01,P<0.001),见图9A、9B。
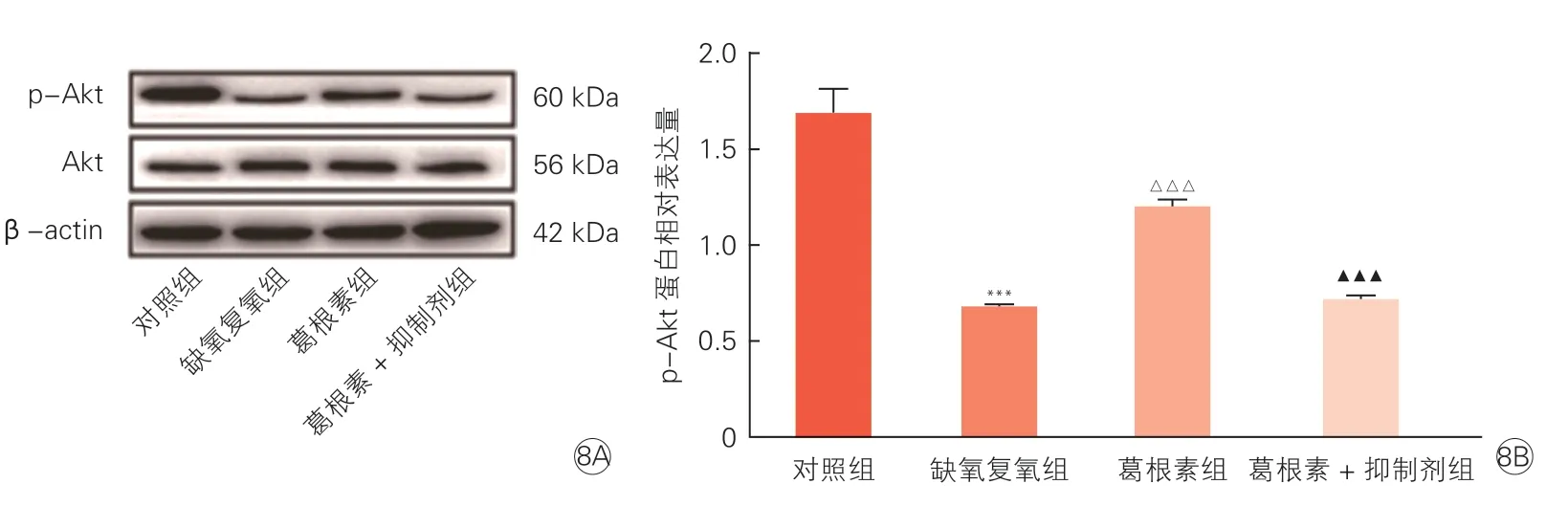
图8 蛋白免疫印迹法分析LY294002 对EA.hy926 细胞p-Akt、Akt 蛋白水平的影响(n=3,)

图9 蛋白免疫印迹法分析LY294002 对EA.hy926 细胞凋亡相关蛋白水平的影响(n=3,)
3 讨论
血管内皮细胞是血液和心肌细胞间的屏障,具有分泌血管活性物质和维持内环境稳定等作用[14]。心肌缺血时会导致肿瘤坏死因子-α(TNF-α)的自分泌上调,并作用于血管内皮细胞,通过各种途径诱发细胞凋亡[15]。而当MIRI 发生时,内皮细胞比心肌细胞更早受到损伤[16]。因此,如何在MIRI发病过程中最大限度保护血管内皮细胞已成为目前研究的重要问题。原代人脐静脉内皮细胞和EA.hy926 细胞是研究血管内皮功能常用的细胞株,由于EA.hy926 细胞具有一定程度的原代人脐静脉内皮细胞的生物特性,且具有较强的增殖能力,在体外实验研究中适用于复杂的、创伤较大的细胞实验[17],因此本研究采用EA.hy926 细胞进行实验。本研究通过噻唑蓝法检测发现缺氧复氧会导致细胞活力降低,且Hoechest 实验结果表明缺氧复氧组细胞核深染状态明显增多,使用葛根素预处理后,细胞核深染状态明显较少,初步表明缺氧复氧诱导细胞凋亡而葛根素对细胞凋亡具有抑制作用。
细胞凋亡是MIRI 发病的重要机理之一[18]。研究发现,缺血再灌注的大鼠中细胞凋亡显著[19-20]。caspase 家族蛋白与Bcl-2 家族蛋白跟细胞凋亡密切相关。Bcl-2 是其家族蛋白中最主要的抗凋亡蛋白,Bax 是最早发现的促凋亡蛋白。正常细胞中Bax 主要存在于细胞质中,当其受到凋亡刺激后转位到线粒体上,造成细胞色素C 释放[21]。当细胞凋亡信号传递至线粒体时,第二信使如Bcl-2被激活,使线粒体释放出细胞色素C 与凋亡蛋白酶激活因子1(Apaf-1)和caspase-9 形成复合体,caspases-9 由此激活,并继续激活下游效应因子caspase-3、caspase-6、caspase-7,使细胞进入凋亡[22]。caspase-3 是最为关键的细胞凋亡执行者,它在细胞凋亡的过程中具有关键作用[23-25],它的活化是凋亡进入不可逆阶段的标志。本研究通过Western blot、实时荧光定量PCR 检测发现在EA.hy926 细胞缺氧12 h、复氧8 h 后,Bax、cleaved caspase-3、cleaved caspase-9 mRNA 及蛋白表达水平明显升高,Bcl-2 mRNA 及蛋白表达水平明显降低。而经葛根素预处理后Bax、cleaved caspase-3、cleaved caspase-9 mRNA 及蛋白表达水平明显降低,Bcl-2 mRNA 及蛋白表达水平明显升高。这表明葛根素可通过抑制相关凋亡mRNA 及蛋白表达从而抑制缺氧复氧损伤导致的内皮细胞凋亡。
PI3K/Akt信号通路是一条经典的凋亡通路,具有调节细胞生长、代谢、凋亡等多种生物学作用,是治疗冠心病、肿瘤、代谢紊乱等多种疾病的重要靶点[26]。PI3K 是生长因子信号转导过程中的重要分子。酪氨酸激酶受体、非酪氨酸激酶受体、胰岛素受体等胞外信号可激活PI3K。Akt 在细胞生长、增殖、与凋亡过程中均发挥了关键作用,是PI3K信号通路中一个重要的下游靶点,PI3K 的活化促使第二信使磷脂酰-3,4,5-三磷酸的形成从而进一步促进Akt 的Thr308 和Ser473 位点磷酸化,这导致Akt 部分或完全激活,活化的Akt 通过抑制凋亡信号蛋白的磷酸化或通过调节转录因子的活性来调节细胞凋亡[27]。在本研究中Western blot 结果显示,葛根素预处理细胞后,p-Akt 表达水平上调,且加入PI3K抑制剂LY294002 后,p-Akt 表达水平下调,且促凋亡蛋白Bax、cleaved caspase-3、cleaved caspase-9表达水平明显上调,抗凋亡蛋白Bcl-2 的表达水平显著下降,这表明PI3K/Akt 通路介导葛根素抑制缺氧复氧诱导的EA.hy926 细胞凋亡。
综上所述,葛根素预处理对缺氧复氧诱导的EA.hy926 凋亡具有明显的改善作用,且其作用由PI3K/Akt信号通路介导。这为中医治疗MIRI 找到了新的途径,葛根素也有望成为中药治疗MIRI 的药物靶点。
利益冲突:所有作者均声明不存在利益冲突

