IGF-1、TNF-α、NF-κB p65亚基预测胫骨平台骨折术后愈合延迟的价值
徐向阳 孙军平 李云朋 王鹏 朱琳 刘汝银★
骨折愈合延迟是骨科常见的并发症,不仅会影响手术效果,还会降低患者的生活质量[1]。因此,对骨折术后愈合延迟的情况进行评估及干预,是改善患者预后的关键。既往研究认为,骨折后愈合依赖于骨细胞的正常分化与增殖,而各种细胞因子、炎性因子和调节因子在这一过程中发挥重要作用[2-3]。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是胰岛素同源多肽,具有促进成骨细胞增殖分化的作用;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平变化可在一定程度上影响骨折愈合;核转录因子κB(nuclear transcription factor-κB,NF-κB)可在TNF-α 的刺激下活化,影响关节软骨的正常生长[4-5]。当前,有关胫骨平台骨折术后愈合延迟的研究多集中在影响因素评估方面,有关IGF-1、TNF-α 和NF-κB 水平是否可预测骨折愈合延迟的发生尚不清楚。本研究将探究血清IGF-1、TNF-α 和NF-κB p65 亚基在胫骨平台骨折术后延迟愈合患者中的表达水平,并分析其对骨折愈合延迟的预测价值。
1 资料与方法
1.1 一般资料
选取2019年8月至2020年8月本院骨科收治的178 例胫骨平台骨折患者,纳入标准:①患者均诊断为胫骨平台骨折,且均为首次骨折;②骨折后3 d 内于本院接受骨折固定术治疗;③患者性别不限,年龄≥18 岁;④患者知情研究内容,均签署知情同意书。排除标准:①多发性骨折、病理性骨折患者;②合并颅脑损伤、股代谢疾病或骨肿瘤患者;③近期存在内分泌治疗史患者;④存在重要脏器功能障碍患者。根据术后骨折愈合情况将患者分为延迟愈合组(n=34)和正常愈合组(n=144),骨折延迟愈合标准为:骨折损伤后9 个月内,至少3个月没有任何愈合进展;临床存在骨折断端疼痛、活动异常、肢体功能障碍等症状;影像学检查显示骨痂极少生长或完全不生长,断端骨质硬化,出现分离或假关节形成[6]。本研究经医院伦理委员会批准,两组患者的一般临床资料比较差异无统计学意义(P>0.05)。见表1。
表1 两组患者一般临床资料比较[(n(%),(±s)]Table 1 Comparison of general clinical data between the two groups[(n(%),(±s)]
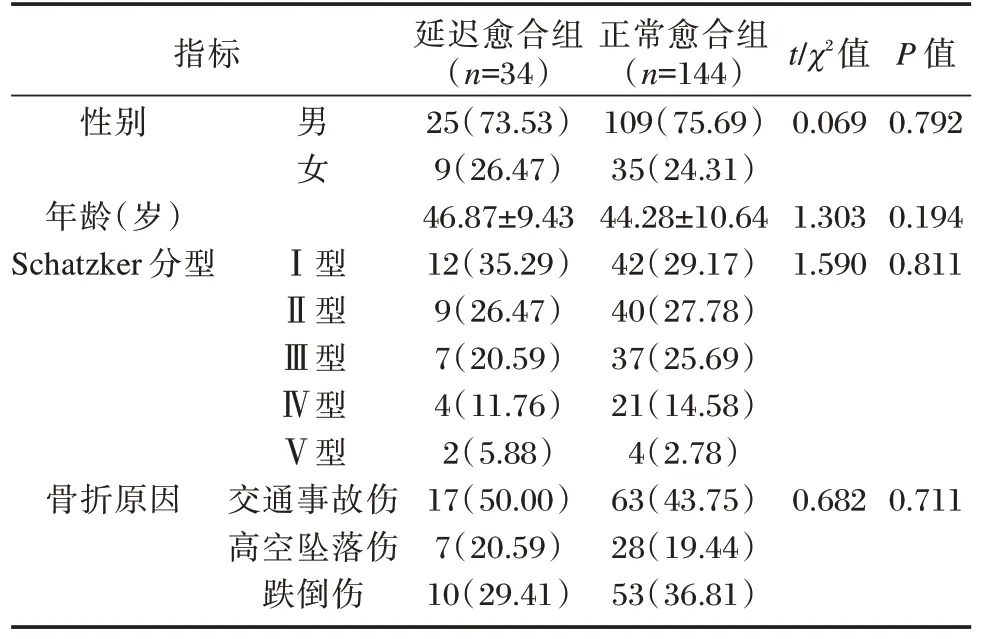
表1 两组患者一般临床资料比较[(n(%),(±s)]Table 1 Comparison of general clinical data between the two groups[(n(%),(±s)]
指标性别年龄(岁)Schatzker 分型骨折原因男女 Ⅰ型Ⅱ型Ⅲ型Ⅳ型Ⅴ型交通事故伤高空坠落伤跌倒伤延迟愈合组(n=34)25(73.53)9(26.47)46.87±9.43 12(35.29)9(26.47)7(20.59)4(11.76)2(5.88)17(50.00)7(20.59)10(29.41)正常愈合组(n=144)109(75.69)35(24.31)44.28±10.64 42(29.17)40(27.78)37(25.69)21(14.58)4(2.78)63(43.75)28(19.44)53(36.81)t/χ2值0.069 1.303 1.590 0.6820.711 P 值0.792 0.194 0.811
1.2 研究方法
所有患者均接受膝关节镜辅助下切开复位内固定术治疗,术后行常规护理康复训练。分别于术前、术后1、4、8 和12 周取患者空腹肘静脉血5 mL,3 500 r/min 离心10 min 后分离血清,低温下保藏待测。①IGF-1、TNF-α 检测:采用酶联免疫吸附法检测IGF-1、TNF-α 水平,试剂盒由上海澜瑞科技有限公司提供,严格按照操作步骤进行。②NF-κB p65 亚基检测:采用蛋白质免疫印迹法检测全血中NF-κB p65 亚基水平,采用GDS-8000 凝胶成像系统(美国UVP 公司)观察NF-κB p65 亚基表达情况,记录灰度值,内参为β 肌动蛋白。
1.3 统计学处理
采用SPSS 20.0 统计软件对数据进行分析。计量资料以()表示,组间比较行独立样本t检验,组内不同时间点比较行重复测量资料的方差分析;计数资料以n(%)表示,行χ2检验,受试者工作特征曲线(ROC)分析IGF-1、TNF-α 和NF-κB p65亚基预测胫骨平台骨折术后愈合延迟的诊断价值;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者不同时间点血清IGF-1 水平比较
两组患者的血清IGF-1 水平随着时间的延长,呈先升高后下降的趋势(P<0.05)。术后4、8 和12周,延迟愈合组患者的血清IGF-1 水平明显低于正常愈合组,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者不同时间点血清IGF-1 水平比较(±s,ng/mL)Table 2 Comparison of serum IGF-1 levels at different time points between 2 groups(±s,ng/mL)

表2 两组患者不同时间点血清IGF-1 水平比较(±s,ng/mL)Table 2 Comparison of serum IGF-1 levels at different time points between 2 groups(±s,ng/mL)
组别延迟愈合组正常愈合组t 值P 值n 34 144术前117.45±13.71 121.84±15.63 1.506 0.134术后1 周222.78±14.51 229.31±20.18 1.780 0.077术后4 周321.84±20.63 329.76±19.65 2.094 0.038术后8 周361.57±21.77 419.73±25.19 12.407<0.001术后12 周342.57±22.76 403.62±19.84 15.680<0.001 F 值898.473 453.567 P 值<0.001<0.001
2.2 两组患者不同时间点血清TNF-α 水平比较
随着时间的延长,延迟愈合组患者的血清TNF-α 水平呈先升高后下降的趋势,正常愈合组患者血清TNF-α 水平逐渐下降(P<0.05)。术后1、4、8 和12 周,延迟愈合组患者的血清TNF-α 水平明显高于正常愈合组,差异均有统计学意义(P<0.05)。见表3。
表3 两组患者不同时间点血清TNF-α 水平比较(±s,ng/L)Table 3 Comparison of serum TNF- α levels at different time points between the two groups(±s,ng/L)

表3 两组患者不同时间点血清TNF-α 水平比较(±s,ng/L)Table 3 Comparison of serum TNF- α levels at different time points between the two groups(±s,ng/L)
组别延迟愈合组正常愈合组t 值P 值n 34 144术前87.64±19.28 91.56±17.33 1.161 0.247术后1 周94.06±20.65 84.71±19.28 2.509 0.013术后4 周128.65±20.31 81.63±18.22 13.237<0.001术后8 周98.97±19.62 74.61±16.57 7.435<0.001术后12 周77.91±17.25 65.28±13.51 4.637<0.001 F 值32.895 49.676 P 值<0.001<0.001
2.3 两组患者不同时间点NF-κB p65 亚基表达水平比较
随着时间的延长,延迟愈合组患者的NF-κB p65 亚基表达水平呈先升高后下降的趋势,正常愈合组患者NF-κB p65 亚基表达水平逐渐下降(P<0.05);术后1、4、8 和12 周,延迟愈合组患者的NFκB p65 亚基表达水平明显高于正常愈合组,差异均有统计学意义(P<0.05)。见表4。
表4 两组患者不同时间点NF-κB p65 亚基表达水平比较(±s,ng/L)Table 4 Comparison of the expression levels of NF- κB p65 subunit at different time points between the two groups(±s,ng/L)
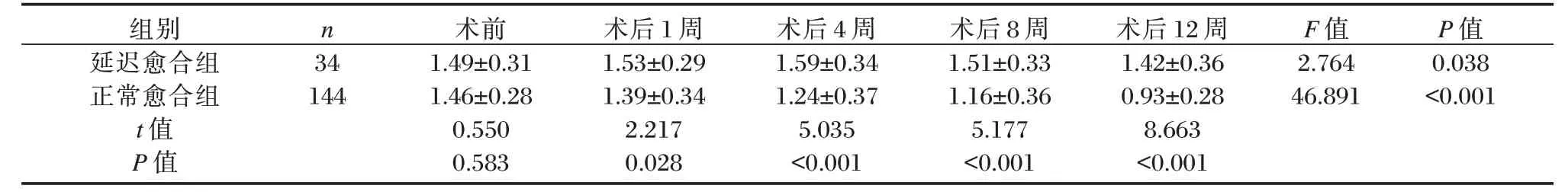
表4 两组患者不同时间点NF-κB p65 亚基表达水平比较(±s,ng/L)Table 4 Comparison of the expression levels of NF- κB p65 subunit at different time points between the two groups(±s,ng/L)
组别延迟愈合组正常愈合组t 值P 值n 34 144术前1.49±0.31 1.46±0.28 0.550 0.583术后1 周1.53±0.29 1.39±0.34 2.217 0.028术后4 周1.59±0.34 1.24±0.37 5.035<0.001术后8 周1.51±0.33 1.16±0.36 5.177<0.001术后12 周1.42±0.36 0.93±0.28 8.663<0.001 F 值2.764 46.891 P 值0.038<0.001
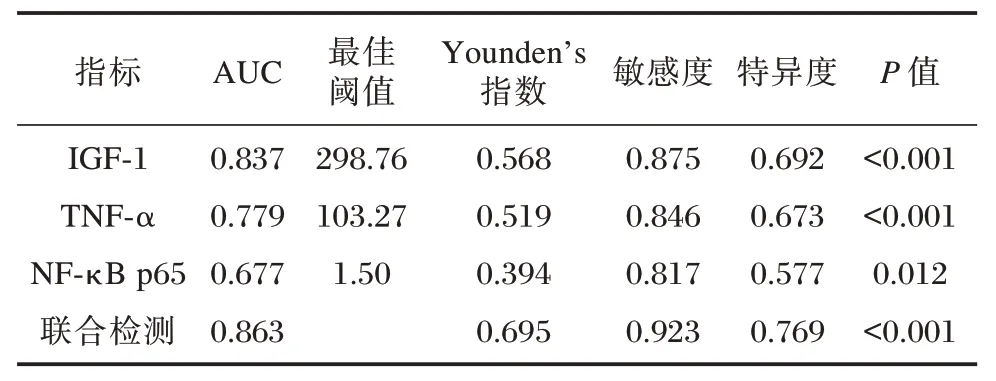
表4 ROC 曲线分析价值Table 4 ROC Curve
2.4 IGF-1、TNF-α、NF-κB p65 亚基及其联合检测对胫骨平台骨折术后愈合延迟的预测价值分析
ROC 曲线分析结果显示,术后8 周血清IGF-1、TNF-α 和NF-κB p65 亚基联合检测预测术后愈合延迟的敏感度和特异度分别为92.30%、76.90%,AUC 值为0.863,明显高于IGF-1、TNF-α 和NF-κB p65 亚基单个指标检测(Z=2.251、2.378、4.157,P=0.036、0.021、0.008)、见表5、图1。

图1 ROC 曲线分析Figure 1 ROC curve
3 讨论
骨折愈合是一个复杂的创伤修复过程,主要包括血肿形成期、炎症反应期、骨痂形成期和骨痂改建期,多种生物因子参与了这一过程。IGF-1 和TNF-α 主要在炎症反应期被大量释放,这两种因子可调节骨髓间充质干细胞的活性,调控其向成骨细胞转化[7-8]。NF-κB 可介导炎症和免疫反应,其家族成员p65 参与NF-κB 通路的激活[9]。探究骨折愈合延迟过程中各种生物因子的水平变化,有助于了解其发生发展机制,可为临床骨折术后愈合延迟的防治提供参考依据[10]。
本研究结果显示,术后4、8 和12 周,延迟愈合组的血清IGF-1 水平低于正常愈合组,提示IGF-1水平过低可能影响骨折的愈合。IGF-1 是成骨细胞增殖分化的关键细胞因子,一方面可通过调控生长激素水平,增强成骨细胞活性;另一方面可抑制胶原酶表达水平,促使线性骨生长,使骨矿物质密度增加,从而加速骨折愈合[11]。有研究发现,IGF-1 在严重骨缺损大鼠血清中水平较低,在骨折部位注射IGF-1 可降低骨吸收水平,增强对骨折愈合的刺激[12]。TNF-α 是临床常见的炎症因子,其水平变化与骨折区炎性损伤关系密切[13]。本研究发现,术后1、4、8 和12 周,延迟愈合组的血清TNF-α 水平高于正常愈合组,提示骨折延迟愈合患者的骨折区存在一定的炎性损伤,从而影响术后骨折的愈合。这可能与TNF-α 抑制骨髓间充质干细胞向成骨细胞转化、诱导成骨细胞凋亡、促进破骨细胞增殖分化等因素有关。徐向勇等[14]发现,TNF-α 在延迟愈合骨折患者中随时间波动明显,是导致骨折愈合时间延长的重要因素之一。本研究发现,术后1、4、8 和12 周,延迟愈合组的NF-κB p65 亚基表达水平高于正常愈合组,提示NF-κB p65 可能参与了骨折愈后延迟的过程。分析其原因可能是:NF-κB 可高效诱导TNF-α等炎性因子编码基因的表达,趋化大量炎性细胞浸润并聚集在炎症部位,加重炎症反应,最终影响骨折愈合[15]。本研究还发现,IGF-1、TNF-α 和NF-κB p65 联合检测的AUC 值最大,提示三者可作为预测胫骨平台骨折术后愈合延迟的良好指标。因此,临床可通过监测患者血清IGF-1、TNF-α 和NF-κB p65 表达水平,预测骨折延迟的发生,同时采取积极的干预措施以促进患者康复。
综上所述,血清IGF-1、TNF-α 和NF-κB p65亚基的表达水平与胫骨平台骨折术后愈合延迟密切相关,随着时间延长,呈先升高后下降的趋势,IGF-1、TNF-α 和NF-κB p65 亚基水平检测在胫骨平台骨折术后愈合延迟的预测方面具有较高诊断价值,联合检测可提高诊断准确性。

