碳酸锰矿中二价锰的测定探讨
覃敏贵,黄 慧,陈宏强,黄彩霞,潘洪泳
(南方锰业集团有限责任公司 大新锰矿分公司,广西 大新 532315)
碳酸锰矿目前在国内大多是用来生产电解金属锰。其流程是将碳酸锰矿加工成锰粉,然后与硫酸充分溶解形成硫酸锰溶液,通电插入阴阳极板,在阴极板上产生电解锰片。可见,Mn2+是电解锰生产中化合制液的重要参考依据,是衡量碳酸锰矿石价值的重要指标。
在参考了文献[1-11]的基础上,建立了一套快速分析碳酸锰矿中二价锰含量的方法。对影响检测结果因素的具体分析后,确定了高氯酸浸取剂的浓度、用量、浸取温度和时间,使之达到检测的最佳效果,同时科学合理利用高氯酸浸取后的余酸作为后续检测用的氧化剂,简化了检测流程,提高了检测效率。
1 试验部分
1.1 主要仪器
恒温水浴锅、分析天平、常用玻璃器皿。
1.2 主要试剂
1)5%高氯酸溶液,移取50 mL高氯酸于1 000 mL的烧杯中,加水至1 000 mL,搅拌均匀。
2)硫酸亚铁铵标准溶液,c(NH4)2Fe(SO4)2·6H2O≈0.040 mol/L,称取78.4 g硫酸亚铁铵于5 000 mL烧杯中,加入4 750 mL水,在不断搅拌下,缓慢加入250 mL浓硫酸。
3)重铬酸钾标准溶液c(1/6K2Cr207)=0.040 0 mol/L。
预处理:将基准重铬酸钾在150 ℃烘箱烘干2 h,并在干燥器中冷却至室温。
配制:称取1.961 5 g上述基准重铬酸钾溶液,置于250 mL烧杯中,加约200 mL水,低温加热至全部溶解,冷却后移入1 000 mL容量瓶中,用水稀释至刻度,混匀。
4)N-苯代邻位氨基苯甲酸指示剂(0.2%),依次称取0.2 g无水碳酸钠和0.2 g N-苯代邻位氨基苯甲酸于150 mL烧杯中,加少量水,低温加热5 min,冷却后移入100 mL容量瓶中,加水至刻度,摇匀。
5)磷酸、硫酸、硝酸、高氯酸均为分析纯试剂,试验用水为蒸馏水。
1.3 硫酸亚铁铵标准溶液的标定
准确移取25.00 mL重铬酸钾标准溶液于250 mL锥形瓶中,依次加入40 mL水、40 mL硫酸溶液(5%)、5 mL磷酸,用硫酸亚铁铵标准溶液滴定至橙黄色消失后,滴加2滴N-苯代邻位氨基苯甲酸指示剂,继续滴定至溶液刚呈绿色为终点。硫酸亚铁铵标准溶液对二价锰的滴定度按下式(1)计算:
(1)
式(1)中:T为硫酸亚铁铵标准溶液对二价锰的滴定度,g/mL;c为重铬酸钾标准溶液的浓度,mol/L;25.00为移取重铬酸钾标准溶液的体积,mL;54.94为锰的摩尔质量,g/mol;V为滴定消耗硫酸亚铁铵标准溶液的体积,mL;V0为滴定空白时消耗硫酸亚铁铵标准溶液的体积,mL。
1.4 空白值的测定
准确移取10.00 mL重铬酸钾标准溶液于250 mL锥形瓶中,按1.3步骤滴定到终点,记录体积V1。再移取10.00 mL重铬酸钾标准溶液于上述锥形瓶中,再用硫酸亚铁铵标准溶液滴定至终点,记录体积V2,两次滴定消耗硫酸亚铁铵标准溶液的体积之差(V1-V2)即为空白值V0。
1.5 试验方法
称取0.100 0 g干燥试样于50 mL烧杯中,加入25 mL 5%的高氯酸溶液,置于75 ℃的水浴锅中加热浸取30 min(每隔5 min搅拌1次) ,取下冷却,过滤于300 mL高型锥形瓶中,用洗瓶冲洗烧杯、滤纸各5次。将上述滤液在电热板上加热浓缩至约15 mL,加入20 mL磷酸和5 mL硝酸,置于高温电炉上加热氧化样品,不断摇动,至瓶底无小气泡、液面平静后取下,待锥形瓶中的溶液冷却至70 ℃左右,加50 mL水,边加边摇,使盐类完全溶解,流水冷却至室温。用硫酸亚铁铵标准溶液滴定至浅红色,加入3滴N-苯代邻位氨基苯甲酸,继续滴定至亮黄色即为终点,记录V,随同试样进行空白试验,滴定时按1.4步骤进行,但不加硫酸和磷酸。二价锰含量(质量分数)按下式(2)计算:
(2)
式(2)中:w为二价锰含量(质量分数),%;T为硫酸亚铁铵标准溶液相当于二价锰的滴定度,g/mL;V为硫酸亚铁铵标准溶液消耗的体积,mL;V0为空白消耗硫酸亚铁铵标准溶液的体积,mL;m为称样质量,g。
2 结果与讨论
2.1 试样粒度的影响
碳酸锰矿试样的粒度能直接影响其在高氯酸溶液中的溶解速度。样品反应速度随试样颗粒大小而有所不同。粒度越细,溶解速度越快。试样的过粉碎也会增加保留其他价态锰矿物的溶解而造成测定误差,因此一般制样时,应少磨多筛,防止试样过粉碎,试验表明,适合于碳酸锰矿中二价锰分析的试样粒度要求为:小于或等于0.074 mm。
2.2 固液比及高氯酸溶液浓度的影响
试样与溶液的质量比,一般称为固液比。在浸取过程中,碳酸锰矿粉的溶解行为与固液比有关。当固液比大,浸取溶液的黏度大,极大地影响碳酸锰矿试样在溶液中的扩散速度。因此在锰矿石二价锰分析中要求固液比要小。
高氯酸浓度对碳酸锰矿物的浸取过程也有很大的影响,高氯酸的浓度增大,碳酸锰矿石的溶解程度和溶解速度亦增大。但是,在碳酸锰矿石中二价锰的分析中,为了有效地使二价锰溶解,而其他价态锰不融入对结果的影响,因此对溶剂浓度的要求是比较严格的。
加高氯酸的作用,一是作为溶剂溶解样品,二是溶解样品后的余酸作为氧化剂将二价锰在高温及磷酸介质中定量氧化成三价锰。计算可以得知浸取一定量碳酸锰试样所必需的大致浓度和用量。试验表明,用5%高氯酸溶液25 mL,能够使0.1 g碳酸锰试样中的二价锰完全溶解,满足二价锰的检测要求。
2.3 水浴温度及时间的影响
一般水浴温度越高,二价锰浸出速度越快,有时因提高水浴温度引起碳酸锰矿试样中的其他高价锰也随之溶解,难溶化合物的生成以及溶剂因挥发而失效等现象,使测定结果偏离。刘万昌[9]认为:为克服有机质和高价锰共存时对碳酸锰的干扰,浸取温度应尽可能低,以碳酸锰能完全浸取为限。
二价锰的浸出率与水浴时间有很大关系,一般水浴时间增长,可使二价锰反应更完全。碳酸锰试样的水浴初始阶段的浸出速度较大,随着试样中二价锰的不断溶出,高氯酸的浓度随之下降,溶出幅度明显减少,而高氯酸进一步和试样中的其他物质反应,增加了其他干扰元素。
综上所述,用25 mL 5%高氯酸溶液于不同的水浴温度条件和不同的浸取时间进行试验,结果表明水浴温度在70~90 ℃、浸取时间在25~50 min对碳酸锰矿试样浸取效果最佳。试验选择水浴温度为75 ℃,浸取时间为30 min。
2.4 搅拌间隔时间的影响
在水浴过程中,搅拌可以强化高氯酸溶液与试样表面之间的传热与反应,加速二价锰的浸出,如果试样静置时间过长,则在试样表面与高氯酸溶剂之间的界面上形成一层饱和溶液,影响试样的溶解速度。如果不断搅拌溶液,则试样颗粒表面的饱和层就被破坏,也就使溶液的浓度保持均匀状态,使试样溶解速度加快。因此,浸取碳酸锰矿试样时应使高氯酸溶液的浓度保持均匀状态,使试样溶解速度加快,搅拌间隔时间要适宜,否则会给操作带来麻烦,经过大量的试验结果表明,搅拌间隔时间5 min为宜。
2.5 氧化过程的影响
所用的氧化剂是25 mL 5%高氯酸溶剂溶解样品后的余酸。高氯酸是高沸点酸,在滤液加热浓缩减少溶剂的过程中,高氯酸的量不变。需注意的是加热浓缩时切勿蒸干,否则有溶质析出或锥形瓶破裂,导致试验失败。在将滤液加热浓缩至约15 mL时,加入磷酸和硝酸继续加热氧化样品。同时,采用300 mL高型锥形瓶盛装滤液,避免在加热浓缩过程中溶液溅出瓶外,影响检测结果。
加热可以使高氯酸的氧化能力增强,反应速度加快,但温度太高则容易生成焦磷酸盐,影响检测结果。高氯酸氧化二价锰最佳的温度为220 ℃~240 ℃,温度太低则氧化不完全。试验中观察到,当加热至开始冒高氯酸泡,此时温度已经达到220 ℃,从开始冒高氯酸泡至无小气泡、液面平静需要3~4 min,因此,为了控制好氧化温度,在冒高氯酸泡的时候,要严格控制好电热板的温度,以能维持冒高氯酸泡为宜,直至瓶底无小气泡、液面平静后取下。
2.6 精密度检验
选用国家标准物质GBW07265样品(Mn2+为22.46%)、GBW07266样品(Mn2+为15.69%)、内部质控样碳酸锰1号样品(Mn2+为16.88%),依据分析步骤,每一个样品进行9次平行测定,计算标准偏差和相对标准偏差,见表1。
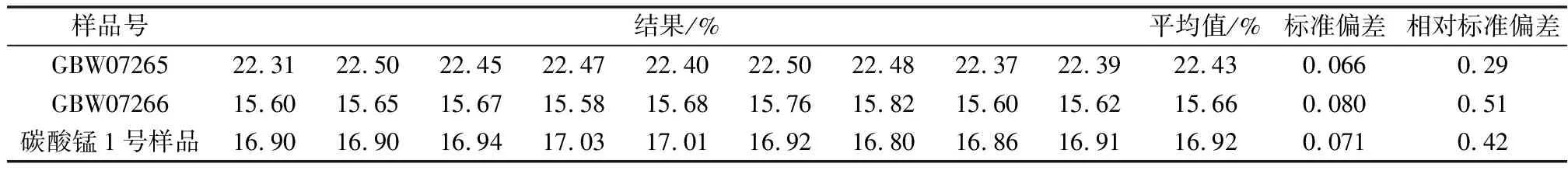
表1 精密度试验结果
由表1可见,对同一样品多次测定值的标准偏差和相对标准偏差都较小,有较好的重现性和精密度。
2.7 准确度试验
称取0.100 0 g内部质控样碳酸锰1号样品(Mn2+为16.88%),分别加入GBW07265样品(Mn2+为22.46%)0.020 0,0.040 0,0.050 0,0.060 0,0.070 0 g,计算得出加标量分别为4.49,8.98,11.23,13.48,15.72 mg,回收率结果见表2。加标回收试验的结果表明,该方法能获得很好的回收率,从而进一步确认了分析方法的准确性。
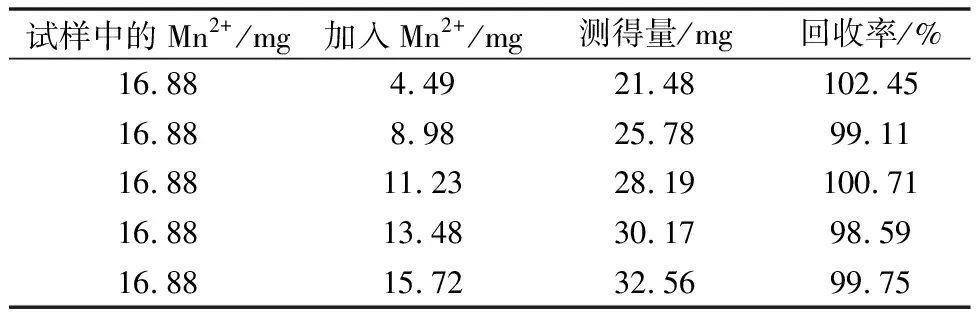
表2 加标回收试验测定值及结果分析
由表2加标回收试验的结果表明,此法能获得很好的回收率,从而确认了分析方法的准确性。
3 结 语
通过试验介绍了碳酸锰矿中二价锰的快速分析方法,试验用25 mL 5%高氯酸在75 ℃水浴上浸取30 min,可使碳酸锰中二介锰浸取完全,而余酸(高氯酸)可使二价锰在高温及磷酸介质中定量氧化成三价锰,用硫酸亚铁铵还原滴定求得二价锰的含量。方法简便易掌握,方法的精密度和准确度良好,可以满足样品分析要求。

