右美托咪定通过抑制TLR4/NF-κB信号通路促进佐剂性膝骨关节炎大鼠成纤维细胞样滑膜细胞凋亡*
邢丹丹, 康文越, 王志华, 王 颖, 李 娜, 吴多志, 林 慧
(海南省人民医院,海南海口570311)
膝骨关节炎(knee osteoarthritis,KOA)表现为关节软骨损伤、滑膜炎症和滑膜增生,是骨关节炎中常见类型[1]。成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLS)作为KOA中参与发病机制的主要细胞,可参与滑膜血管形成、炎症等过程[2],特别是其出现的肿瘤样特征,包括过度增殖和凋亡不足导致滑膜组织异常增生现象[3],因此促进FLS凋亡成为KOA的潜在治疗方法。右美托咪定(dexmedetomi⁃dine,DEX)作为α2受体激动药物,具有调控肿瘤细胞增殖和凋亡作用[4],研究发现在KOA中DEX能够抑制软骨细胞凋亡,进而缓解疾病[5],但在FLS中尚未发现相关研究。Toll样受体4(Toll-like receptor 4,TLR4)/核因子κB(nuclear factor-κB,NF-κB)通路在KOA中发挥重要作用,不仅可介导促炎症因子和基质金属蛋白酶等影响疾病状态[6],而且对细胞凋亡和细胞外基质代谢具有重要调控作用[7],推测TLR4/NF-κB信号通路可能与DEX调控FLS凋亡机制存在一定关系。因此,本研究采用弗氏完全佐剂(Freund's complete adjuvant,FCA)建立KOA大鼠模型,探究DEX对FLS凋亡的影响,并探究其机制。
材料和方法
1 动物
SPF级健康SD大鼠,购自北京维通利华实验动物科技有限公司,合格证号为SCXK(京)-2016-0011,体重(200±10)g,6~8周龄。温度(24±1)℃、湿度(50±5)%、12 h光照/12 h黑暗、定期通风环境中自由饮水摄食。实验符合3R原则,本研究经本院伦理委员会审核并通过。
2 主要试剂
盐酸DEX注射液(江苏恒瑞医药股份有限公司,批准文号:国药准字H20090248,规格:2 mL;200µg);FCA(北京梅科万德生物科技有限公司,批号:201850231,规格:10 mL);TLR4激动剂脂多糖(lipo⁃polysaccharide,LPS;Invivogen,货号tlrl-b5lps);苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(上海生工生物技术公司,货号E607318);末端脱氧核苷酸转移酶介导的dUTP原位切口末端标记(terminal deoxy⁃nucleotidyl transferase-mediated dUTP nick-end la⁃beling,TUNEL)凋亡试剂盒(上海通善生物科技有限公司,货号Ts-E1001);抗血管细胞黏附分子1(vas⁃cular cell adhesion molecule-1,VCAM-1)、TLR4、NF-κB p65、caspase-3、活化的caspase-3(cleaved caspase-3)、核纤层蛋白B(lamin B)和GAPDH抗体(Abcam,货号分别为ab271899、ab13556、ab207297、ab184787、ab214430、ab16048和ab8245);Cell Counting Kit-8(CCK-8)检测试剂盒和annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物科技有限公司,货号分别为C0037和C1062S)。
3 主要方法
3.1 动物分组及处理 参考文献[8]建立KOA大鼠模型,大鼠备皮与消毒,剃须刀将大鼠右侧前、后膝关节及以下部位毛剃干净,75%乙醇对剃毛部位消毒,消毒完全后使用注射器将0.1 mL FCA注射液注射入膝关节内,分别在第1、3和7天各注射1次,每天强制大鼠活动1 h,7 d后大鼠膝关节出现红肿热痛、同时伴有肿胀现象,周围出现僵硬,膝关节活动受限则为模型建立成功。模型成功30只,随机分为模型组(model group)、DEX组(DEX group)、DEX+TLR4激活剂组(DEX+TLR4 activator group),每组10只。对照组(control group)10只大鼠将FCA注射液换为生理盐水,其余步骤相同。
DEX组鞘内注射100µL/kg DEX[9],DEX+TLR4激活剂组在DEX组基础上鞘内注射500µg/kg LPS,对照组、模型组相同部位注射等体积生理盐水,每天1次,连续28 d。
3.2 KOA严重程度的评估及膝关节直径的测量在建模前和建模后、给药后均评价关节炎严重程度情况。关节炎的严重程度分级[10]:无肿胀为0分;关节稍红肿为1分;关节轻度红、肿、热为2分;关节中度红、肿、热,出现轻度功能障碍为3分;关节重度红、肿、热,活动受限,不能负重为4分。单个膝关节评分在[0,4]分之间,本研究为2个膝关节评估总分(即KOA评估值)。建模前和建模后、给药后分别用游标卡尺检测大鼠膝关节直径。
3.3 HE染色观察大鼠膝关节滑膜组织的形态 收集各组大鼠膝关节滑膜组织,部分置于4%多聚甲醛中固定48 h,0.5 mol/L脱钙液EDTA(pH 8.0)脱钙12 h,经石蜡包埋后切片(厚度5µm),苏木精染色、伊红复染,中性树胶封片,显微镜下观察膝关节滑膜组织病理变化(包括病理变化和滑膜增生情况)。
3.4 TUNEL染色检测膝关节滑膜组织细胞的凋亡情况 使用TUNEL凋亡试剂盒检测膝关节滑膜组织中细胞凋亡情况。石蜡切片经脱蜡处理,蛋白酶K工作液37℃孵育30 min、DAB显色液显色,中性树胶封片,显微镜下观察、拍照。浓缩棕色DAB沉淀的细胞为TUNEL阳性细胞(即凋亡细胞)。随机选5个视野计数,凋亡指数(%)=TUNEL阳性细胞数/总细胞数×100%。
3.5 大鼠FLS的分离与培养 方法3.3中剩余部分膝关节滑膜组织立即剔除脂肪和纤维,手术剪剪成1 cm×1 cm×1 cm大小组织块,用无Ca2+、Mg2+的DHank’s液轻轻漂洗3次,滑膜组织块平铺在培养瓶中,置在37℃、5%CO2培养箱中贴壁培养2 h,添加含20%胎牛血清的DMEM培养液,继续放置在37℃、5%CO2培养箱中贴壁培养。每天观察,待组织边缘长出较多细胞后去除组织块继续培养,培养期间更换培养液,原代培养细胞成片时传代,待细胞传代3代时,光学显微镜观察细胞形态,并采用抗VCAM-1多克隆抗体鉴定培养细胞是否为FLS。
3.6 FLS的鉴定 细胞置6孔板中,95%的冷乙醇固定细胞30 min,滴加VCAM-1多克隆抗体37℃孵育30 min,滴加FITC标记的Ⅱ抗37℃孵育30 min,荧光显微镜观察细胞形态。
3.7 CCK-8法检测FLS活力 1×107/L FLS接种于96孔板上,每孔100µL,置于37℃、5%CO2培养箱中培养48 h,添加CCK-8试剂,继续培养2 h,酶标仪在450 nm处检测细胞的吸光度(A)值。存活率(%)=实验组(A)值/对照组(A)值×100%。
3.8 Annexin V-FITC细胞凋亡检测试剂盒检测FLS的凋亡情况 每组1×108/L FLS,经胰酶消化后500 r/min离心5 min收集细胞置于离心管中,加入400µL annexin V结合液悬浮细胞,再加入5µL annexin VFITC染色液4℃避光孵育15 min,加入10µL PI染色液4℃避光孵育5 min。流式细胞仪检测细胞凋亡情况。
3.9 Western blot检测FLS中TLR4、NF-κB p65、cas⁃pase-3和cleaved caspase-3蛋白水平 细胞浆和细胞核蛋白抽提试剂盒提取细胞浆蛋白和细胞核蛋白(检测NF-κBp65蛋白水平),其余细胞添加蛋白裂解液冰上裂解10 min,10 000 r/min离心10 min,上清为总蛋白(检测其余蛋白水平)。凝胶电泳分离蛋白、PVDF膜转膜,5%脱脂奶粉室温孵育2 h,分别添加对应抗TLR4、NF-κB p65、caspase-3、cleaved caspase-3、lamin B(细胞核蛋白内参照)和GAPDH(其余蛋白内参照)抗体,4℃孵育过夜;加入对应Ⅱ抗,室温孵育1 h。DAB显色试剂盒避光显色,蛋白凝胶成像仪(Tanon,型号:3500)拍照和定量分析。
4 统计学处理
GraphPad Prism 7.0软件对所有数据进行分析。计量数据均采用均数±标准差(mean±SD)表示。多组间比较行单因素方差分析,组间两两比较行SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 DEX对大鼠KOA的影响
建模前,各组KOA评估值和膝关节直径差异无统计学显著性(P>0.05)。建模后,与对照组相比,模型组、DEX组和DEX+TLR4激活剂组KOA评估值、膝关节直径升高(P<0.05)。给药后,与对照组相比,模型组、DEX+TLR4激活剂组KOA评估值和膝关节直径及DEX组KOA评估值升高(P<0.05);与模型组相比,DEX组KOA评估值和膝关节直径及DEX+TLR4激活剂组KOA评估值降低(P<0.05);与DEX组相比,DEX+TLR4激活剂组KOA评估值和膝关节直径升高(P<0.05)。见表1。
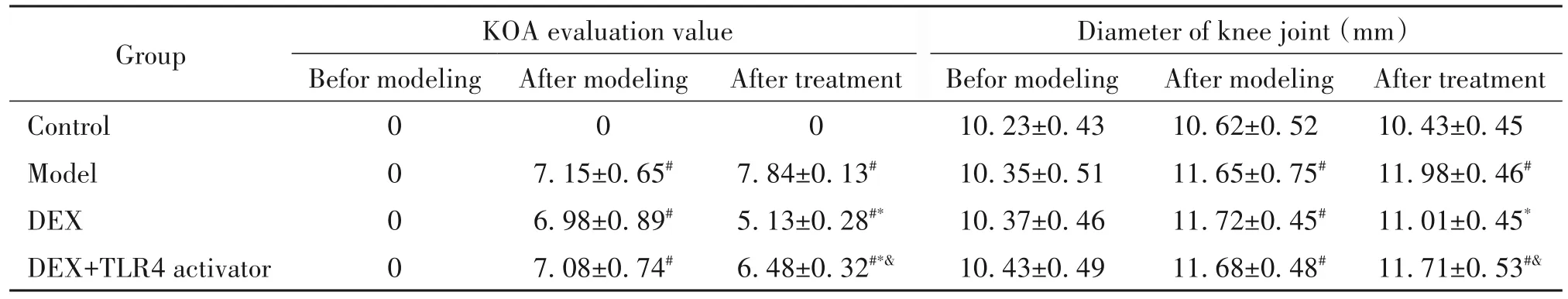
表1 4组大鼠KOA评估值和膝关节直径的比较Table 1.Comparison of KOA evaluation value and knee joint diameter in the 4 groups(Mean±SD.n=10)
2 DEX对大鼠膝关节滑膜组织形态的影响
对照组滑膜组织、滑膜内膜各层次完整,整齐排列;模型组出现大量炎症细胞浸润现象,纤维组织增生、滑膜细胞增生明显,各层次排列紊乱,滑膜组织周围出现较多毛细血管增生现象,呈重度滑膜炎现象;DEX组出现轻度炎症浸润现象,纤维组织、滑膜细胞存在部分增生,排列规则,滑膜组织周围出现微量毛细血管增生现象,呈轻度滑膜炎现象;DEX+TLR4激活剂组呈中度滑膜炎现象。见图1。

Figure 1.Histological changes of knee synovium in the 4 groups(HEstaining,×200).图1 4组大鼠膝关节滑膜组织形态
3 DEX对大鼠膝关节滑膜组织细胞凋亡的影响
分别与对照组和模型组相比,DEX组和DEX+TLR4激活剂组膝关节滑膜组织细胞凋亡指数升高(P<0.05);与DEX组相比,DEX+TLR4激活剂组膝关节滑膜组织细胞凋亡指数降低(P<0.05)。见图2、表2。
4 大鼠FLS的鉴定结果
各组细胞分离培养发现,细胞均呈纺锤形,与FLS形态基本一致。免疫荧光细胞化学分析显示,VCAM-1呈阳性表达,即培养细胞为FLS。见图3。

Figure 2.Apoptosis of synovial cells in the knee joint of rats in the 4 groups(TUNEL staining,×200).图2 4组大鼠膝关节滑膜组织细胞凋亡情况

Figure 3.The morphological changes of FLS(×100)and the expression of its marker protein VCAM-1(cytoimmunofluorescence staining,×200).图3 FLS的形态及标志蛋白VCAM-1的表达
5 DEX对FLS活力的影响
与对照组相比,模型组、DEX组和DEX+TLR4激活剂组FLS的活力升高(P<0.05);与模型组相比,DEX组和DEX+TLR4激活剂组FLS活力降低(P<0.05);与DEX组相比,DEX+TLR4激活剂组FLS活力升高(P<0.05)。见表2。
6 DEX对FLS凋亡的影响
分别与对照组和模型组相比,DEX组和DEX+TLR4激活剂组FLS的凋亡率升高(P<0.05);与DEX组相比,DEX+TLR4激活剂组FLS的凋亡率降低(P<0.05)。见图4、表2。

表2 4组大鼠膝关节滑膜组织细胞凋亡指数(TUNEL染色)、FLS活力和FLS凋亡率(流式细胞术)的比较Table 2.Comparisons of apoptotic index of synovial tissue cells in knee joint(by TUNEL staining),the viability of FLS,and the apoptotic index of FLS(by flow cytometry)in the 4 groups(%.Mean±SD.n=10)
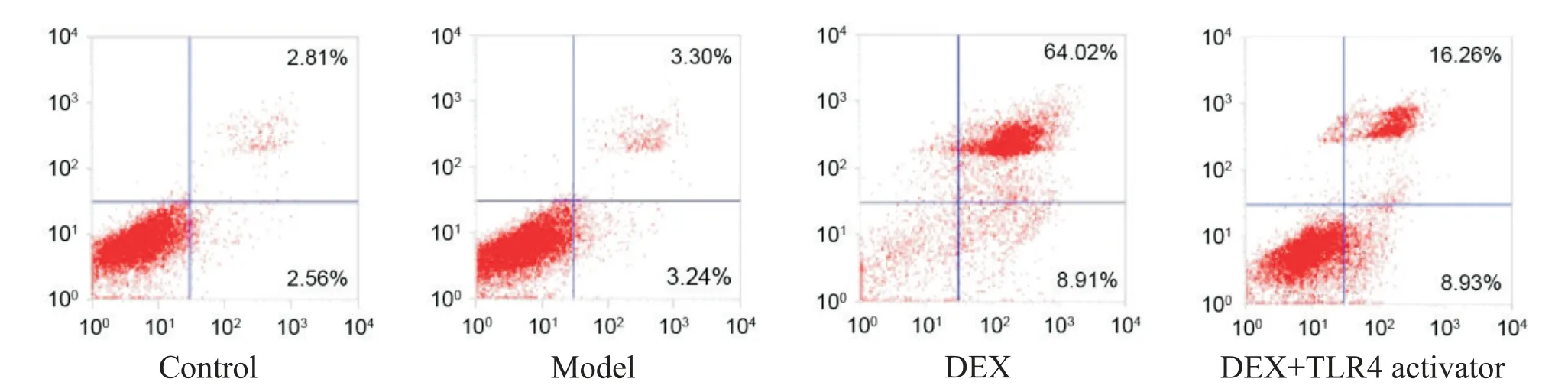
Figure 4.The representitive images of flow cytometry for analyzing the apoptosis of FLSin 4 groups.图4 4组FLS凋亡情况的流式细胞术图像
7 DEX对FLS中TLR4、NF-κB p65、caspase-3和cleaved caspase-3蛋白水平的影响
与对照组相比,DEX组、DEX+TLR4激活剂组FLS中TLR4、cleaved caspase-3/caspase-3及核内NF-κB p65蛋白水平,模型组FLS中TLR4和核内NF-κB p65蛋白水平升高(P<0.05),模型组、DEX组和DEX+TLR4激活剂组FLS中核外NF-κB p65蛋白水平降低(P<0.05);与模型组相比,DEX组和DEX+TLR4激活剂组FLS中TLR4和核内NF-κB p65蛋白水平降低(P<0.05),cleaved caspase-3/caspase-3和核外NF-κB p65蛋白水平升高(P<0.05);与DEX组相比,DEX+TLR4激活剂组FLS中TLR4和核内NF-κB p65蛋白水平升高(P<0.05),cleaved caspase-3/cas⁃pase-3和核外NF-κB p65蛋白水平降低(P<0.05)。见图5、表3。
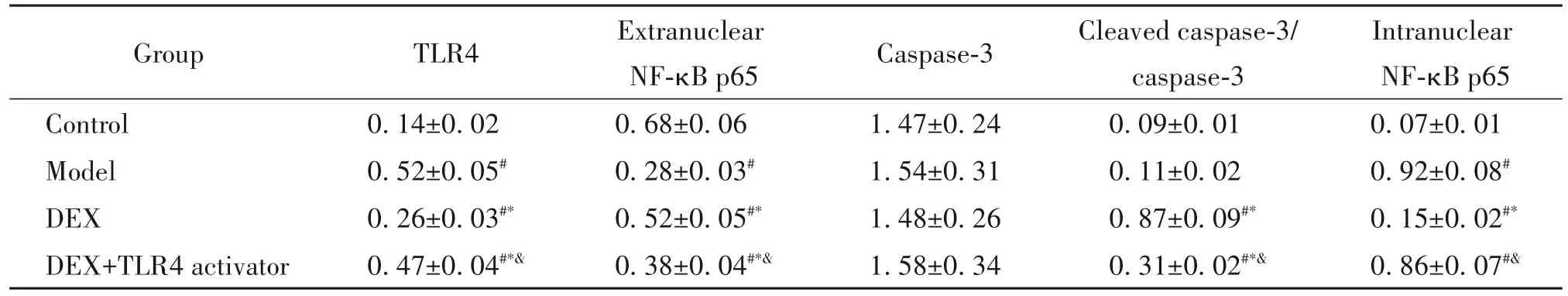
表3 4组FLS中TLR4、NF-4a p65、caspase-3和cleaved caspase-3蛋白水平的比较Table 3.Comparisons of TLR4,NF-κB p65,caspase-3 and cleaved caspase-3 protein levels in FLSof the 4 groups(Mean±SD.n=10)

Figure 5.The images of Western blot for determining the protein levels of TLR4,NF-κB p65,caspase-3 and cleaved caspase-3 in FLSof the 4 groups.图5 4组FLS中TLR4、NF-κB p65、caspase-3和cleaved caspase-3蛋白水平变化的比较
讨 论
KOA中FLS增殖过度、凋亡不足,滑膜组织增生,表现为FLS类肿瘤样会导致关节局部结构破坏[11]。诱导FLS凋亡能够降低滑膜组织的异常增生,实现对疾病的缓解。DEX在KOA治疗中常作为麻醉药物,用于缓解术后镇痛[12];随着研究深入,研究发现DEX能够影响细胞凋亡从而影响疾病,为DEX在KOA临床上的应用提供新的理论依据。在本研究中,KOA大鼠评估值升高、膝关节直径增加,膝关节肿胀明显,组织病理切片发现滑膜组织表现出炎症浸润明显、滑膜细胞增生现象明显,各层次紊乱严重,表现出重度滑膜炎现象,提示KOA中滑膜组织损伤严重。经DEX治疗后,KOA大鼠膝关节滑膜组织病理损伤减轻明显,仅出现轻度炎症浸润现象,纤维组织、滑膜细胞存在部分增生,提示DEX能够缓解滑膜细胞过度增生现象,实现对KOA大鼠的保护。进一步TUNEL染色发现DEX治疗后滑膜组织细胞凋亡指数升高,提示DEX可能是通过促进细胞凋亡从而缓解KOA中滑膜细胞的过度生长现象,具体机制尚需进一步研究。
滑膜细胞分为A型滑膜细胞(巨噬细胞样滑膜细胞)和B型滑膜细胞(FLS),在KOA中以FLS为主,约占70%~80%。为验证KOA中FLS发挥的作用,本文提取原代FLS,又因VCAM-1作为FLS分子标记之一,在FLS中大量表达,而在其它成纤维细胞中不表达[13],因此本研究采用免疫荧光细胞化学染色鉴定FLS,研究发现,细胞呈纺锤形,且VCAM-1呈阳性表达,即提取细胞为FLS,可用于接下来研究。本研究发现,FLS在KOA中生长加快、凋亡差异不明显,提示FLS的异常生长却不凋亡是滑膜组织异常增生的原因之一。
在KOA模型大鼠FLS中TLR4、核内NF-κB p65蛋白水平明显升高,核外NF-κBp65蛋白水平明显降低,提示TLR4/NF-κB在KOA大鼠FLS异常生长中发挥一定作用。而TLR4作为机体重要蛋白质免疫分子,可调控多种非特异性免疫,在KOA中既可以激活机体免疫细胞应答并诱导激发抗微生物防御系统,产生更多炎症因子,炎症因子在NF-κB p65作用下参与疾病免疫过程[14];又可以影响细胞凋亡,从而影响疾病[15],在KOA中抑制TLR4的表达能够缓解疾病,实现对滑膜细胞异常增生的缓解[16]。NF-κB p65作为广泛存在于哺乳动物细胞中的转录因子,参与多种基因调控过程,作为TLR4下游调控因子,能够由胞质转位到核内,刺激各种细胞因子等的表达[17]。TLR4/NF-κB通路与细胞凋亡关系密切,荔枝核总黄酮在大鼠肝星状细胞中抑制细胞增殖、促进细胞凋亡与抑制TLR4/NF-κB通路激活关系密切[18]。caspase-3作为促凋亡因子,在KOA中研究发现,抑制凋亡相关蛋白caspase-1和caspase-3等的活化可抑制KOA的发生[19]。此外,DEX能够抑制炎症通路TLR4/NF-κB的表达,实现对KOA的缓解[20]。在本研究中,经DEX治疗后KOA大鼠FLS存活率及细胞中TLR4、核内NF-κBp65蛋白水平降低,凋亡率及细胞中核外NF-κB p65、cleaved caspase-3蛋白水平升高;在DEX基础上添加TLR4激活剂LPS后,大鼠膝关节滑膜组织炎症浸润程度加重,且滑膜组织细胞凋亡指数及FLS凋亡率降低,提示DEX抑制TLR4/NF-κB的表达从而促进FLS细胞凋亡,实现对疾病的缓解。
综上所述,DEX通过下调TLR4表达、抑制NF-κB核移位从而促进KOA中FLS凋亡,从而缓解滑膜组织异常增生,实现对疾病的保护,为DEX在KOA中应用提供新的依据。TLR4/NF-κB通路与炎症关系密切,但在本研究中尚未做炎症相关的探讨,接下来这将作为研究重点深入探究。

