活血解毒方通过修复表皮屏障减轻银屑病样小鼠皮损复发表现*
刘 宇, 李 萍, 王 燕, 底婷婷, 蒙玉娇, 郭简宁,郭肖瑶, 齐 聪, 赵京霞△
(1首都医科大学附属北京中医医院,北京市中医研究所,银屑病中医临床基础研究北京市重点实验室,北京100010;2北京中医药大学,北京100029)
银屑病是一种难治性皮肤科常见病,表现为皮肤红斑、鳞屑、增厚。研究证实银屑病患者存在着表皮屏障的损伤[1],紧密连接的异常直接影响表皮通透屏障功能,银屑病患者皮损中被证实存在着紧密连接蛋白的异常表达[2]。研究发现,银屑病患者外用保湿剂可以改善其受损的表皮屏障功能,并预防、延缓银屑病复发[3],但中药对紧密连接的调节作用及对银屑病复发的影响却不甚明确。
血瘀证是银屑病慢性期的中医证候之一,有反复发作、迁延难愈等特点。活血解毒方(Huoxue-Jie⁃du decoction,HXJD)是针对银屑病血瘀证的常用方剂。临床研究和基础研究均已明确发现HXJD的有效性,并发现该方可减缓银屑病的复发,但具体作用机制尚不明确[4-5]。凉血解毒方(Liangxue-Jiedu de⁃coction,LXJD)是临床治疗银屑病证属血热的常用方,多用于急性期银屑病。因此,本研究对比LXJD,观察HXJD对银屑病样小鼠皮损紧密连接及对复发模型小鼠皮损的干预作用,为中药延缓银屑病复发提供生物学证据。
材料和方法
1 材料
1.1 动物 SPF级C57BL/6J小鼠,雄性,体质量20~22 g,购于北京华阜康生物科技股份有限公司,动物合格证号为SCXK(京)2014-0004,饲养于北京市中医研究所动物室。实验经北京市中医研究所实验动物管理委员会批准,伦理号为2018100202。
1.2 药物 咪喹莫特乳膏(四川明欣药业有限责任公司);氨甲蝶呤(methotrexate,MTX)片(上海信谊药厂有限公司);HXJD(组成为:白花蛇舌草、莪术、鬼箭羽、鸡血藤、桃仁、丹参、当归、元参、威灵仙、桂枝、苍术、草河车);LXJD(组成为土茯苓、生槐花、紫草、生地黄、赤芍、白鲜皮、草河车、丹皮、白茅根、防风、白花蛇舌草、板蓝根);中药材来源于首都医科大学附属北京中医医院中药房。
1.3 试剂与仪器 过氧化物酶封闭液、DAB显色液和荧光封片剂(中杉金桥);抗Ki67、CD3、loricrin、claudin-1和claudin-7抗体(Abcam);抗occludin抗体(Proteintech);Alexa Fluor®488山羊抗兔IgG(冠星科技有限宇公司);BCA试剂盒(Thermo)。
组织脱水机(型号ASP300S)、包埋机(型号EG1140C)和HE半自动染色仪(型号AUTOSTAIN⁃ERXL)均购自Leica;正置荧光显微镜及图像分析系统(型号IMAGERZ2)购自Zeiss。
2 方法
2.1 分组与模型制备 采用咪喹莫特诱导银屑病样皮损的经典模型[5],给药剂量参考课题组前期实验结果[6]。小鼠腹腔注射80 mg/kg戊巴比妥钠麻醉,背部刮毛约2 cm×2 cm。随机分成5组,空白对照(control)组、模型(model)组、阳性药(MTX)组、HXJD组和LXJD组,每组9只,单笼饲养。除空白对照组外,予5%咪喹莫特乳膏62.5 mg外用,日1次,空白对照组予等量凡士林。6 d后,每组随机处死6只小鼠,剩余小鼠,正常饲养29 d后,重新备皮,要求同前,于第37天除空白对照组外,其余4组均予外涂咪喹莫特诱导银屑病复发模型,共5 d。
2.2 给药方法 造模同时灌胃给药,阳性药组予MTX(1 mg/kg,0.9%生理盐水溶解),HXJD组和LXJD组予相应水煎剂,空白对照和模型组予生理盐水,每天1次,每次0.2 mL。复发模型造模时,不给药。
2.3 小鼠的皮损表现及PASI评分 每天对小鼠皮损进行拍照,并根据红斑、鳞屑和浸润进行严重程度评分,3项相加即为总分。以纵坐标为各组小鼠3项得分及总分的平均值、横坐标为时间绘制折线图,观察小鼠皮损变化。
2.4 小鼠皮肤表皮含水量的检测 第1次取材前,用水油笔检测各组小鼠背部皮损表皮含水量,重复3次,取均值绘制柱状图。
2.5 小鼠皮损的病理学改变检测 组织经固定、脱水后,制成5µm石蜡切片,进行HE染色。每个标本选4张染色切片观察组织病理学改变,并在20倍及40倍物镜下拍照,对40倍物镜下图片采用ZEN图像分析系统测量表皮厚度。
2.6 小鼠皮损表皮细胞增殖分化标志分子的检测 分别采用免疫荧光法和免疫组化法检测小鼠皮损Ki67和loricrin的表达。石蜡切片经脱蜡及抗原修复后,过氧化物酶封闭液室温封闭10 min,10%山羊血清37℃孵育30 min,加入Ki67(1∶400)和loricrin(1∶200)Ⅰ抗4℃孵育过夜。Ki67用Alexa Fluor®488标记的荧光Ⅱ抗(1∶800)37℃孵育1 h后,DAPI封片;loricrin用羊抗兔IgG抗体37℃孵育1 h后显色封片。显微镜下观察,并计算阳性细胞数及平均吸光度。
2.7 免疫组化法检测小鼠皮损 CD3+T细胞的浸润检测步骤同loricrin,但Ⅰ抗稀释比为1∶50。正置光学显微镜下观察CD3+T细胞的浸润情况。
2.8 免疫组化法检测小鼠皮损表达紧密连接蛋白的表达 检测步骤同loricrin,抗claduin-1、claudin-7、occludin的Ⅰ抗稀释比均为1∶200。正置光学显微镜下观察蛋白的定位及表达,并计算阳性细胞数及平均吸光度。
2.9 Western blot检测小鼠皮损occludin的表达研磨提取皮肤组织蛋白,经定量、变性、电泳、电转后,5%脱脂奶粉室温封闭1 h后,Ⅰ抗(1∶1 000)4℃摇床孵育过夜,Ⅱ抗(1∶10 000)室温摇床避光孵育1 h后,扫膜并对条带进行灰度分析。
3 统计学处理
采用SPSS17.0及GraphPad Prism 6.0软件进行统计分析。数据以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 HXJD减轻银屑病样小鼠的皮损表现
Control组小鼠背部皮肤光滑,颜色为肉红色。随着咪喹莫特的涂抹,model组小鼠皮损出现红斑、鳞屑、浸润等银屑病样表现。与model组相比,用药组的皮损表现均减轻。PASI评分趋势图提示,各组小鼠在用药第2天,出现红斑、鳞屑、浸润等表现;用药3天后,各组小鼠在3项评分中逐渐出现差异趋势;在总分图中,model组最为严重;与model组相比,HXJD组和LXJD组严重程度减低;MTX组皮损严重程度最轻。对比HXJD和LXJD发现,HXJD对小鼠皮损的缓解作用较差。见图1。
2 HXJD有效恢复银屑病样小鼠的表皮屏障功能
与control组相比,model组小鼠第7天表皮含水量明显降低(P<0.05),提示其表皮通透屏障受损;与mode组相比,HXJD组小鼠表皮含水量升高(P<0.05);对比两中药组发现,HXJD组的表皮含水量明显升高(P<0.05),提示其有效恢复受损表皮通透屏障,见表1。
3 HXJD减轻银屑病样小鼠的表皮厚度
病理观察可见第7天comtrol组小鼠皮肤表皮薄,真皮淋巴细胞浸润较少;model组小鼠表皮明显增厚(P<0.05),表皮细胞角化不全,真皮大量淋巴细胞浸润;与model组相比,给药组表皮变薄(P<0.05),真皮淋巴细胞浸润减少;对比两中药组发现,HXJD组表皮厚度较LXJD更厚(P<0.05),见图2及表1。

表1 活血解毒方对银屑病样小鼠表皮含水量和皮损表皮厚度的干预作用Table 1.Effect of Huoxue-Jiedu decoction(HXJD)on the mois⁃ture content and thickness of psoriatic mouse epider⁃mis(Mean±SD.n=6)
4 HXJD减轻银屑病样小鼠表皮细胞的异常增殖分化标志分子的表达
免疫荧光法检测各组小鼠Ki67的表达,阳性显示为绿色。结果显示,control组表皮基底层有少量阳性表达;model组较control组表达明显增多(P<0.05);与model组相比,MTX组、HXJD组和LXJD组中阳性表达明显减少(P<0.05);对比两中药组发现,HXJD组较LXJD组阳性表达明显减少(P<0.05),见图3及表2。
免疫组化法检测各组小鼠loricrin的表达,阳性显示为棕色。在control组中,loricrin呈细线状表达在表皮角质层;与control组相比,model组蛋白表达减少(P<0.05);与model组相比,MTX组、HXJD组和LXJD组均增加了loricrin的表达(P<0.05);对比两中药组,HXJD可将loricrin浓缩至角质层,促进形成角质层屏障,帮助修复受损的表皮通透屏障,而LXJD组蛋白仍旧弥散表达在表皮上层,见图3及表2。
5 HXJD减少银屑病样小鼠皮损的T淋巴细胞激活浸润
CD3标记皮肤中激活的T淋巴细胞,阳性显示为棕色。在control组,真皮中可见少量棕色阳性颗粒;与control组相比,model组阳性点明显增多(P<0.05);与model组相比,MTX组、HXJD组和LXJD组中CD3+T细胞明显减少(P<0.05),见图3及表2。

表2 活血解毒方对银屑病样皮损Ki67、loricrin和CD3表达的影响Table 2.Effect of Huoxue-Jiedu decoction(HXJD)on the ex⁃pression of Ki67,loricrin and CD3 in psoriatic mouse skin lesions(Mean±SD.n=3)

Figure 1.Effect of Huoxue-Jiedu decoction(HXJD)on the skin lesions of psoriatic mice.Mean±SD.n=6.*P<0.05 vs model group.图1 活血解毒方对银屑病样小鼠皮损的干预作用
6 HXJD增加银屑病样小鼠皮损中紧密连接蛋白的表达
免疫组化法检测各组小鼠皮损组织claudin-1、claudin-7和occludin的表达和定位,可见在control组抗claudin-1和claudin-7抗体均标记表皮细胞胞膜,表达连续,呈完整网状;抗occludin抗体标记表皮细胞膜及胞浆,表达连续。与control组相比,model组中3种蛋白的表达均明显减少(P<0.05),且表达完整性严重破坏,其中occludin标记表皮全层,出现异常定位。与model组相比,MTX组、HXJD组和LXJD组中3种蛋白的表达均有不同程度增加(P<0.05),且一定程度恢复表达的完整连续性。对比两中药组,HXJD组的claudin-1和claudin-7表达较LXJD组更高(P<0.05),occludin的表达较LXJD组的差异未见统计学显著性。见图4及表3。

表3 活血解毒方对银屑病样小鼠皮损claudin-1、claudin-7和occludin表达的影响Table 3.Effect of Huoxue-Jiedu decoction(HXJD)on the expression of claudin-1,claudin-7 and occludin in psoriatic mouse skin le⁃sions(Mean±SD.n=3)
Western blot提示,与control组比较,model组的occludin表达减少(P<0.05);与model组相比,HXJD和LXJD组的occludin表达量有升高趋势,但未见统计学显著性,见图5。
7 HXJD对银屑病复发模型小鼠皮损表现及严重程度评分的影响
肉眼观察到control组小鼠较初次造模,皮肤出现少量干屑,但无明显红斑及皮肤增厚;随着咪喹莫特的涂抹,model组的皮损再次出现类似银屑病样皮损;与model组相比,MTX组的皮损鳞屑减少,红斑减少不明显,浸润减轻;与model组相比,HXJD组和LXJD组的皮损表现明显减轻。PASI评分趋势图提示,各组小鼠在咪喹莫特刺激的第2天,较初次造模,迅速出现了红斑、鳞屑、浸润等表现,且各组在以上方面出现了较为明显的差异,在总积分图中可看出model组最为严重;与model组比较,HXJD组和LXJD组小鼠的皮损严重程度降低,疾病发展趋势缓慢,MTX组的皮损严重程度最重。对比两中药组,HXJD组的皮损浸润、红斑及总积分较LXJD组均明显降低。见图6。

Figure 2.Effect of Huoxue-Jiedu(HXJD)decoction on the pathological changes of psoriatic mouse skin lesions(HE staining,scale bar=20µm).图2 活血解毒方对银屑病样小鼠皮损病理学变化的影响
8 HXJD减轻银屑病复发模型小鼠皮损表现
二次造模5 d后,control组皮肤表皮薄,皮下淋巴细胞浸润较少;而model组小鼠皮肤增厚(P<0.05),真皮浸润淋巴细胞增多,表皮细胞角化不全;与model组比较,MTX组、HXJD组和LXJD组的表皮不同程度变薄(P<0.05),且角化不全细胞明显减少,淋巴细胞浸润也有不同程度减少;对比两中药组,HXJD组表皮厚度较LXJD组明显变薄(P<0.05),见图7。
讨 论
银屑病是在一定遗传背景下,由感染、代谢、应激等内外环境因素诱发的慢性炎症性皮肤病,世界卫生组织已将其列为影响人类健康的重要疾病之一[7]。寻常型银屑病是银屑病最常见类型,目前西医多采用维甲酸、光疗、免疫抑制剂、靶向性生物制剂等进行治疗并开展了多方面的探索,取得了一定进展,但银屑病的长病程和高复发率,仍是困扰银屑病患者的关键问题和治疗瓶颈。据文献报道,即使是治疗效果比较好的生物制剂,如secukinumab[8]和secukinumab[9],停药后仍会在平均20~24周内复发。因此,探索有效的治疗药物和方法,证实其疗效,进行推广应用,具有重要意义。

Figure 4.Effect of Huoxue-Jiedu decoction(HXJD)on the expression of claudin-1,claudin-7 and occludin in psoriatic mouse skin lesions(scale bar=20µm).图4 活血解毒方对银屑病样小鼠皮损claudin-1、claudin-7和occludin表达的影响
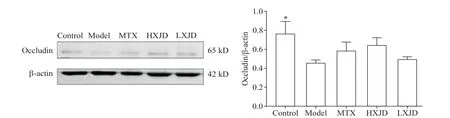
Figure 5.Effect of Huoxue-Jiedu decoction(HXJD)on the expression of occludin in psoriatic mouse skin lesions.Mean±SD.n=3.*P<0.05 vs model group.图5 活血解毒方对银屑病样小鼠皮损occludin表达的干预作用
皮肤形成表皮屏障,保护我们免受外界环境的伤害,同时控制水分流失[10]。紧密连接作为形成表皮屏障的重要部分,主要在表皮颗粒层发挥作用,形成有效的渗透性阻隔,维持内环境的稳态[11]。研究证实,银屑病患者皮损中紧密连接蛋白表达异常[12]。紧密连接的异常可引起角质形成细胞异常的增殖分化,进而破坏表皮通透屏障,增加经皮水分丢失;另外,破坏的紧密连接为免疫细胞的迁移提供便利,加重免疫反应[13];二者相互作用,最终表现为皮肤增厚、干燥,疾病迁延难愈。

Figure 6.Effect of Huoxue-Jiedu decoction(HXJD)on the skin lesions of mice with recurrent psoriasis induced by imiquimod.Mean±SD.n=3.*P<0.05 vs model group.图6 活血解毒方对咪喹莫特二次诱导的银屑病复发模型小鼠皮损的干预作用
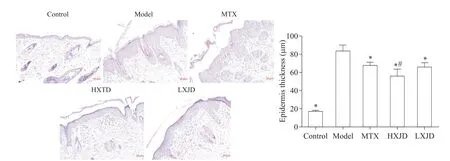
Figure 7.Effect of Huoxue-Jiedu decoction(HXJD)on the pathological changes of skin lesions and the skin thicknessin the mice with recurrent psoriasis(scale bar=20µm).Mean±SD.n=3.*P<0.05 vs model group;#P<0.05 vs LXJDgroup.图7 活血解毒方对银屑病复发模型小鼠皮损病理学变化和皮损表皮厚度的干预作用
寻常型银屑病主要分为血热证、血燥证和血瘀证3种证型。其中,血热证占53.8%,血瘀证占18.1%[14-16]。LXJD和HXJD分别用于急、慢性期银屑病,临床疗效良好。基础研究发现LXJD可有效减轻咪喹莫特诱导BALB/c小鼠的银屑病模型表现,减少表皮细胞异常的增殖分化、抑制免疫细胞过度活化及相关炎性因子分泌,而HXJD对此模型的作用欠佳[6]。因此,本实验采用慢性银屑病动物模型进一步探究HXJD对银屑病慢性期及复发的作用及机制。
本实验选用C57BL/6J小鼠,咪喹莫特外涂进而诱导银屑病样动物模型。研究表明,C57BL/6J小鼠相较其他包括BALB/c在内小鼠品系的给药表现与人类银屑病表现更为相近[17]。且在已有研究中,银屑病复发模型多选用C57BL/6J品系小鼠[18-20]。咪喹莫特是Toll样受体激动剂,可以激活相关通路导致出现类似银屑病表现,且该造模方式有一定自愈性,7 d左右达到皮损严重程度峰值,停药约5天皮肤外观即可恢复正常。国内外多个研究团队在此基础上,采用咪喹莫特二次刺激模型作为银屑病样皮损复发模型。本实验参考第三军医大学团队的造模方式,在初次外涂咪喹莫特6 d后,停止干预,继续单笼饲养,30 d后再次外涂咪喹莫特诱导银屑病样皮损复发发现,二次诱导的小鼠的皮损出现更早,表现较初次更为严重[18]。
本实验研究显示,HXJD和LXJD均可改善银屑病样小鼠皮损表现,降低PASI评分,对比两中药组,LXJD对银屑病样小鼠皮损表现及表皮厚度的改善明显优于HXJD,这与前期课题组研究结果一致[6]。在抑制炎症方面,HXJD组CD3+T细胞的数量较LXJD组是增多的。而在屏障修复方面,对比LXJD组,HXJD可明显升高皮损的表皮含水量以及紧密连接蛋白claudin-1、claudin-7和occludin的表达水平。以上结果明确了,HXJD主要通过调节紧密连接,修复表皮屏障起到缓解皮损表现的作用。
HXJD和LXJD均含有白花蛇舌草、草河车等清热解毒药物,但两方侧重点有所不同,HXJD用了大量活血及养血药物,如鸡血藤、丹参、当归等,而LXJD则更加了生槐花、紫草等清热凉血药物的比例。我们前期研究发现,养血类药物具有良好的调节紧密连接的作用,而清热解毒药物对紧密连接的调节作用不甚明显[21]。且通过对比凉血方与LXJD,发现加入解毒药后,可以有效抑制炎性因子的表达,提示解毒药的作用靶点主要在抑制炎症方面[22-23]。由上推测,HXJD因含有鸡血藤和当归等养血活血药物,从而具有良好的修复表皮屏障的作用。
皮肤屏障一直是皮肤科关注的重点,通过本研究,我们已经明确HXJD对皮肤屏障有较好的修复作用。有临床研究发现,银屑病患者在易复发时节前涂抹保湿剂,可以提升表皮通透屏障功能并延缓皮损表现[3]。那么,HXJD是否具有减轻银屑病样皮损复发的作用?我们后续观察了HXJD和LXJD对银屑病复发模型小鼠皮损的影响。结果提示,无论从宏观皮损还是组织学表现,HXJD可明显减轻复发模型小鼠的皮损表现。对比LXJD,HXJD可明显降低银屑病复发模型小鼠的红斑和浸润,具有更好的缓解银屑病样小鼠复发皮损表现的作用。
综上所述,HXJD通过调节紧密连接修复表皮屏障,从而减轻和延缓小鼠银屑病样皮损复发,也提示表皮屏障的修复可作为预防银屑病复发的作用靶点。基于实验结论,建议临床治疗慢性期银屑病时,应注意使用活血、养血类药物,慎用凉血类药物。

