一类轴手性噁唑啉-铂卡宾络合物的合成
江 鹏, 刘云龙, 王 艳, 王飞军
(华东理工大学 化学与分子工程学院,上海 200237)
轴手性配体在多种不对称催化反应中表现出较高的反应活性和对映选择性[1]。1980年,Noyori首次合成了BINAP,并将其用于手性催化,表现出了很好的对映选择性[2]。目前已报道了许多具有轴手性的配体(Chart 1)[3-4]。轴手性配体具有容易修饰和引入大位阻及有电子效应的官能团等优点[5-9]。这些具有轴手性的配体已被证实在许多催化反应中均起到了重要作用[10],如分子内的不对称氢化[11-14]、环丙基化、烯丙基化和Wacker环化等[15-17]反应。
N-杂环卡宾配位的过渡金属催化剂也是多种交叉偶联反应领域的研究热点[18]。N-杂环卡宾[19-20]能够与过渡金属形成比传统的膦配体更加稳定的碳金属键,并且具有更突出的电子效应和立体效应。
近年来,本课题组报道了几种基于N-芳基骨架的轴安定手性配体(1, Chart 2)和轴不安定手性配体(2, Chart 2)。轴不安定手性配体2能够围绕N-芳基轴自由旋转。当这些配体和醋酸钯配位时,最终只能得到(aS,S)构型的络合物(Chart 3)。 (aR,S)构型的络合物因噁唑环上取代基和钯盐之间位阻过大而无法稳定存在。
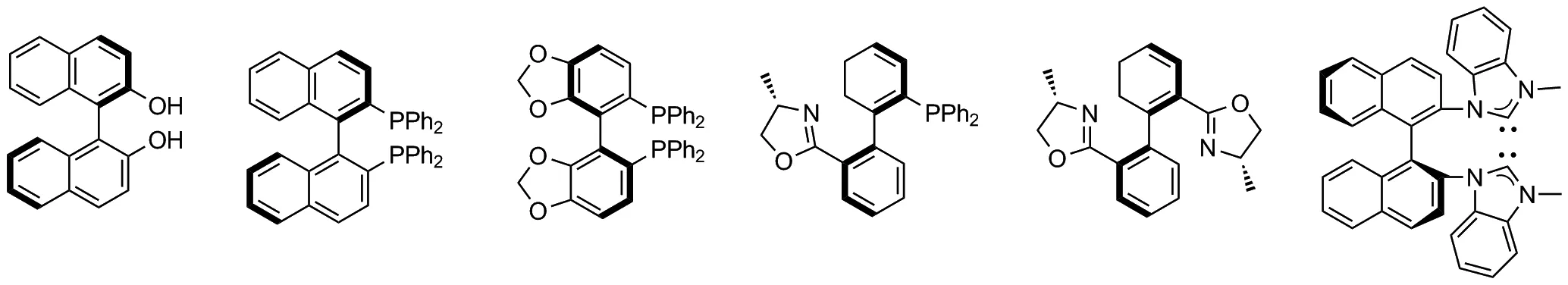
Chart 1
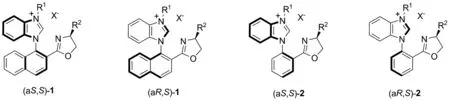
Chart 2

Chart 3
铂卡宾络合物在许多反应中都有广泛的应用[21]。在本课题组前期研究的基础上(Scheme 1),本文设计了如Scheme 2所示的合成路线,合成了表1中的一类轴手性铂卡宾络合物。
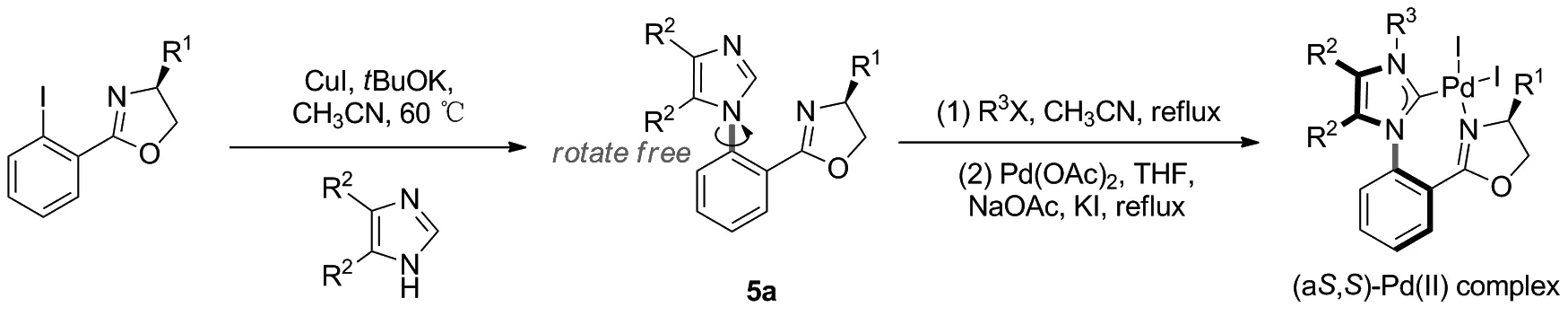
Scheme 1

Scheme 2

表 1 与Pt(COD)Cl2的配位结果
1 实验部分
1.1 仪器与试剂
Bruker AM-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);RigakuAFC7R型X-射线衍射仪。
5、6a、6c、6d按文献[22]方法合成;其余所用试剂均均为化学纯或分析纯。
1.2 合成
(1)6的合成
将化合物55 mmol和苄溴6 mL(50 mmol)溶于20 mL无水乙腈中,氮气保护下回流反应24 h(TLC检测)。冷却至室温,旋蒸除溶,残余物经硅胶柱层析[洗脱剂:V(乙醇)/V(二氯甲烷)=1/10]纯化得黄色固体6。
6a: 黄色固体,产率95%;1H NMR(400 MHz, CDCl3)δ: 10.70(s, 1H), 8.97(s, 2H), 7.93(s, 1H), 7.47~7.91(m, 17H), 6.43(d,J=6.6 Hz, 1H), 4.60(dd,J=8.7 Hz, 10.2 Hz, 1H), 3.95(d,J=7.8 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 161.7, 143.3, 134.7, 132.8, 132.7, 132.5, 132.4, 132.0, 131.4, 130.5, 129.6, 129.3, 129.2, 128.7, 128.5, 128.5, 128.3, 128.1, 127.9, 127.3, 127.2, 127.2, 126.4, 115.4, 114.0, 113.1, 67.7, 54.4, 53.0。
6b: 黄色固体,产率92%;1H NMR(400 MHz, CDCl3)δ: 10.74(s, 1H), 8.22(s, 1H), 7.21~7.77(m, 17H), 6.43(d,J=6.6 Hz, 1H), 4.60(dd,J=10.2 Hz, 8.7 Hz, 1H), 3.95(d,J=7.8 Hz, 1H), 2.91(s, 3H), 2.81(s, 3H);13C NMR(100 MHz, CDCl3)δ: 162.7, 143.2, 134.7, 132.8, 132.7, 132.6, 132.5, 132.3, 132.0, 131.2, 130.5, 129.5, 129.3, 129.1, 128.7, 128.5, 128.4, 128.1, 127.8, 127.3, 127.2, 127.1, 126.3, 114.4, 114.0, 113.1, 65.7, 54.2, 52.0, 36.6, 31.5。
6c: 黄色固体,产率93%;1H NMR(400 MHz, CDCl3)δ: 10.97(s, 1H), 8.14(dd,J=2.0 Hz, 7.3 Hz, 1H), 7.85(d,J=8.3 Hz, 1H), 7.78~7.70(m, 3H), 7.61(dd,J=11.3 Hz, 4.2 Hz, 2H), 7.53(dt,J=14.9 Hz, 7.8 Hz, 2H), 7.42~7.29(m, 4H), 7.21(d,J=8.0 Hz, 1H), 6.46(d,J=15.1 Hz, 1H), 5.85(d,J=15.1 Hz, 1H), 4.11(t,J=9.1 Hz, 1H), 3.82(t,J=8.0 Hz, 1H), 3.80~3.63(m, 1H), 1.12~0.94(m, 1H), 0.63(s, 1H), 0.25(d,J=6.7 Hz, 2H), 0.18(d,J=6.7 Hz, 2H);13C NMR(100 MHz, CDCl3)δ: 158.5, 143.6, 133.1, 133.1, 132.8, 131.8, 131.4, 130.9, 129.3, 129.2, 129.1, 128.9, 128.7, 128.6, 128.5, 127.3, 126.9, 125.0, 113.6, 113.0, 72.6, 69.3, 51.2, 32.2, 17.7, 17.6。
6d: 黄色固体,产率75%;1H NMR(400 MHz, CDCl3)δ: 10.79(s, 1H), 8.10~8.14(m, 1H), 7.71(dd,J=7.0 Hz, 2.5 Hz, 2H), 7.54 (d,J=6.5 Hz, 2H), 7.41~7.28(m, 5H), 6.90(s, 1H), 6.31(d,J=15.1 Hz, 1H), 5.79(d,J=15.1 Hz, 1H), 4.03~3.96(m, 1H), 3.88(t,J=8.2 Hz, 1H), 3.60~3.55(m, 1H), 2.33(s, 3H), 2.25(s, 3H), 0.23(s, 9H);13C NMR(100 MHz, CDCl3)δ: 162.3, 154.5, 134.8, 133.1, 133.0, 132.9, 132.8, 132.7, 131.9, 130.7, 128.6, 128.5, 127.6, 127.3, 126.8, 122.8, 119.7, 114.2, 112.2, 110.3, 70.3, 51.1, 33.3, 28.9, 25.0, 19.2。
(2)7的合成
将651 mg(0.1 mmol), Pt(COD)Cl238 mg(0.1 mmol), NaOAc 12.3 mg(0.15 mmol)和KI 166 mg(1 mmol)加入干燥的圆底烧瓶中,加入10 mL无水乙腈,氮气保护下回流反应过夜。冷却至室温,旋蒸除溶,残余物经硅胶柱层析[洗脱剂:V(乙酸乙酯)/V(石油醚)=1/2]纯化得淡黄色固体7。
7a: 淡黄色固体,产率69%;1H NMR (400 MHz, CDCl3)δ: 8.05(d,J=7.7 Hz, 1H), 7.95(dd,J=10.9 Hz, 4.6 Hz, 1H), 7.88~7.71(m, 2H), 7.49(t,J=7.5 Hz, 1H), 7.36~7.24(m, 5H), 7.21(t,J=7.7 Hz, 2H), 7.21~7.15(m, 2H), 7.14~7.08(m, 1H), 6.96(d,J=8.2 Hz, 2H), 6.39(d,J=15.6 Hz, 1H), 6.24(dd,J=10.2 Hz, 5.2 Hz, 1H), 5.08(t,J=9.8 Hz, 1H), 4.69(dd,J=9.2 Hz, 5.3 Hz, 2H), 3.74(d,J=15.9 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 162.8, 162.2, 139.1, 135.3, 134.6, 134.3, 133.8, 131.2, 129.9, 129.5, 129.1, 128.5, 128.0, 127.9, 127.8, 127.2, 124.4, 124.4, 123.4, 113.0, 110.8, 70.9, 53.1。7a(CCDC: 995271)的晶体学数据见表2。
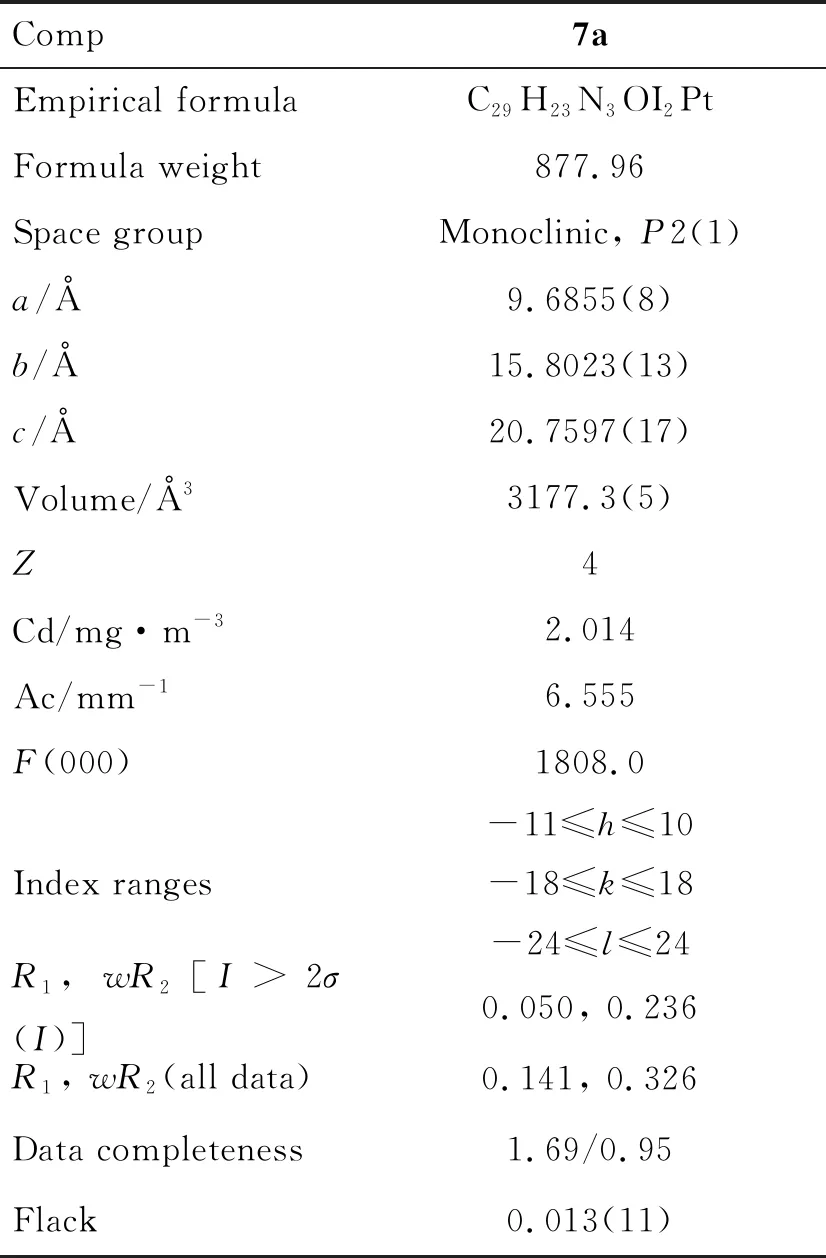
表2 7a的晶体学数据
7b: 淡黄色固体,产率72%;1H NMR(400 MHz, CDCl3)δ: 7.96(d,J=7.7 Hz, 1H), 7.90(t,J=7.5 Hz, 1H), 7.78~7.68 (m, 2H), 7.43(t,J=7.4 Hz, 1H), 7.28~7.13(m, 7H), 7.15~6.90(m, 3H), 6.42(s, 1H), 6.26(d,J=16.1 Hz, 1H), 6.23~6.16(m, 1H), 5.00(t,J=9.8 Hz, 1H), 4.60(dd,J=9.1 Hz, 5.4 Hz, 1H), 3.67(d,J=15.9 Hz, 1H), 2.23(s, 3H), 2.12(s, 3H);13C NMR(100 MHz, CDCl3)δ: 162.9, 160.3, 139.0, 135.6, 134.3, 134.0, 133.8, 133.7, 133.1, 132.2, 131.0, 129.7, 129.5, 129.0, 128.4, 128.0, 127.8, 127.8, 127.3, 123.4, 113.0, 111.1, 70.9, 52.8, 20.4, 20.3。
7c: 淡黄色固体,产率70%;1H NMR(400 MHz, CDCl3)δ: 8.01~7.93(m, 2H), 7.75~7.66(m, 2H), 7.63~7.56(m, 2H), 7.42~7.33(m, 4H), 7.27(q,J=3.4 Hz, 3H), 6.31(d,J=15.5 Hz, 1H), 6.03(d,J=15.5 Hz, 1H), 5.23~5.06(m, 1H), 4.59(t,J=9.7 Hz, 1H), 4.35(dd,J=9.1 Hz, 5.7 Hz, 1H), 0.90~0.84(m, 1H), 0.72(d,J=7.0 Hz, 3H), 0.07(d,J=5.6 Hz, 3H);13C NMR(100 MHz, CDCl3)δ: 162.9, 162.5, 135.2, 134.4, 134.3, 134.3, 134.1, 131.3, 129.7, 128.8, 128.5, 128.4, 127.7, 127.4, 124.8, 124.6, 123.4, 112.7, 111.4, 102.6, 72.5, 70.4, 53.4, 22.7, 18.4, 14.0。
7d: 淡黄色固体,产率67%;1H NMR(400 MHz, CDCl3)δ: 7.97(dd,J=7.8 Hz, 1.3 Hz, 1H), 7.87(td,J=7.9 Hz, 1.5 Hz, 1H), 7.70(dd,J=9.9 Hz, 4.0 Hz, 2H), 7.40(dd,J=6.4 Hz, 2.7 Hz, 2H), 7.33(dd,J=7.5 Hz, 2.9 Hz, 3H), 7.04(s, 1H), 6.69(s, 1H), 6.63(d,J=15.9 Hz, 1H), 5.66(d,J=15.9 Hz, 1H), 5.18(dd,J=10.6 Hz, 6.2 Hz, 1H), 4.65(t,J=10.0 Hz, 1H), 4.48(dd,J=9.3 Hz, 6.3 Hz, 1H), 2.26(s, 3H), 2.17(s, 3H), 0.92(s, 9H);13C NMR(100 MHz, CDCl3)δ: 164.1, 160.9, 135.5, 134.1, 134.0, 134.0, 133.9, 132.9, 132.7, 131.6, 129.4, 128.6, 128.0, 127.7, 127.5, 123.7, 113.5, 111.5, 75.6, 71.3, 54.4, 33.8, 26.1, 25.9, 20.3。
2 结果与讨论
2.1 合成
当含有手性噁唑啉配位基团的轴不安定配体,与金属配位形成双齿有机金属化合物时,我们发现只能得到立体位阻较小的金属化合物。为了进一步发展基于金属铂的手性催化剂,设计了这些配体与铂络合的实验。
首先,我们选择取代噁唑啉的配体与苄溴在乙腈中回流,得到相应的噁唑啉盐。之后,我们通过以下反应条件:NaOAc为碱,Pt(COD)Cl2作为铂源,KI催化,在乙腈中回流,得到了收率大于50%的最终产物。
对比化合物6d和7d的1H NMR谱图(图 1),发现卡宾氢δ10.79 处信号消失。同时,噁唑啉上的3个氢和叔丁基的9个氢的信号向低场移动。而苄基亚甲基上的氢原子,一个向高场移动,另一个向低场移动。因此,认定铂同时和卡宾与唑啉配位。

δ
2.2 晶体结构
根据7a的X-ray结果(图 2),发现只得到了(aS,S)构型的7a。综合核磁和X-ray的结果,确证只得到了一种构型(aS,S)的铂络合物。避免了非对映异构体的拆分,突出了绿色经济的优点。
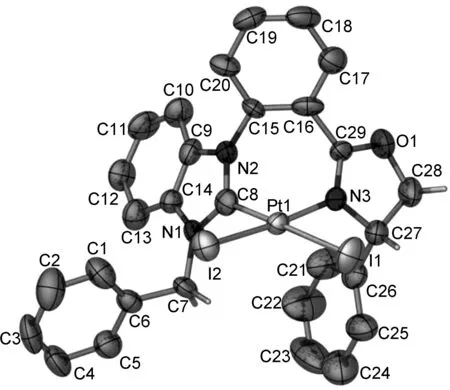
图 2 7a的晶体结构
研究了部分轴手性配体与铂的络合情况和晶体结构,以较高的收率得到了经X-ray证实的(aS,S)构型的铂络合物。本方法所用试剂经济易得,实验步骤简便,反应条件相对温和,有望在不对称催化方面得到应用。由于含有手性取代基团的噁唑啉环的配体在与金属铂配位后,理论上可以得到一对非对映异构体。然而,因为受到轴手性与噁唑啉环上取代基手性的共同影响,最终只得到能量上占优势的(aS,S)构型的络合物。

