长萼爵床的化学成分研究
李灿杰,林定钗,许伟滨,蔡俊星,王文志,张玉波,2,李药兰,王国才*
1暨南大学中药及天然药物研究所;2暨南大学基础医学与公共卫生学院药理学系,广州 510632
爵床科(Acanthaceae)爵床属(Justicia)植物全球约600种,主要分布在热带地区,包括印度、非洲和南美巴西等[1];根据爵床属植物的化学成分和药理活性研究的报道,该属植物富含木脂素、三萜、黄酮及脂肪酸等化合物,显示出明显的抗肿瘤、抗病毒和抗炎活性[2-5],具有广阔的开发潜力。
长萼爵床Justiciacalycina(Nees)主要分布在南美洲亚马逊热带雨林地区[6],其药用部位为干燥全草,作为厄瓜多尔地区的药用植物之一,在当地用于治疗感冒咳嗽、结膜炎、湿疹和癣疮等。据文献报道,长萼爵床新鲜叶子和花中富含精油,通过GC-MS进行成分测定鉴定出63种化合物,主要成分是单萜和倍半萜[7],而对该植物化学成分进行系统研究的报道较少。为了合理开发利用该植物资源,为其药用作用提供科学依据,本实验对长萼爵床全草95%乙醇提取物进行化学成分研究,并对分离得到的化合物进行抗RSV、HSV-1活性筛选和抗炎活性筛选。
1 材料与方法
1.1 仪器与材料
SHIMADZU LC-2030C 3D型分析型高效液相色谱仪(日本SHIMADZU公司);CBM-20- A型制备型高效液相色谱仪(日本SHIMADZU公司);Agilent 6210 ESI/TOF型(美国Agilent公司)质谱仪;JASCO V-550可见光/紫外光谱仪(日本JASCO公司);Bruker AV-400/AV-500/AV-600 MHz型(德国Bruker公司)核磁共振波谱仪;JASCO FI/IR-480 Plus Fourier transform型红外光谱仪(日本JASCO公司);Cosmosil 5C18-MS-II(4.6 mm × 250 mm,5 μm)分析色谱柱;Cosmosil 5C18-MS-II色谱柱(20 mm × 250 mm,5 μm)制备色谱柱;柱色谱硅胶(80~100目、200~300目,青岛海洋化工厂);Sephadex LH-20色谱填料(瑞典Pharmacia 公司);ODS色谱填料(德国Merck公司);硅胶GF254薄层板(烟台化学工业研究所);色谱纯甲醇(山东禹王公司);其余试剂均为山东禹王公司分析纯试剂。
实验所用长萼爵床药材于2018年1月采自南美洲厄瓜多尔亚马逊热带雨林地区,经暨南大学药学院周光雄教授鉴定为爵床科爵床属植物长萼爵床Justiciacalycina(Nees) 的干燥全草,标本(No.20180130)存于暨南大学中药及天然药物研究所。
1.2 实验方法
1.2.1 提取分离
取干燥长萼爵床全草2.0 kg,粉碎,用95%乙醇渗漉提取3次,合并提取液后减压浓缩,得到总浸膏100.0 g。将总浸膏进行硅胶柱层析(200~300目),以二氯甲烷-甲醇(100∶0→0∶100,V/V)梯度洗脱,经TLC以及高效液相分析后合并得到5个馏分(Fr.1~5)。Fr.1经ODS柱层析以甲醇-水体系(40∶60→100∶0,V/V)梯度洗脱,再经制备型高效液相色谱分离纯化后得到化合物4(9.3 mg)、5(6.5 mg)和6(7.5 mg)。Fr.2经Sephadex LH-20柱色谱以二氯甲烷-甲醇(1∶1)分离纯化,再经制备型高效液相色谱分离纯化后得到化合物13(10.0 mg)、14(10.0 mg)、15(4.1 mg)。Fr.3经制备型高效液相色谱分离纯化后得到化合物7(8.2 mg)、8(4.8 mg)和9(5.3 mg)。Fr.4经ODS柱层析以甲醇-水体系(10∶90→100∶0,V/V)梯度洗脱,再经Sephadex LH-20柱色谱以二氯甲烷-甲醇(1∶1)分离纯化,最后经制备型高效液相色谱分离纯化后得到化合物1(6.3 mg)、2(7.6 mg) 和3(10.4 mg)。Fr.5经制备型高效液相色谱分离纯化后得到化合物10(10.2 mg)、11(11.8 mg)和12(6.6 mg)。化合物1~15的化学结构如图1所示。
1.2.2 抗RSV及HSV-1活性筛选
以呼吸道合胞病毒(respiratory syncytial virus,RSV)和单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)为研究对象,以10 μM利巴韦林(ribavirin)为抗RSV活性测试阳性药物组,以10 μM阿昔洛韦(aciclovir)为抗HSV-1活性测试阳性药物组,对分离得到的化合物在浓度为3.125、6.25、12.5、25、50、100 μM的浓度下,进行抗RSV和HSV-1活性筛选。
抗RSV活性测试所用的Hep-2细胞(抗HSV-1活性测试采用Vero细胞)接种于96孔细胞培养板中,于37 ℃、5%培养箱中培养并长成细胞单层。弃去细胞培养液,每孔加入50 μL样品和50 μL 100 × TCID50的病毒稀释液,设置阳性药物组、病毒对照组和细胞对照组,置37 ℃、5%培养箱中培养。培养48~72 h,待病毒对照组完全病变后,记录各组病毒病变情况。
1.2.3 抗炎活性筛选
采用Griess法检测对LPS诱导下RAW 264.7巨噬细胞分泌NO的抑制作用。RAW 264.7巨噬细胞接种于96孔细胞培养板中,37 ℃、5%培养箱中培养并长成细胞单层后加入100 μL不同浓度的待测样品(其浓度分别为3.125、6.25、12.5、25、50、100 μM),培养箱中培养1 h后加入100 μL的LPS(1 μg/mL),同时设置阳性对照组、模型组和空白对照组,继续培养12 h。将上清液与等体积的Griess试剂混合,用酶联免疫检测仪测定混合物在550 nm处的吸光度,同时采用MTT法测定细胞毒性。
2 结果
2.1 结构鉴定
化合物1白色针晶(CHCl3);mp.214~216 ℃;浓硫酸-香草醛反应显蓝紫色。ESI-MS:m/z449 [M+Na]+。1H NMR(600 MHz,CDCl3)δ:4.68(1H,s,H-29a),4.57(1H,s,H-29b),3.19(1H,dd,J= 11.2,4.8 Hz,H-3),2.37(1H,m,H-19),1.68(3H,s,H-30),1.03(3H,s,H-28),0.97(3H,s,H-27),0.94(3H,s,H-26),0.83(3H,s,H-25),0.79(3H,s,H-24),0.76(3H,s,H-23);13C NMR(150 MHz,CDCl3)δ:38.9(C-1),27.6(C-2),79.2(C-3),39.0(C-4),55.4(C-5),21.1(C-6),34.4(C-7),41.0(C-8),50.6(C-9),37.3(C-10),18.5(C-11),25.3(C-12),38.2(C-13),43.0(C-14),27.6(C-15),35.7(C-16),43.2(C-17),48.5(C-18),48.1(C-19),151.1(C-20),30.0(C-21),40.2(C-22),28.1(C-23),19.5(C-24),16.3(C-25),16.1(C-26),14.7(C-27),15.5(C-28),109.5(C-29),18.1(C-30)。以上数据与文献[8]报道基本一致,故鉴定化合物1为羽扇豆醇。
化合物2白色针晶(CHCl3);mp.171~173 ℃;浓硫酸-香草醛反应显蓝紫色。ESI-MS:m/z435 [M+Na]+。1H NMR(600 MHz,CDCl3)δ:5.15(1H,m,H-7),5.16(1H,dd,J= 15.2,8.8 Hz,H-22),5.03(1H,dd,J= 15.1,8.8 Hz,H-23),3.60(1H,m,H-3),1.03(3H,d,J= 6.6 Hz,H-21),0.85(3H,d,J= 6.4 Hz,H-27),0.80(3H,m,H-26),0.79(3H,m,H-19),0.55(3H,m,H-18);13C NMR(150 MHz,CDCl3)δ:37.3(C-1),31.6(C-2),71.2(C-3),38.1(C-4),40.4(C-5),29.8(C-6),117.6(C-7),139.7(C-8),49.6(C-9),34.4(C-10),21.7(C-11),39.6(C-12),43.4(C-13),55.3(C-14),23.2(C-15),28.7(C-16),56.1(C-17),12.2(C-18),13.2(C-19),41.0(C-20),21.2(C-21),138.3(C-22),129.6(C-23),51.4(C-24),32.0(C-25),21.5(C-26),19.1(C-27),25.6(C-28)。以上数据与文献[9]报道基本一致,故鉴定化合物2为α-菠甾醇。
化合物3淡黄色油状物(CH3OH);浓硫酸-香草醛反应显棕黑色。ESI-MS:m/z409 [M+Na]+。1H NMR(500 MHz,CD3OD)δ:5.99(1H,d,J= 15.6 Hz,H-7),5.90(1H,s,H-4),5.74(1H,dd,J=15.6,7.2 Hz,H-8),4.56(1H,m,H-9),4.31(1H,d,J= 7.8 Hz,H-1′),2.61(1H,d,J= 17.0 Hz,H-2a),2.20(1H,d,J= 17.0 Hz,H-2b),1.97(3H,s,H-13),1.31(3H,d,J= 6.5 Hz,H-10),1.06(3H,s,H-11),1.04(3H,s,H-12);13C NMR(125 MHz,CD3OD)δ:42.4(C-1),50.8(C-2),201.2(C-3),127.1(C-4),167.1(C-5),80.0(C-6),133.8(C-7),133.7(C-8),74.6(C-9),22.2(C-10),19.5(C-11),23.5(C-12),24.7(C-13),101.3(C-1′),75.0(C-2′),78.2(C-3′),71.7(C-4′),78.4(C-5′),62.8(C-6′)。以上数据与文献[10]报道基本一致,故鉴定化合物3为corchoionoside C。
化合物4淡黄色油状物(CH3OH);浓硫酸-香草醛反应显紫色。ESI-MS:m/z401 [M+Na]+。1H NMR(400 MHz,CD3OD)δ:6.64~7.01(6H,m,Ar-H),4.85(1H,m,H-7),4.30(1H,m,H-8),3.85(2H,m,H-9),3.81(3H,s,3′-OCH3),3.80(3H,s,3-OCH3),3.56(2H,m,H-9′),2.61(3H,t,J= 7.8 Hz,H-7′),1.77~1.81(2H,m,H-8′);13C NMR(100 MHz,CD3OD)δ:134.2(C-1),114.0(C-2),147.0(C-3),147.3(C-4),115,7(C-5),121.1(C-6),86.7(C-7),74.2(C-8),62.3(C-9),138.2(C-1′),111.8(C-2′),148.8(C-3′),151.9(C-4′),119.7(C-5′),121.9(C-6′),35.7(C-7′),32.8(C-8′),62.3(C-9′),56.4(3-OCH3),56.5(3′-OCH3)。以上数据与文献[11]报道基本一致,故鉴定化合物4为1-(4-hydroxy-3-methoxyphenyl)-2-[4-(3- hydroxypropyl)-2-methoxy- phenoxy]-1,3-propanediol。
化合物5无色油状物(CH3OH);浓硫酸-香草醛反应显蓝紫色。ESI-MS:m/z383 [M+Na]+。1H NMR(400 MHz,CD3OD)δ:6.97(1H,d,J= 1.4 Hz,H-2′),6.83(1H,d,J= 1.6 Hz,H-3′),6.79(1H,s,H-2),6.77(1H,s,H-6′),6.74(1H,s,H-5),5.51(1H,d,J= 6.1 Hz,H-7′),3.87(3H,s,H-5′),3.83(3H,s,H-3),3.80(1H,m,H-9a),3.59(2H,t,J= 6.2 Hz,H-9′),3.49(1H,m,H-9b),2.65(1H,t,J= 7.4 Hz,H-7),1.84(1H,m,H-8),1.81(2H,m,H-8′);13C NMR(100 MHz,CD3OD)δ:135.0(C-1),110.7(C-2),149.2(C-3),147.7(C-4),116.3(C-5),119.9(C-6),89.1(C-7),55.6(C-8),65.1(C-9),130.1(C-1′),114.3(C-2′),145.4(C-3′),147.7(C-4′),137.1(C-5′),118.1(C-6′),35.9(C-7′),33.0(C-8′),62.4(C-9′),56.9(3-OCH3),56.5(3′-OCH3)。以上数据与文献[12]报道基本一致,故鉴定化合物5为4-(2,3-dihydro-3-hydroxymethyl-5-(3-hydroxypropyl)-7-methoxy-benzofuran-2-yl)-2-methoxyph-enol。
化合物6白色粉末(CHCl3);浓硫酸-香草醛反应显棕黑色。ESI-MS:m/z251 [M+Na]+。1H NMR(400 MHz,CDCl3)δ:7.52(1H,d,J= 16.0 Hz,H-11),7.49~7.51(2H,m,H-2,H-6),7.34~7.39(3H,m,H-3,H-4,H-5),6.60(1H,d,J= 16.0 Hz,H-10),5.97(1H,d,J= 2.2 Hz,H-7),5.54(1H,d,J= 2.2 Hz,H-8),3.84(3H,s,H-14);13C NMR(100 MHz,CDCl3)δ:135.3(C-1),127.6(C-2),129.1(C-3),129.7(C-4),129.1(C-5),127.6(C-6),136.2(C-7),118.7(C-8),158.9(C-9),101.6(C-10),89.0(C-11),163.7(C-12),171.5(C-13),56.1(C-14)。以上数据与文献[13]报道基本一致,故鉴定化合物6为5-styrylfuran-2- carboxylic acid methyl ester。
化合物7淡黄色针晶(CHCl3);mp.83~85 ℃;浓硫酸-香草醛反应显绿色。ESI-MS:m/z201 [M+Na]+。1H NMR(400 MHz,CDCl3)δ:9.66(1H,d,J= 7.7 Hz,H-1),7.38(1H,d,J= 15.8 Hz,H-3),7.13(1H,s,H-2′),7.07(1H,d,J= 8.1 Hz,H-6′),6.97(1H,d,J= 8.1 Hz,H-5′),6.56(1H,dd,J= 15.9,7.8 Hz,H-2),3.95(3H,s,3′-OCH3);13C NMR(100 MHz,CDCl3)δ:193.7(C-1),115.1(C-2),153.2(C-3),126.6(C-1′),124.2(C-2′),147.1(C-3′),149.1(C-4′),109.6(C-5′),126.6(C-6′),56.2(3′-OCH3)。以上数据与文献[14]报道基本一致,故鉴定化合物7为ferulyl aldehyde。
化合物8无色油状物(CHCl3);ESI-MS:m/z317 [M+Na]+。1H NMR(400 MHz,CDCl3)δ:5.35(4H,m,H-9,H-10,H-12,H-13),3.66(3H,s,1′-OCH3),2.76(2H,t,J= 5.9 Hz,H-11),2.30(2H,t,J= 7.5 Hz,H-2),2.05(4H,m,H-8,H-14),1.61(2H,m,H-3),1.25~1.38(8H,m,H-4,H-7,H-15,H-17),0.88(3H,t,J= 6.9 Hz,H-18);13C NMR(100 MHz,CDCl3)δ:174.6(C-1),34.3(C-2),22.8(C-3),29.3(C-4),29.3(C-5),29.6(C-6),29.8(C-7),27.4(C-8),130.3(C-9),128.1(C-10),25.9(C-11),128.3(C-12),130.4(C-13),27.4(C-14),29.4(C-15),31.7(C-16),22.8(C-17),14.3(C-18),51.6(1′-OCH3)。以上数据与文献[15]报道基本一致,故鉴定化合物8为亚油酸甲酯。
化合物9无色油状物(CHCl3);ESI-MS:m/z319 [M+Na]+。1H NMR(500 MHz,DMSO-d6)δ:5.24(1H,t,J= 6.3 Hz,H-2),3.92(2H,d,J= 6.3 Hz,H-1),1.91(1H,m,H-4),1.55(3H,s,H-17),1.36(2H,m,H-5),1.34(1H,m,H-6a),1.30(2H,m,H-7),1.26(1H,m,H-6b),1.23(4H,m,H-9,H-13),1.16(3H,m,H-8a,H-10a,H-12a),1.07(2H,m,H-14),1.03(3H,m,H-8b,H-10b,H-12b),0.84(6H,d,J= 6.7 Hz,H-16,H-20),0.81(6H,d,J= 6.8 Hz,H-18,H-19);13C NMR(125 MHz,DMSO-d6)δ:57.5(C-1),125.3(C-2),135.5(C-3),39.2(C-4),24.6(C-5),36.0(C-6),32.0(C-7),36.8(C-8),23.8(C-9),36.8(C-10),32.1(C-11),36.6(C-12),24.2(C-13),38.8(C-14),27.4(C-15),22.4(C-16),15.8(C-17),19.6(C-18),19.6(C-19),22.5(C-20)。以上数据与文献[16]报道基本一致,故鉴定化合物9为3,7,11,15-tetra- methylhexadec-2-en-1-ol。
化合物10白色蜡状固体(CHCl3);ESI-MS:m/z301 [M+Na]+。1H NMR(400 MHz,CDCl3)δ:5.28~5.42(6H,m,H-9,H-10,H-12,H-13,H-15,H-16),2.80(2H,m,H-11,H-14),0.97(3H,t,J= 7.6 Hz,H-18);13C NMR(100 MHz,CDCl3)δ:179.6(C-1),34.2(C-2),24.8(C-3),29.2(C-4),29.2(C-5),29.7(C-6),29.3(C-7),27.4(C-8),132.1(C-9),127.3(C-10),25.7(C-11),128.4(C-12),128.4(C-13),25.8(C-14),127.9(C-15),130.4(C-16),20.7(C-17),14.4(C-18)。以上数据与文献[17]报道基本一致,故鉴定化合物10为α-亚麻酸。
化合物11白色晶体(CHCl3);mp.218~220 ℃;浓硫酸-香草醛反应显紫色。ESI-MS:m/z441 [M+Na]+。1H NMR(400 MHz,DMSO-d6)δ:6.11(1H,m,H-14),5.60(1H,d,J= 2.0 Hz,H-13),4.40(1H,m,H-8),4.32(1H,m,H-6),3.75(1H,m,H-4),2.19(1H,dd,J= 13.1,4.1 Hz,H-15),1.82(2H,m,H-16),1.67(2H,m,H-10),1.60(2H,d,J= 5.8 Hz,H-9),1.52(2H,m,H-5),1.50(2H,m,H-17),1.24(2H,dd,J= 11.2,5.1 Hz,H-2),1.06(3H,s,H-20),1.04(6H,s,H-19,H-22),0.82(3H,s,H-1),0.75(3H,s,H-18);13C NMR(100 MHz,DMSO-d6)δ:20.3(C-1),37.6(C-2),83.0(C-3),66.6(C-4),48.7(C-5),66.8(C-6),68.7(C-7),76.2(C-8),46.9(C-9),44.4(C-10),75.7(C-11),202.6(C-12),120.4(C-13),165.2(C-14),50.1(C-15),40.2(C-16),29.0(C-17),17.1(C-18),20.9(C-19),23.8(C-20),26.1(C-21),29.9(C-22)。以上数据与文献[18]报道基本一致,故鉴定化合物11为3,7,11,15-tetramethyl-n-octadac-13-en-3,4,6,7,8,11-hexol-12-one。
化合物12白色针晶(CH3OH),mp.214~215 ℃;与三氯化铁反应生成黄色无定形沉淀。ESI-MS:m/z161 [M+Na]+。1H NMR(400 MHz,CD3OD)δ:7.48(2H,d,J= 8.1 Hz,H-2,H-6),6.77(2H,d,J= 8.1 Hz,H-3,H-5);13C NMR(100 MHz,CD3OD)δ:122.8(C-1),131.7(C-2),115.8(C-3),163.6(C-4),115.8(C-5),131.7(C-6),169.3(C-7)。以上数据与文献[19]报道基本一致,故鉴定化合物12为对羟基苯甲酸。
化合物13白色固体(CHCl3);三氯化铁反应呈紫色。ESI-MS:m/z191 [M+Na]+。1H NMR(400 MHz,CDCl3)δ:10.95(1H,s,4-OH),7.74(1H,d,J= 8.5 Hz,H-6),6.39(1H,d,J= 6.3 Hz,H-5),6.36(1H,s,H-3),3.91(3H,s,7-OCH3);13C NMR(100 MHz,CDCl3)δ:105.8(C-1),162.1(C-2),103.1(C-3),163.7(C-4),107.8(C-5),131.9(C-6),170.3(C-7),52.0(7-OCH3)。以上数据与文献[20]报道基本一致,故鉴定化合物13为2,4-二羟基苯甲酸甲酯。
化合物14白色粉末(CHCl3);浓硫酸-香草醛反应显棕黑色。ESI-MS:m/z171 [M+Na]+。1H NMR(400 MHz,CDCl3)δ:7.79(1H,d,J= 15.8 Hz,H-3),7.56(2H,m,H-2′,H-6′),7.42(3H,m,H-3′,H-4′,H-5′),6.47(1H,d,J= 15.8 Hz,H-2);13C NMR(100 MHz,CDCl3)δ:171.1(C-1),117.3(C-2),147.1(C-3),134.2(C-1′),129.1(C-2′),128.5(C-3′),130.8(C-4′),128.5(C-5′),129.1(C-6′)。以上数据与文献[21]报道基本一致,故鉴定化合物14为桂皮酸。
化合物15白色粉末(CH3OH);ESI-MS:m/z177 [M+Na]+。1H NMR(400 MHz,CD3OD)δ:7.45(1H,d,J= 8.6 Hz,H-6),7.42(1H,s,H-2),6.82(1H,d,J= 8.4 Hz,H-5);13C NMR(100 MHz,CD3OD)δ:123.2(C-1),115.8(C-2),146.0(C-3),151.5(C-4),117.7(C-5),123.9(C-6),170.3(C-7)。以上数据与文献[22]报道基本一致,故鉴定化合物15为3,4-二羟基苯甲酸。
2.2 抗RSV及HSV-1活性筛选结果
对长萼爵床中分离得到的15个化合物的抗RSV和HSV-1活性进行筛选,分别以利巴韦林、阿昔洛韦为阳性对照。结果显示,化合物1~15均未表现出抗RSV和HSV-1活性(IC50> 100 μM)。
2.3 抗炎活性筛选结果
本试验采用Griess法检测对LPS诱导下RAW 264.7巨噬细胞分泌NO的抑制作用。结果表明,化合物1~7、14对LPS诱导的RAW264.7巨噬细胞分泌NO的释放均显示一定的抑制作用。结果如表1所示。
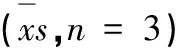
表1 化合物1~15抗炎活性筛选结果Table 1 Anti-inflammatory activities of compounds 1-15 = 3)
3 结论
本实验对厄瓜多尔药用植物长萼爵床中的化学成分进行了研究,对其95%乙醇提取物进行了化合物的分离和鉴定,从中分离、鉴定出了15个化合物,包括三萜类、木脂素类、脂肪酸类、苯甲酸类化合物及其他类化合物,所有化合物均是首次从该植物中分离得到。本实验深入地了解该植物的化学成分,提供了长萼爵床更为丰富的化学信息。据文献报道[2-5],该属植物有抗病毒活性和抗炎活性,本文对分离得到的15个化合物的抗RSV和HSV-1活性进行测试,与阳性对照组相比,化合物1~15均未表现出抗RSV和HSV-1活性;经抗炎活性筛选发现,化合物1~7、14有较好的抑制NO生成的活性。对于长萼爵床中抗病毒、抗炎活性的化学成分还需进一步的探索与研究,为更好地开发利用该植物、丰富该植物化学成分的种类和探究其有效活性成分奠定了一定的理论基础。

